Содержание
- 2. 4. Термодинамика (т/д) В своём развитии пришла к основным обобщениям – началам (законам) т/д. Всё остальное
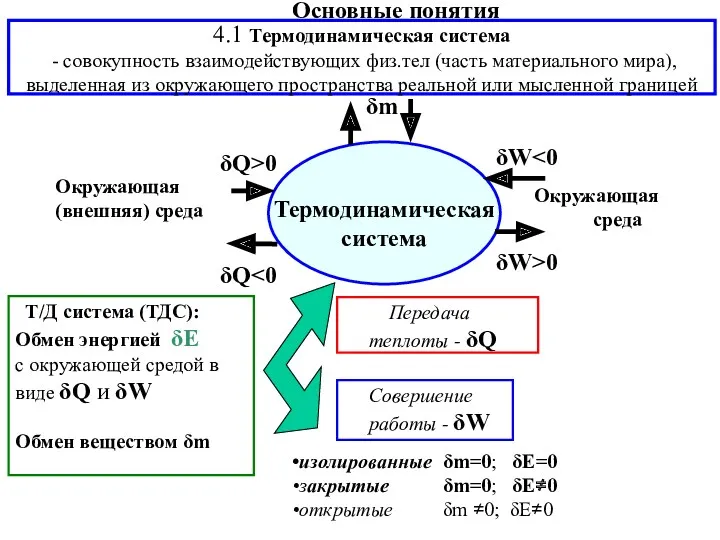
- 3. Передача теплоты - δQ Совершение работы - δW изолированные δm=0; δE=0 закрытые δm=0; δE≠0 открытые δm
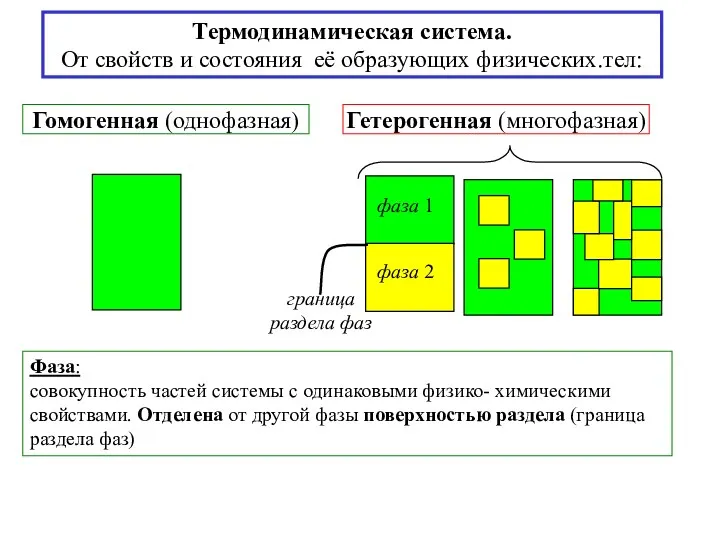
- 4. Фаза: совокупность частей системы с одинаковыми физико- химическими свойствами. Отделена от другой фазы поверхностью раздела (граница
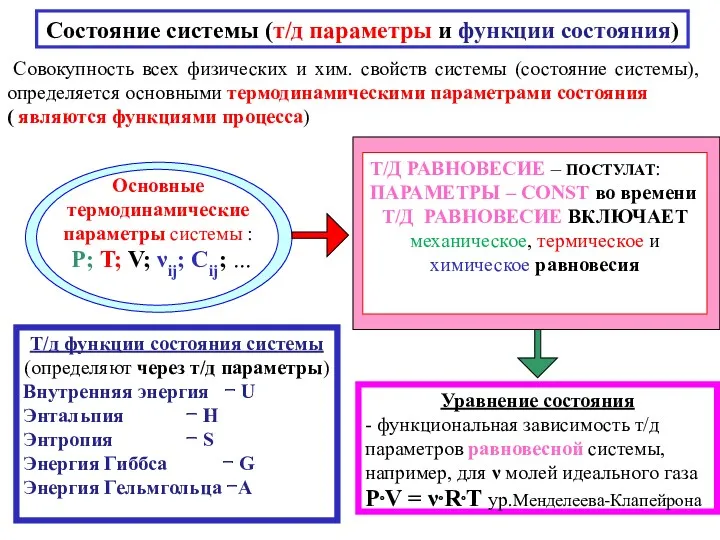
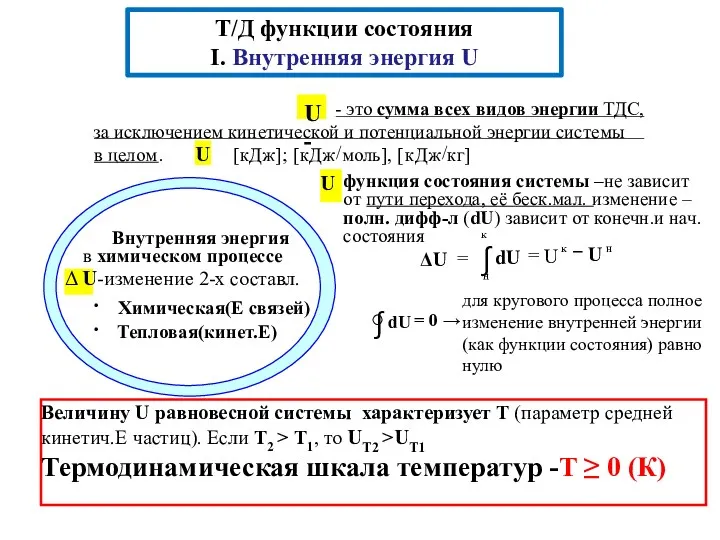
- 5. Т/д функции состояния системы (определяют через т/д параметры) Внутренняя энергия − U Энтальпия − H Энтропия
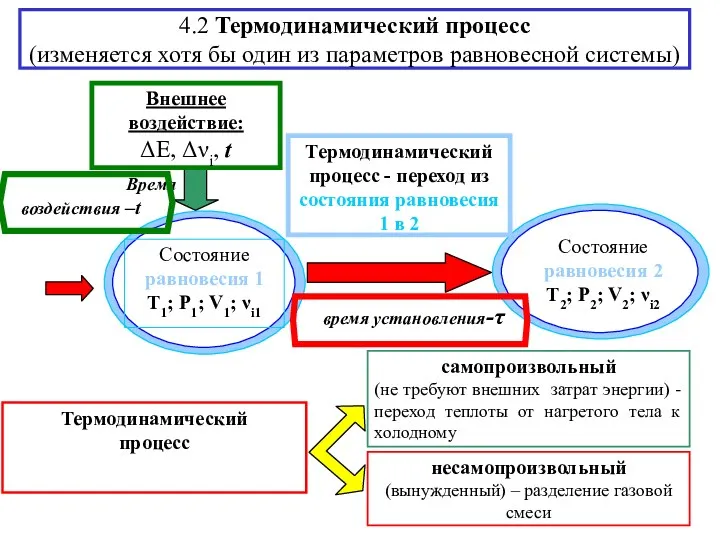
- 6. 4.2 Термодинамический процесс (изменяется хотя бы один из параметров равновесной системы)
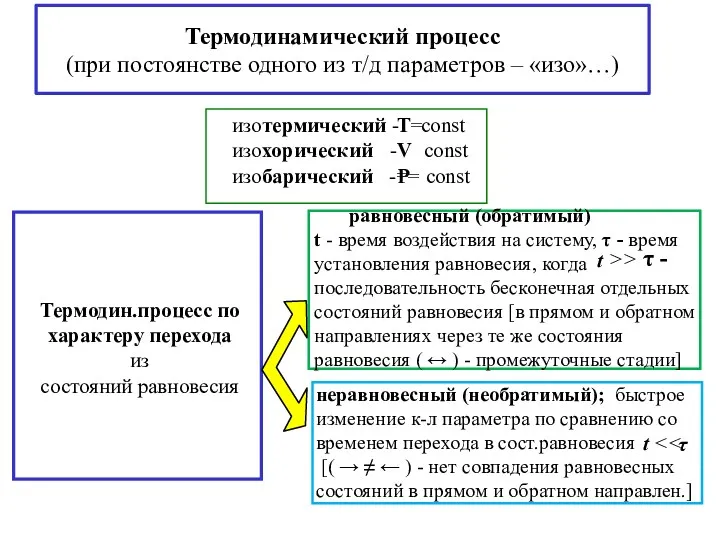
- 7. Термодинамический процесс (при постоянстве одного из т/д параметров – «изо»…)
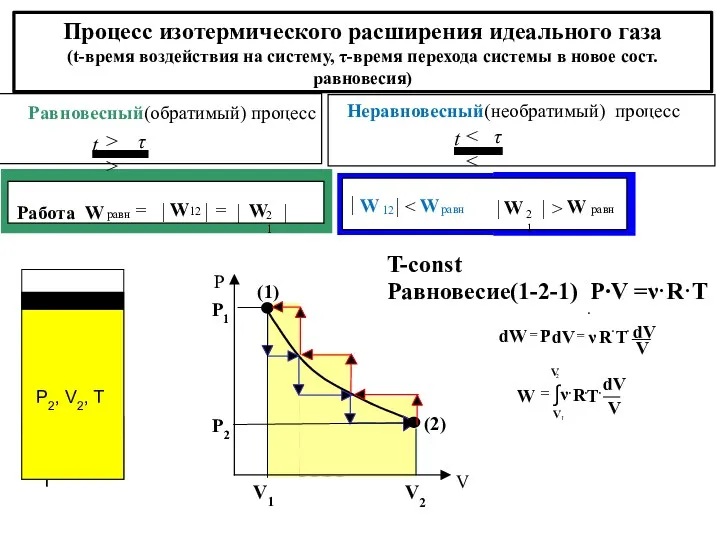
- 8. T-const Процесс изотермического расширения идеального газа (t-время воздействия на систему, τ-время перехода системы в новое сост.равновесия)
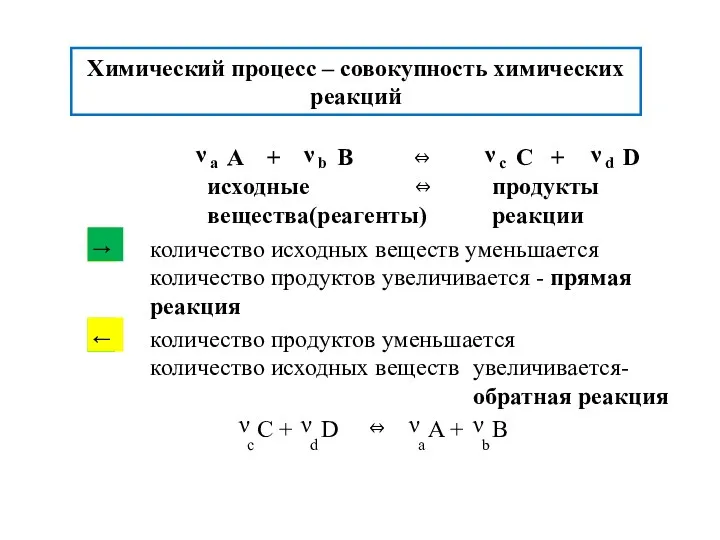
- 9. Химический процесс – совокупность химических реакций
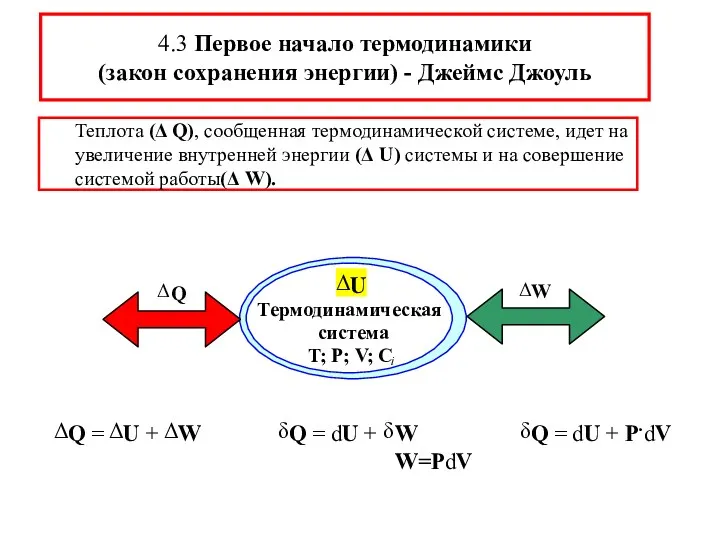
- 10. Теплота (Δ Q), сообщенная термодинамической системе, идет на увеличение внутренней энергии (Δ U) системы и на
- 11. Величину U равновесной системы характеризует Т (параметр средней кинетич.Е частиц). Если Т2 > Т1, то UТ2
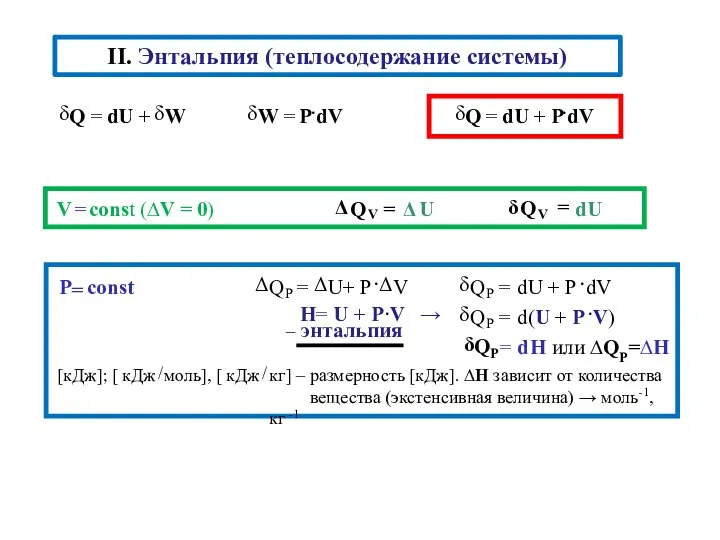
- 12. II. Энтальпия (теплосодержание системы)
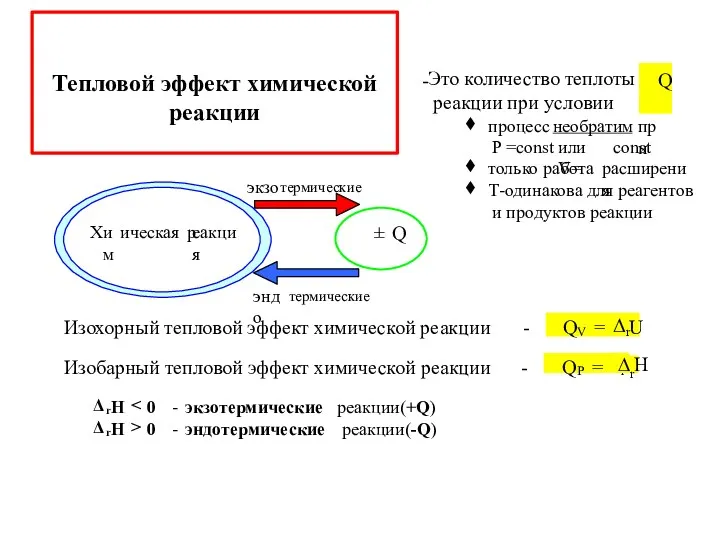
- 13. Тепловой эффект химической реакции
- 14. Закон Гесса «тепловой эффект реакции зависит только от вида и состояния исходных веществ и конечных продуктов
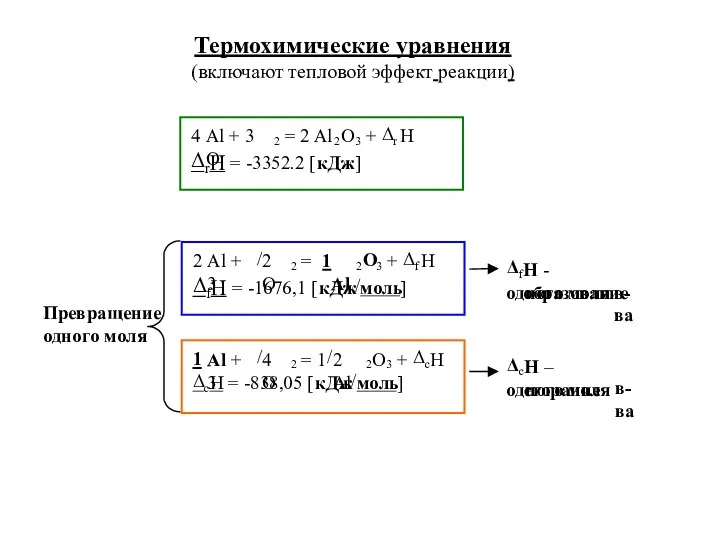
- 15. Термохимические уравнения (включают тепловой эффект реакции)
- 16. Стандартные условия: Р0 = 1,013⋅105 Па Т0 = 298,15 К С0 = 1моль/л ΔrН0298 стандартная энтальпия(тепловой
- 17. Следствие из закона Гесса: ΔrН0298 = (∑ νiΔfН0i)продукты – (∑ νiΔfН0i)исходные вещества Пример. реакция : CH4
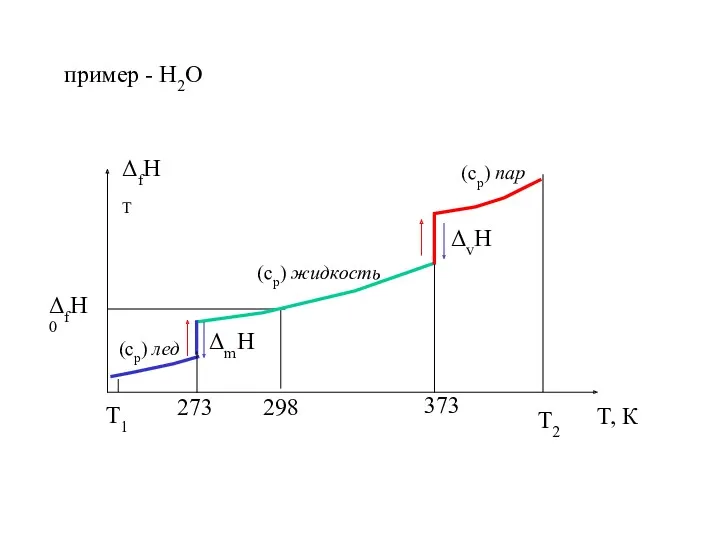
- 18. Зависимость теплового эффекта реакции от температуры
- 19. пример - Н2О T2 T1
- 20. Второе начало термодинамики δQ - TdS ≤ 0; δQ из 1-го начала, тогда dU + p⋅dV
- 21. III. Энтропия и т/д вероятность W1= 1 W2= 4 W3= 6 W4= 4 W5= 1 1
- 22. S = k⋅lnW k = 1,38⋅10-23Дж/К – постоянная Больцмана (k = R/NА) W – термодинамическая вероятность
- 23. В изолированной системе самопроизвольно будут протекать процессы с увеличением термодинамической вероятности, а состояние равновесия соответствует состоянию
- 24. S [Дж/К] стандартная - S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии
- 25. IV. Энергия Гиббса (изобарно-изотермический потенциал) Направление химического процесса
- 26. Энергия Гиббса реакции Стандартная энергия Гиббса (образования) вещества ΔG0298 ΔrG0298 = (∑ νi⋅ΔfG0i)продукты – (∑ νi⋅ΔfG0i)исходные
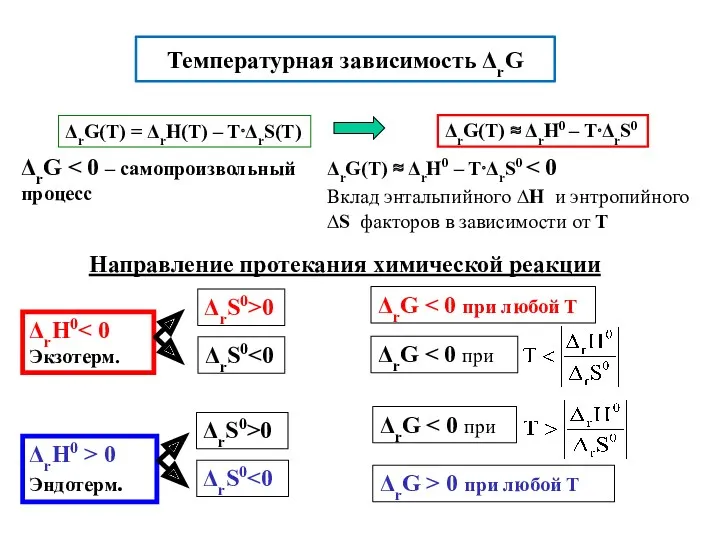
- 27. Температурная зависимость ΔrG Направление протекания химической реакции
- 28. Энергия Гиббса реакции в нестандартных условиях С ≠С0 ΔrGi =ΔrG0i + R⋅T⋅lnCi ΔrG = (νc⋅ΔfG0C+ νd⋅ΔfG0D
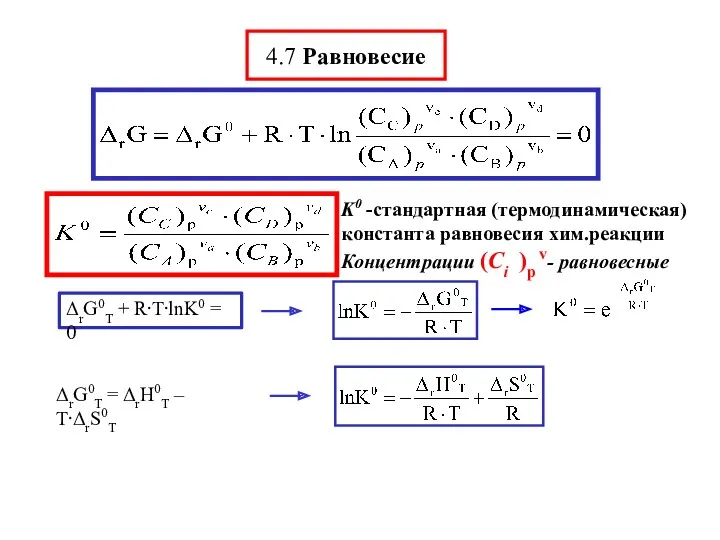
- 29. 4.7 Равновесие
- 31. Скачать презентацию









![S [Дж/К] стандартная - S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372264/slide-23.jpg)



 Соединения химических элементов. Урок-игра. 8 класс
Соединения химических элементов. Урок-игра. 8 класс Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Химическая связь
Химическая связь Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6
Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6 большая стирка
большая стирка Алкадиены. Гомологический ряд, номенклатура и изомерия
Алкадиены. Гомологический ряд, номенклатура и изомерия Химическая связь
Химическая связь Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату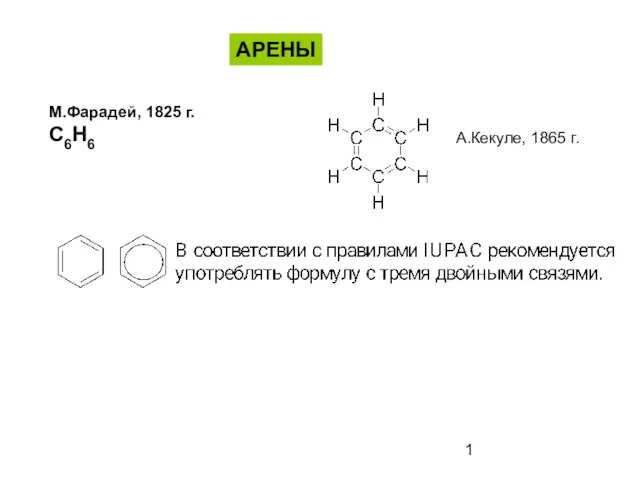 Ароматические соединения - арены
Ароматические соединения - арены Водородная связь
Водородная связь Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей Атомный и ионный радиусы. Принципы шаровых упаковок
Атомный и ионный радиусы. Принципы шаровых упаковок Азот и его соединения
Азот и его соединения Технология оптического стекла
Технология оптического стекла Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Электрохимические процессы
Электрохимические процессы Простые вещества
Простые вещества Кислород
Кислород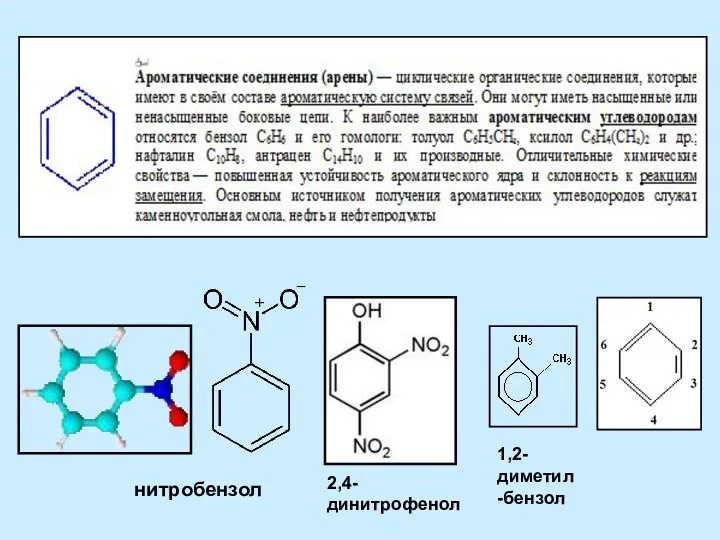 Ароматические соединения (арены)
Ароматические соединения (арены) Алкалоидтар
Алкалоидтар Лекция 2. Строение атома и Периодический закон Д.И. Менделеева
Лекция 2. Строение атома и Периодический закон Д.И. Менделеева Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Химия в строительстве
Химия в строительстве Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Углерод
Углерод