Содержание
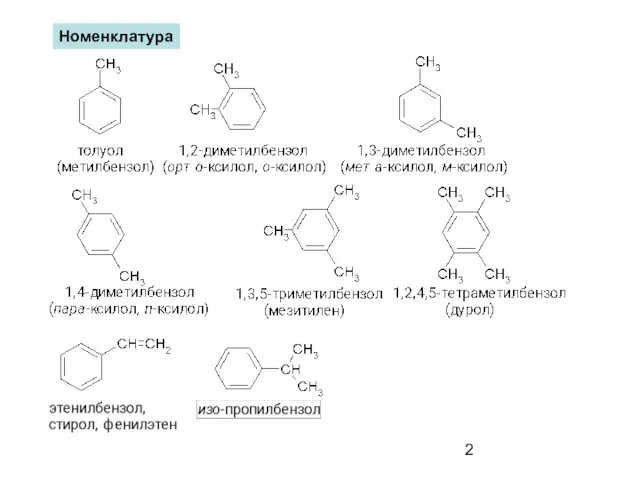
- 2. Номенклатура
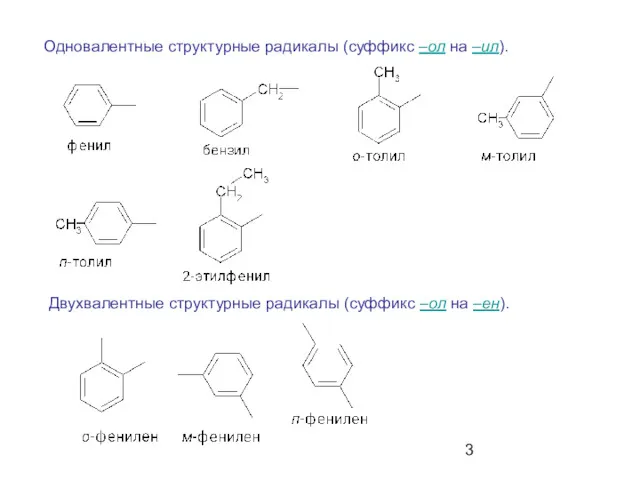
- 3. Одновалентные структурные радикалы (суффикс –ол на –ил). Двухвалентные структурные радикалы (суффикс –ол на –ен).
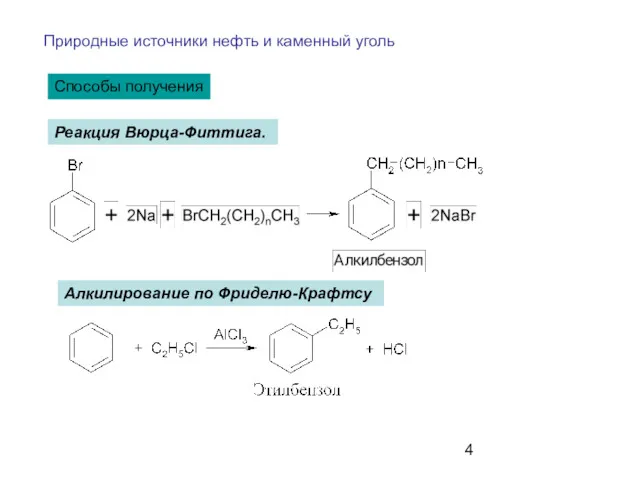
- 4. Способы получения Природные источники нефть и каменный уголь Реакция Вюрца-Фиттига. Алкилирование по Фриделю-Крафтсу
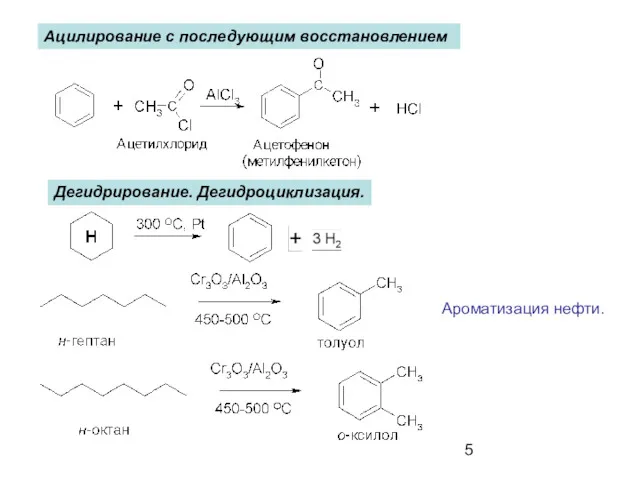
- 5. Ацилирование с последующим восстановлением Дегидрирование. Дегидроциклизация. Ароматизация нефти.
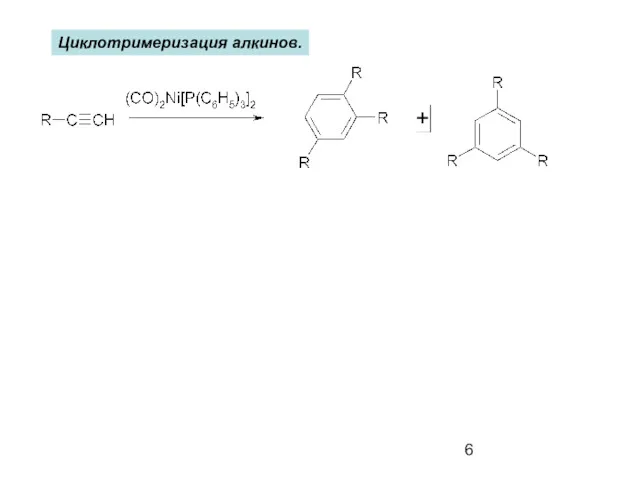
- 6. Циклотримеризация алкинов.
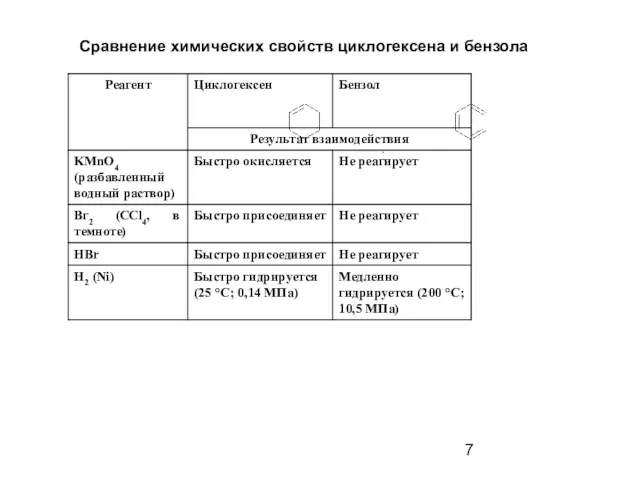
- 7. Сравнение химических свойств циклогексена и бензола
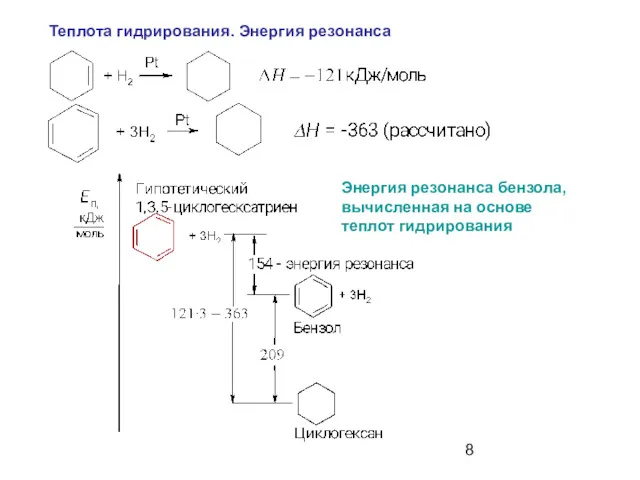
- 8. Теплота гидрирования. Энергия резонанса Энергия резонанса бензола, вычисленная на основе теплот гидрирования
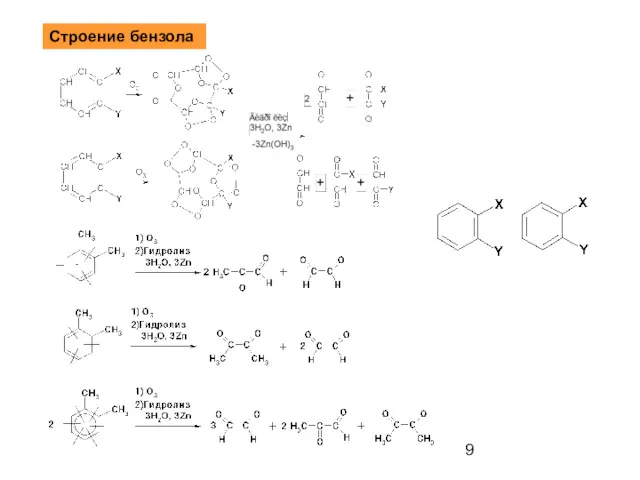
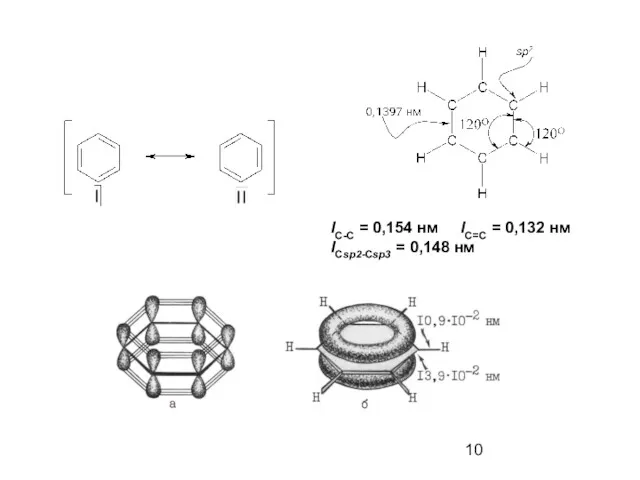
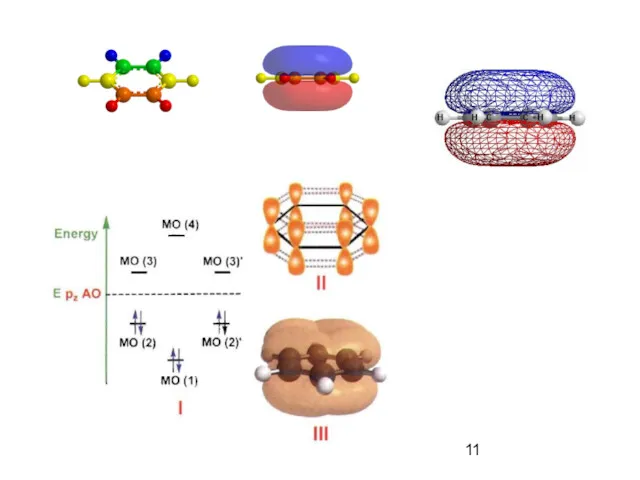
- 9. Строение бензола
- 10. lС-С = 0,154 нм lС=С = 0,132 нм lCsp2-Csp3 = 0,148 нм
- 12. Ароматичность. Правило Хюккеля. Ароматическими свойствами обладает соединение, если его строение удовлетворяет следующим требованиям: соединение включает в
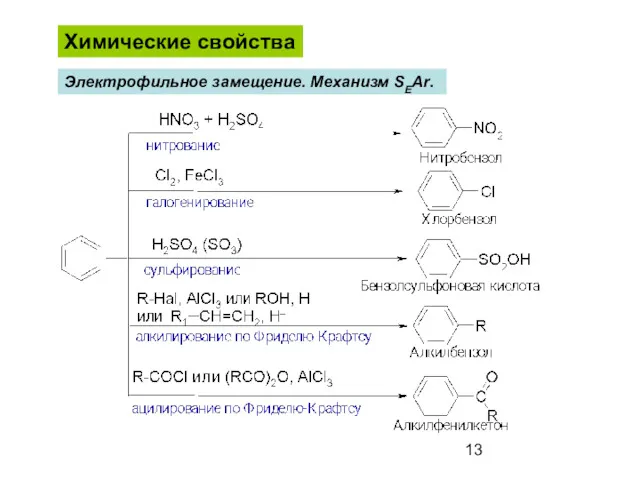
- 13. Химические свойства Электрофильное замещение. Механизм SEAr.
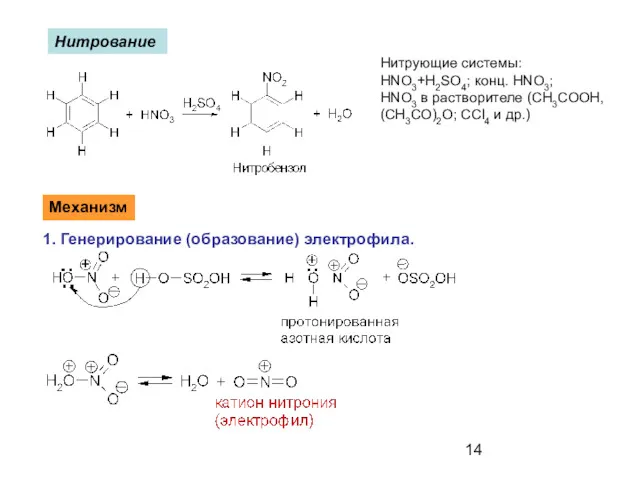
- 14. Нитрование Механизм 1. Генерирование (образование) электрофила. Нитрующие системы: HNO3+H2SO4; конц. HNO3; HNO3 в растворителе (CH3COOH, (CH3CO)2O;
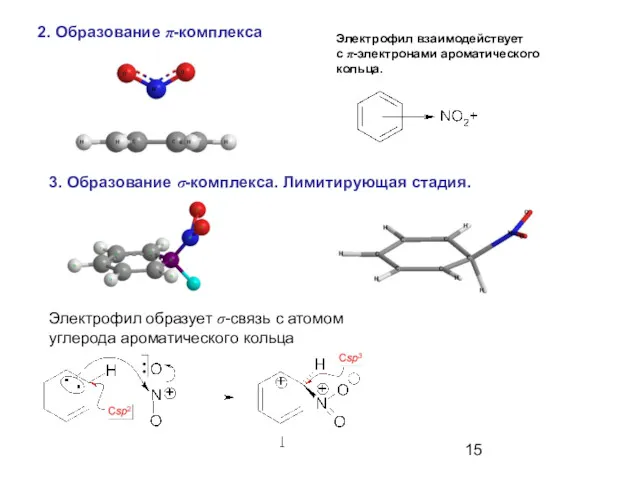
- 15. 2. Образование π-комплекса 3. Образование σ-комплекса. Лимитирующая стадия. Электрофил взаимодействует с π-электронами ароматического кольца. Электрофил образует
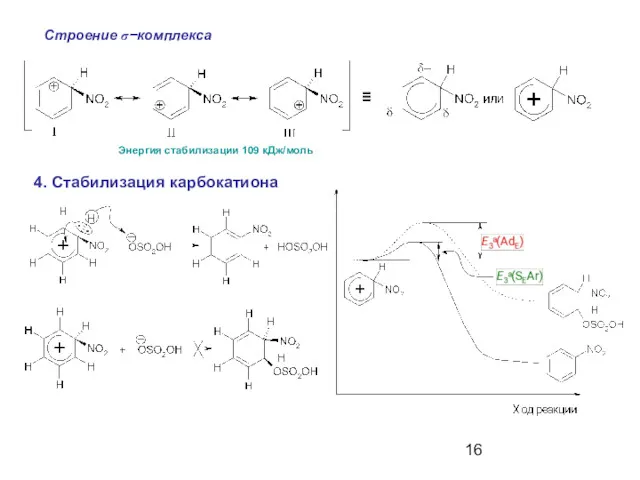
- 16. Строение σ−комплекса Энергия стабилизации 109 кДж/моль 4. Стабилизация карбокатиона ≡
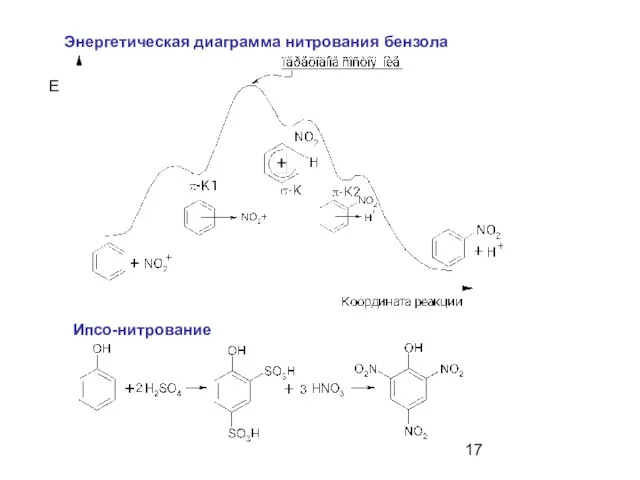
- 17. Энергетическая диаграмма нитрования бензола Е Ипсо-нитрование
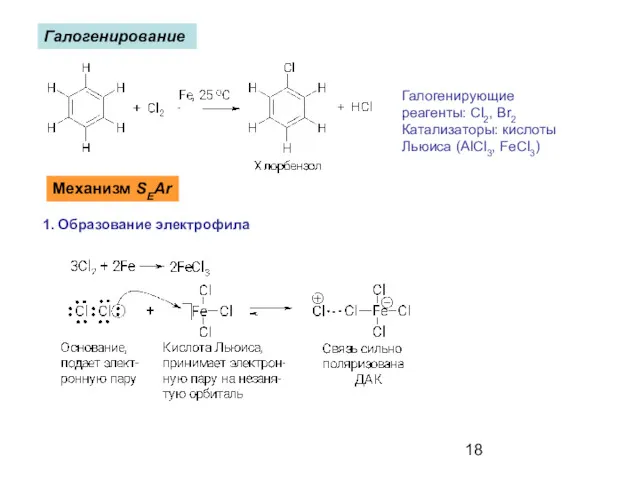
- 18. Галогенирование Галогенирующие реагенты: Cl2, Br2 Катализаторы: кислоты Льюиса (AlCl3, FeCl3) Механизм SEAr 1. Образование электрофила
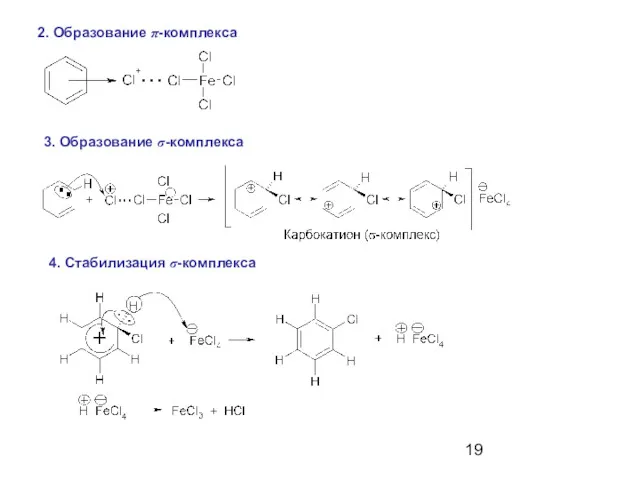
- 19. 2. Образование π-комплекса 3. Образование σ-комплекса 4. Стабилизация σ-комплекса
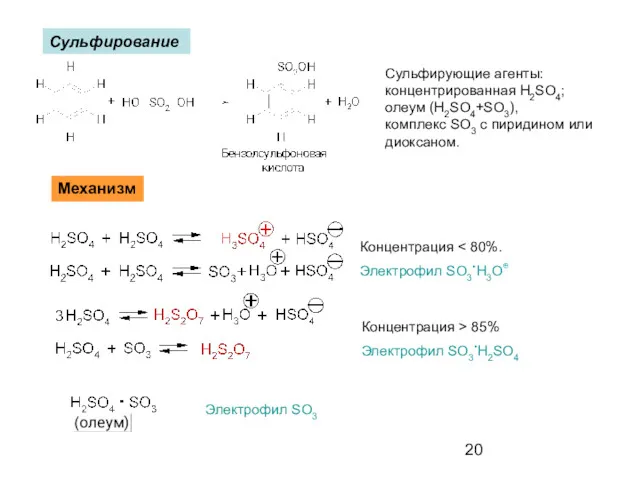
- 20. Сульфирование Сульфирующие агенты: концентрированная H2SO4; олеум (H2SO4+SO3), комплекс SO3 с пиридином или диоксаном. Механизм Концентрация Электрофил
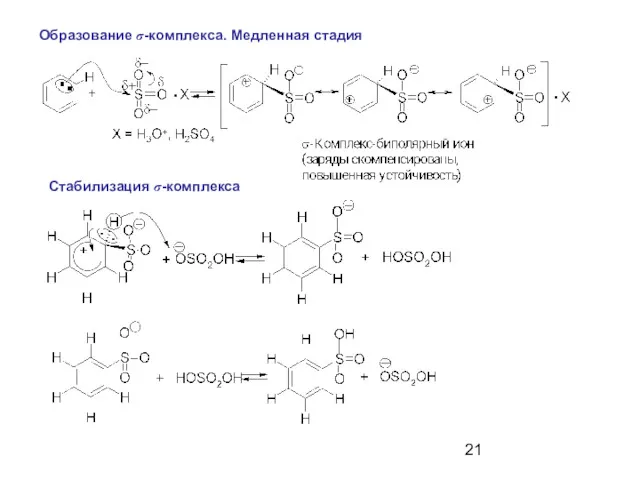
- 21. Образование σ-комплекса. Медленная стадия Стабилизация σ-комплекса
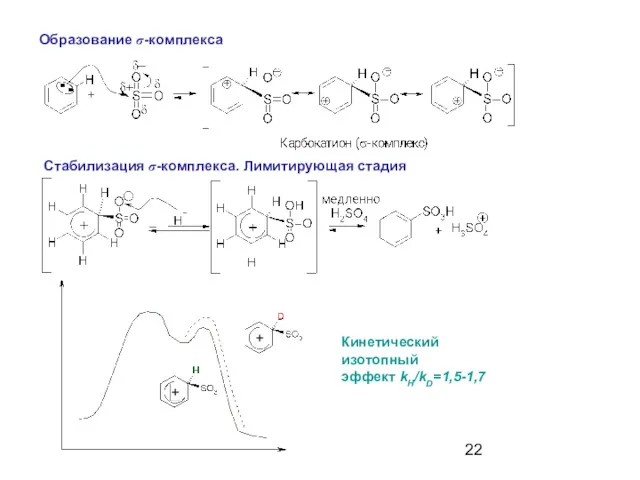
- 22. Образование σ-комплекса Стабилизация σ-комплекса. Лимитирующая стадия Кинетический изотопный эффект kH/kD=1,5-1,7
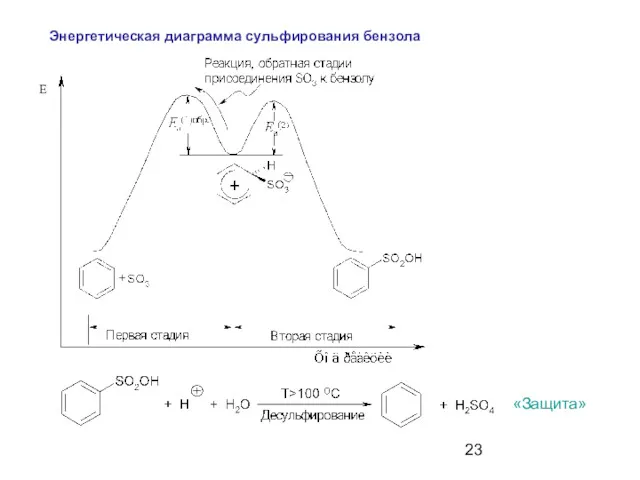
- 23. E Энергетическая диаграмма сульфирования бензола «Защита»
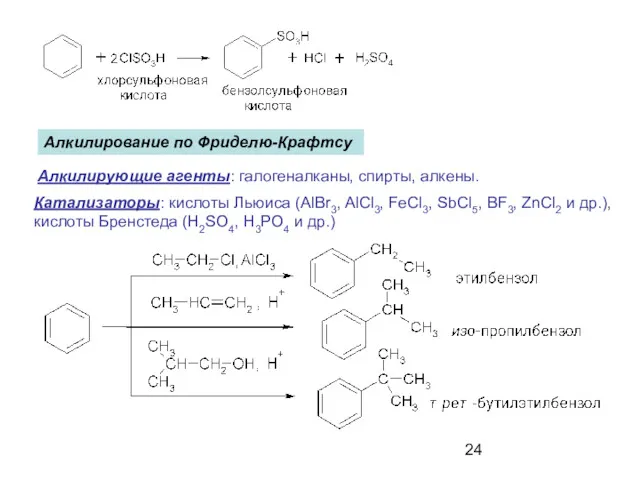
- 24. Алкилирование по Фриделю-Крафтсу Алкилирующие агенты: галогеналканы, спирты, алкены. Катализаторы: кислоты Льюиса (AlBr3, AlCl3, FeCl3, SbCl5, BF3,
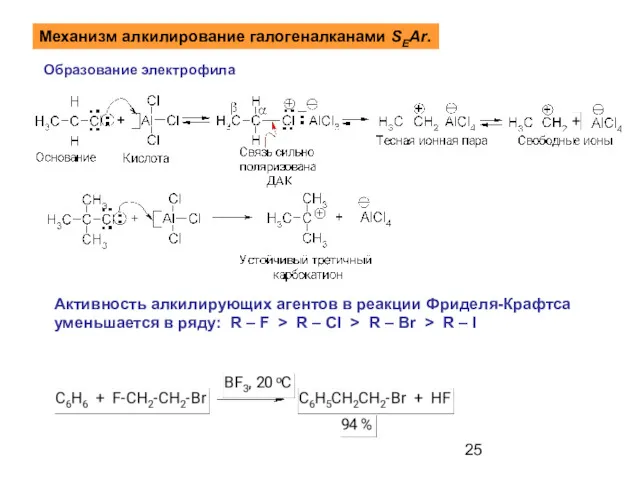
- 25. Механизм алкилирование галогеналканами SEAr. Образование электрофила Активность алкилирующих агентов в реакции Фриделя-Крафтса уменьшается в ряду: R
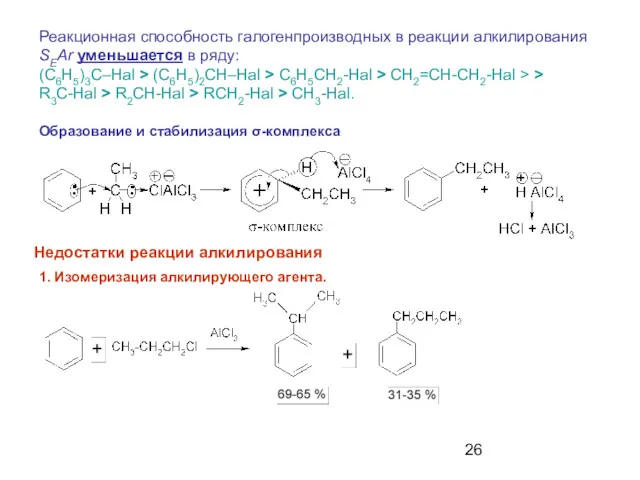
- 26. Образование и стабилизация σ-комплекса Недостатки реакции алкилирования 1. Изомеризация алкилирующего агента. Реакционная способность галогенпроизводных в реакции
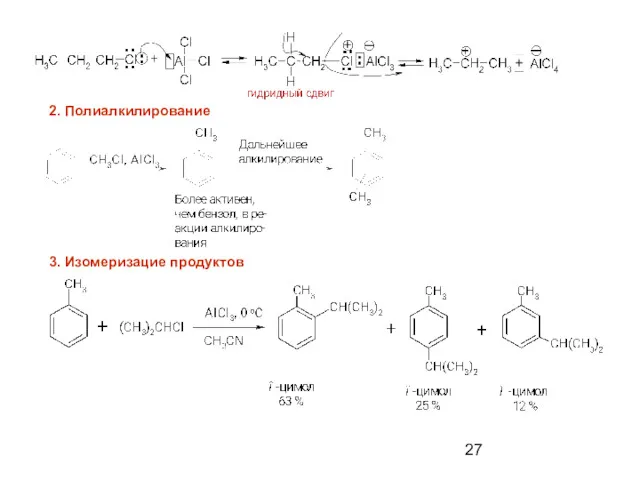
- 27. 2. Полиалкилирование 3. Изомеризацие продуктов
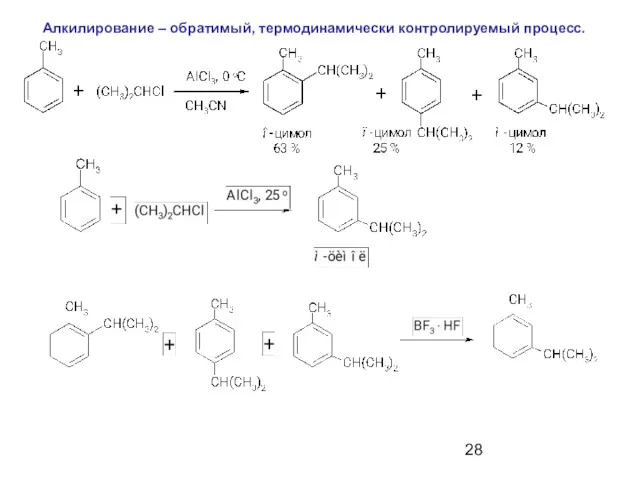
- 28. Алкилирование – обратимый, термодинамически контролируемый процесс.
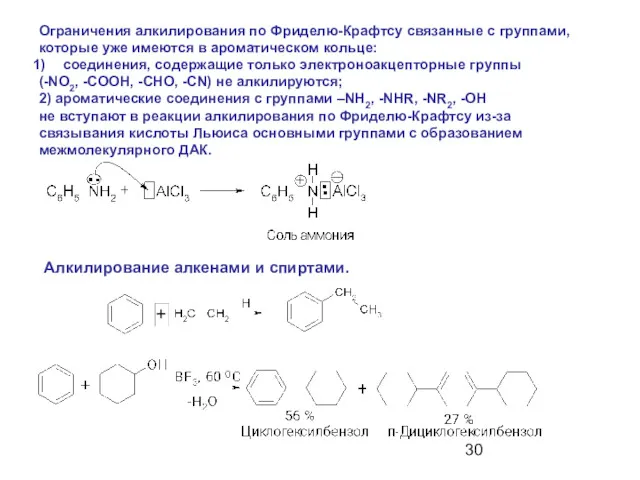
- 30. Ограничения алкилирования по Фриделю-Крафтсу связанные с группами, которые уже имеются в ароматическом кольце: соединения, содержащие только
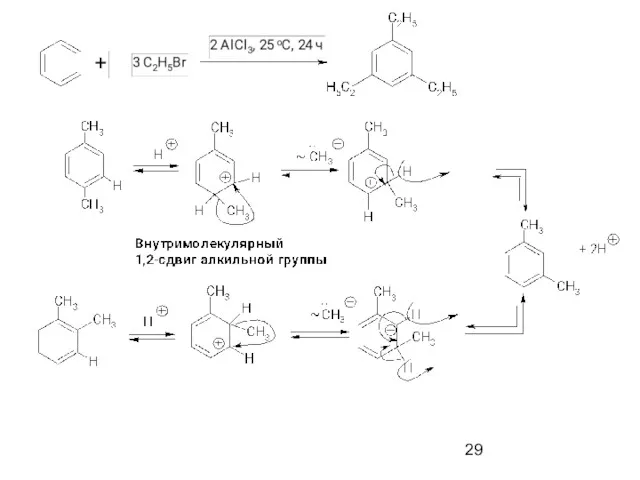
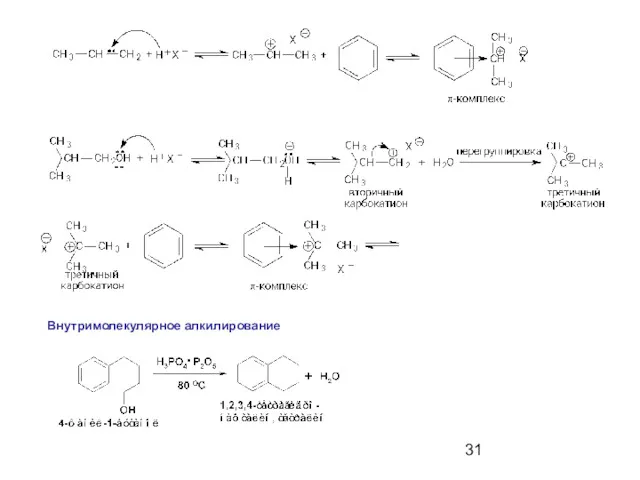
- 31. Внутримолекулярное алкилирование
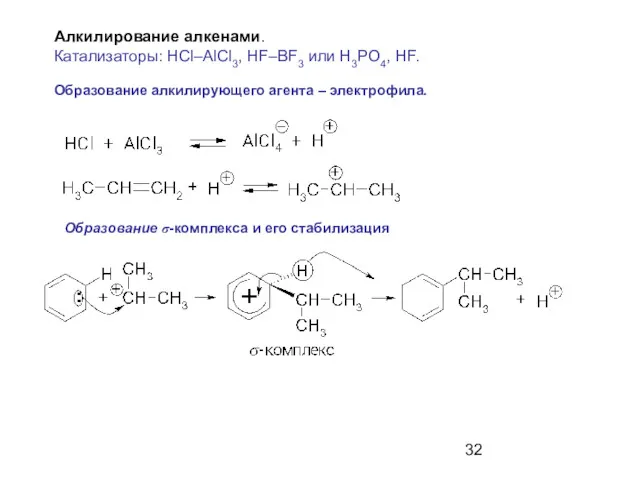
- 32. Алкилирование алкенами. Катализаторы: HCl–AlCl3, HF–BF3 или H3PO4, HF. Образование алкилирующего агента – электрофила. Образование σ-комплекса и
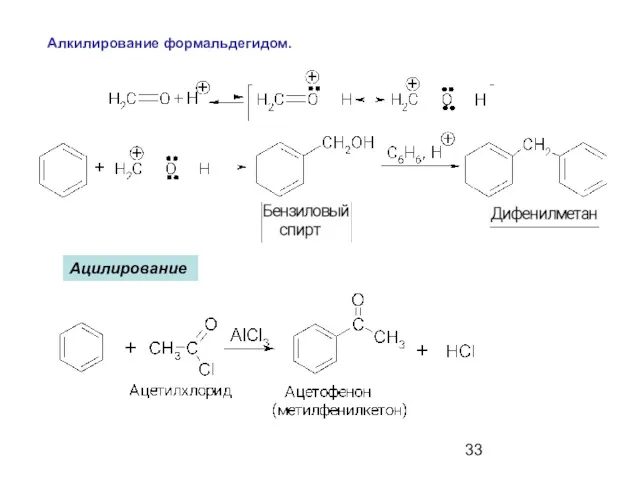
- 33. Алкилирование формальдегидом. Ацилирование
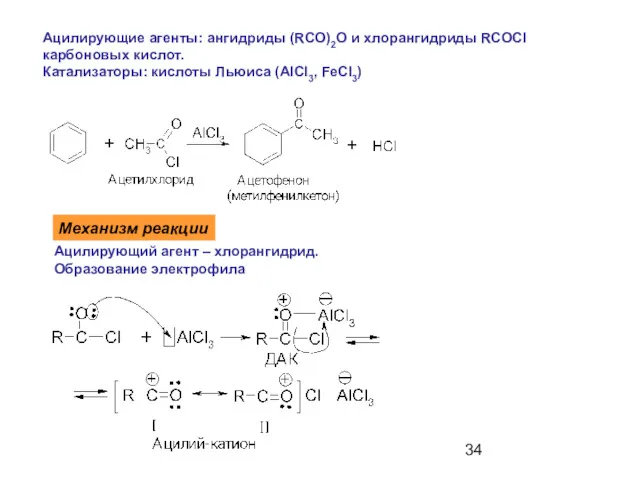
- 34. Ацилирующие агенты: ангидриды (RCO)2O и хлорангидриды RCOCl карбоновых кислот. Катализаторы: кислоты Льюиса (AlCl3, FeCl3) Механизм реакции
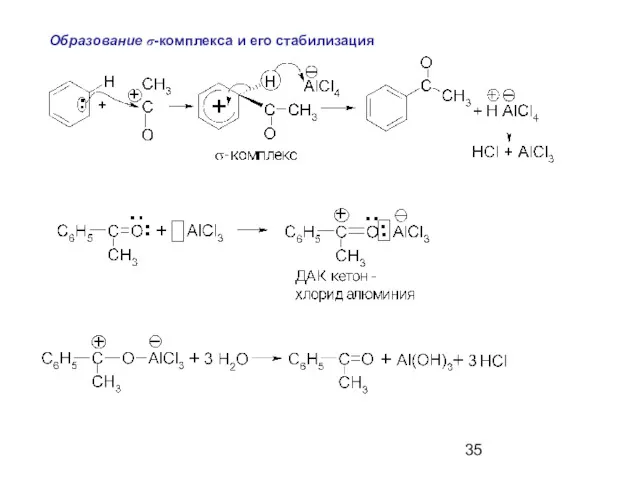
- 35. Образование σ-комплекса и его стабилизация
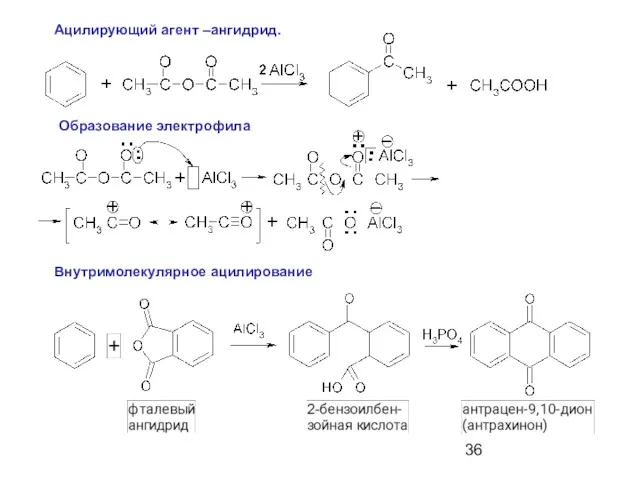
- 36. Ацилирующий агент –ангидрид. Образование электрофила Внутримолекулярное ацилирование
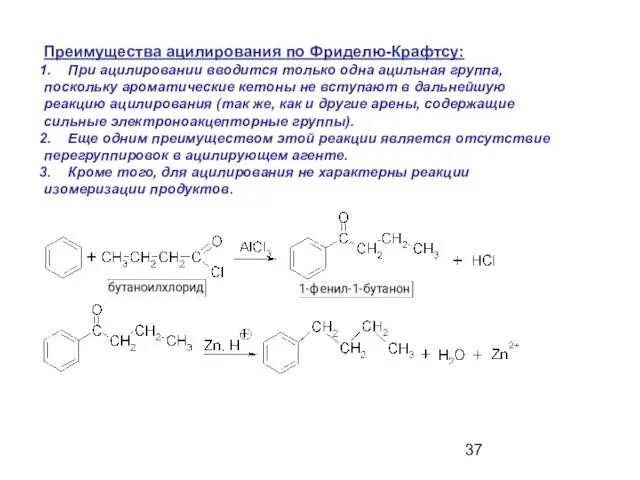
- 37. Преимущества ацилирования по Фриделю-Крафтсу: При ацилировании вводится только одна ацильная группа, поскольку ароматические кетоны не вступают
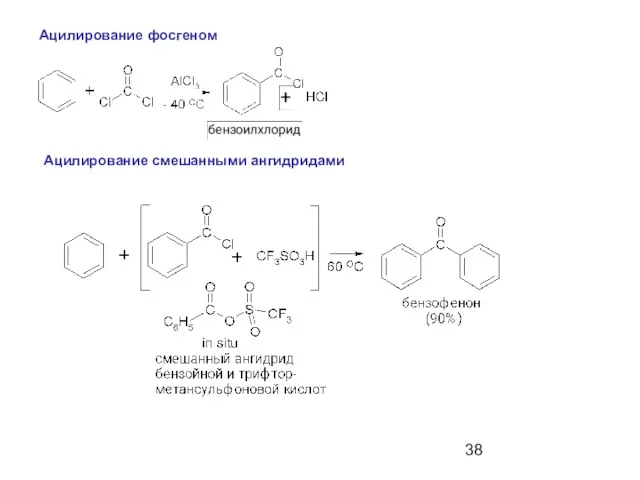
- 38. Ацилирование фосгеном Ацилирование смешанными ангидридами
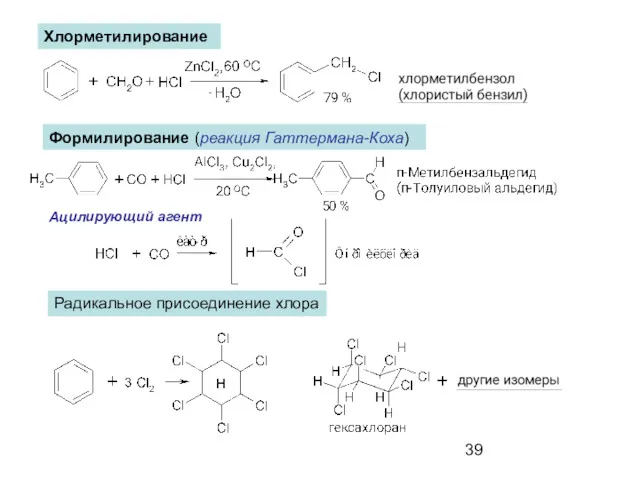
- 39. Хлорметилирование Формилирование (реакция Гаттермана-Коха) Ацилирующий агент Радикальное присоединение хлора
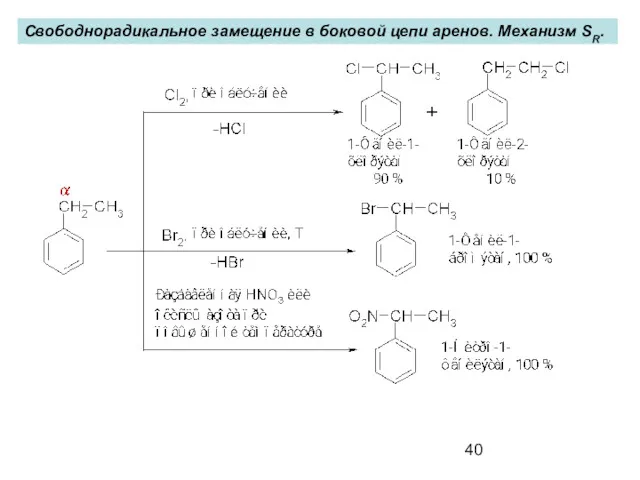
- 40. Свободнорадикальное замещение в боковой цепи аренов. Механизм SR.
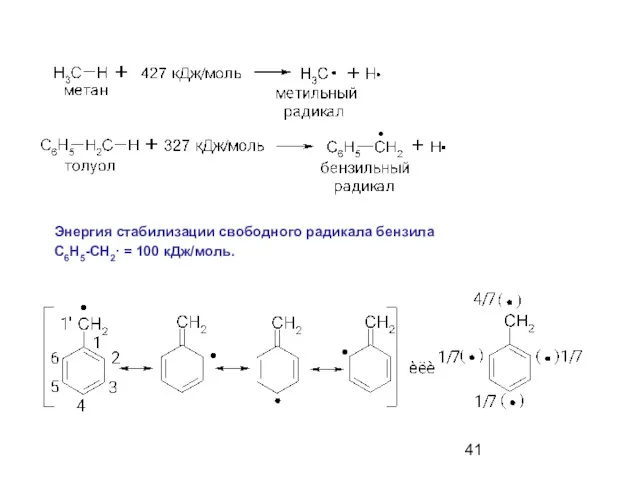
- 41. Энергия стабилизации свободного радикала бензила С6Н5-СН2∙ = 100 кДж/моль.
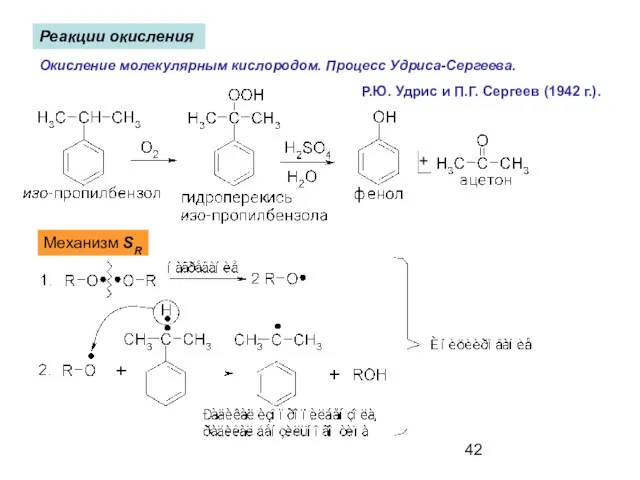
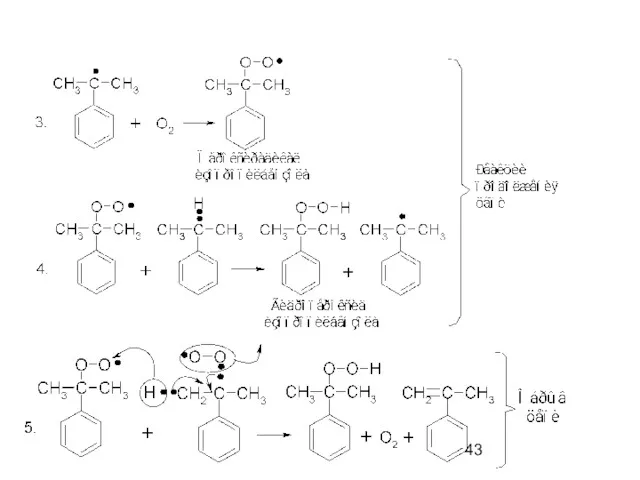
- 42. Реакции окисления Окисление молекулярным кислородом. Процесс Удриса-Сергеева. Механизм SR Р.Ю. Удрис и П.Г. Сергеев (1942 г.).
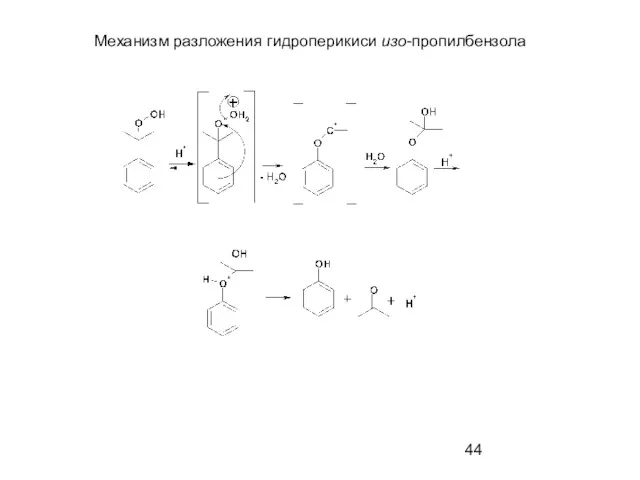
- 44. Механизм разложения гидроперикиси изо-пропилбензола
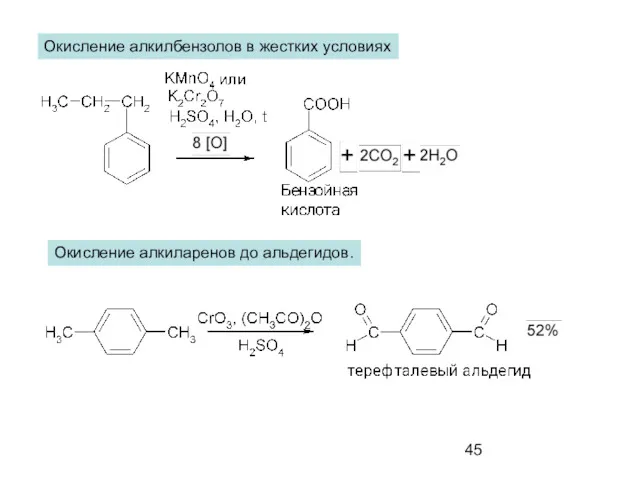
- 45. Окисление алкилбензолов в жестких условиях Окисление алкиларенов до альдегидов.
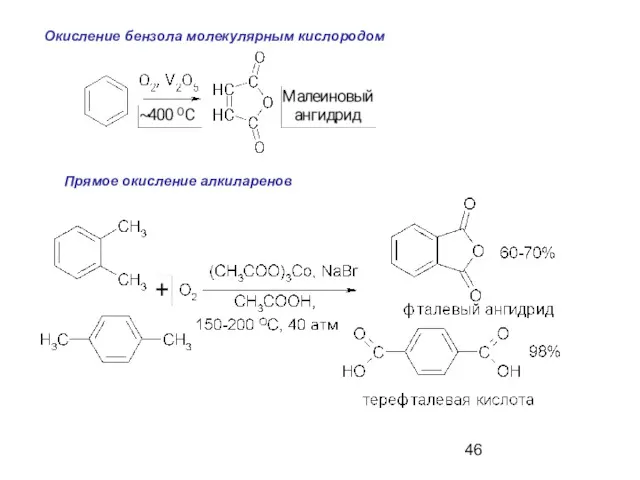
- 46. Окисление бензола молекулярным кислородом Прямое окисление алкиларенов
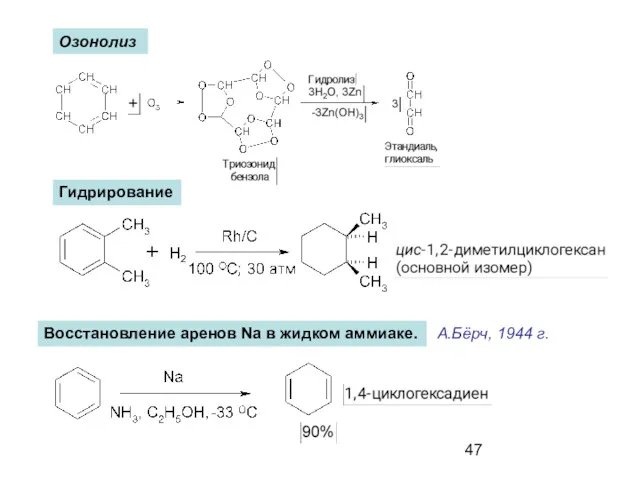
- 47. Озонолиз Гидрирование Восстановление аренов Na в жидком аммиаке. А.Бёрч, 1944 г.
- 49. Скачать презентацию

 Композиционные материалы
Композиционные материалы Биохимическая трансформация веществ (2)
Биохимическая трансформация веществ (2) Методы выращивания монокристаллов кремния. Сравнение. Сферы применения монокристаллов, выращенных различными методами
Методы выращивания монокристаллов кремния. Сравнение. Сферы применения монокристаллов, выращенных различными методами Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева
Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева Р-элементы IV Группы Периодической Системы
Р-элементы IV Группы Периодической Системы Польза и вред химического производства
Польза и вред химического производства Мир камня. Чувашский национальный музей
Мир камня. Чувашский национальный музей Свойства растворов электролитов
Свойства растворов электролитов Растворы электролитов. Ионизация воды и шкала рН
Растворы электролитов. Ионизация воды и шкала рН Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне Физико-химические свойства аммиака. Производство аммиака
Физико-химические свойства аммиака. Производство аммиака Происхождение химических элементов
Происхождение химических элементов Химические реакции. Закон сохранения массы веществ
Химические реакции. Закон сохранения массы веществ Химические формулы
Химические формулы Химическая промышленность
Химическая промышленность Строение атома углерода. Валентные состояния атома углерода
Строение атома углерода. Валентные состояния атома углерода Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие Приёмы обращения с лабораторным оборудованием и основы техники безопасности
Приёмы обращения с лабораторным оборудованием и основы техники безопасности Основные типы химический реакций
Основные типы химический реакций Процессы нитрования
Процессы нитрования Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер
Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Хімічна рівновага
Хімічна рівновага Растворы. Роль растворов в природе
Растворы. Роль растворов в природе Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Молекулы и атомы
Молекулы и атомы Нефть
Нефть Ионная связь и степень окисления. 8 класс
Ионная связь и степень окисления. 8 класс