Содержание
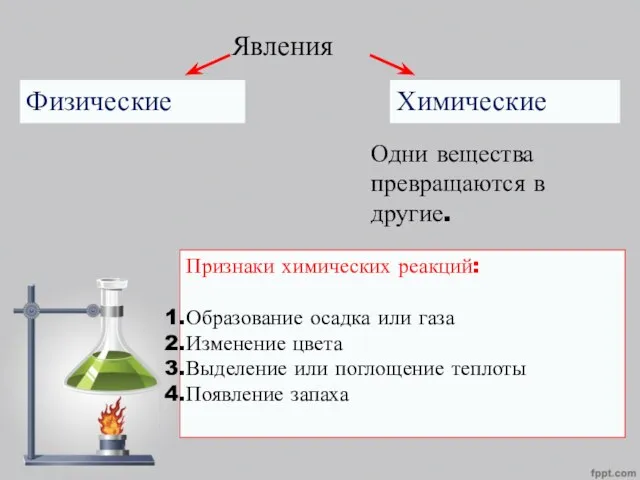
- 2. Явления Физические Химические Одни вещества превращаются в другие. Признаки химических реакций: Образование осадка или газа Изменение
- 3. Реакции, протекающие с выделением теплоты и света, называют реакциями горения. Горение магния Горение серы
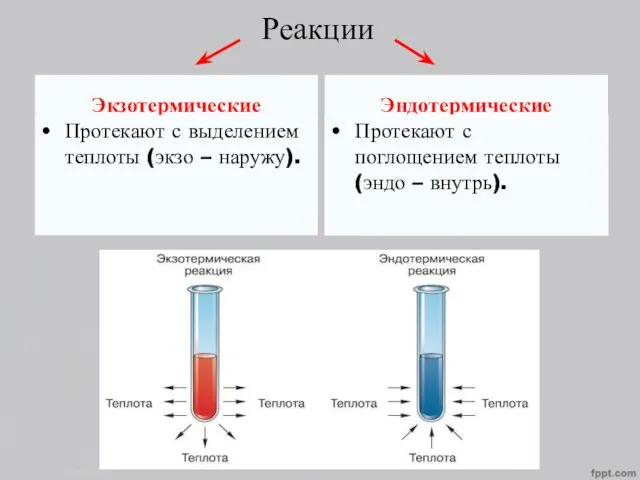
- 4. Реакции Экзотермические Протекают с выделением теплоты (экзо – наружу). Эндотермические Протекают с поглощением теплоты (эндо –
- 5. Эндотермическая реакция Реакция разложения ртути
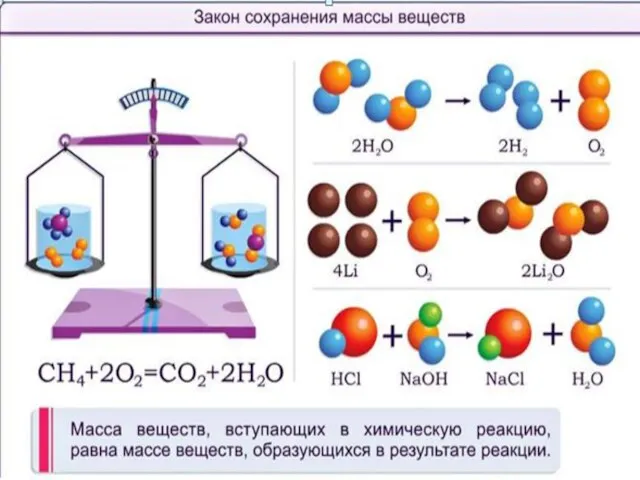
- 6. Закон сохранения массы веществ
- 7. В печи сожгли уголь массой 10кг, а масса образовавшейся золы составила всего 3кг. Почему?
- 8. В течение тысячелетий люди верили в то, что вещество может бесследно исчезать, а также возникать из
- 9. Бойль проделал множество опытов по прокаливанию металлов в незапаянных ретортах и всякий раз масса оказывалась больше
- 10. Подобно Бойлю русский ученый М.В.Ломоносов делал опыты в запаянных ретортах. Но, в отличие от Бойля, Ломоносов
- 13. Химические уравнения. Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
- 14. Исходные вещества, принимающие участие в химических реакциях называются реагентами. Новые вещества, образующиеся в результате химической реакции
- 15. Алгоритм составления уравнения химической реакции. P + O2 = Помните! Молекулы большинства простых газообразных веществ двухатомны
- 16. Расставьте коэффициенты в следующих уравнениях: СuCl2 + Al = AlCl3 + Cu 2) Н2 + N2
- 17. Уравнять следующие реакции: 1) Cl2O7 = Cl2 + O2 2) KClO3 = KCl + O2 3)
- 19. Скачать презентацию













 Разделение углеводородных газов
Разделение углеводородных газов Бутадиеновые каучуки
Бутадиеновые каучуки Решение заданий по теме: Оксиды
Решение заданий по теме: Оксиды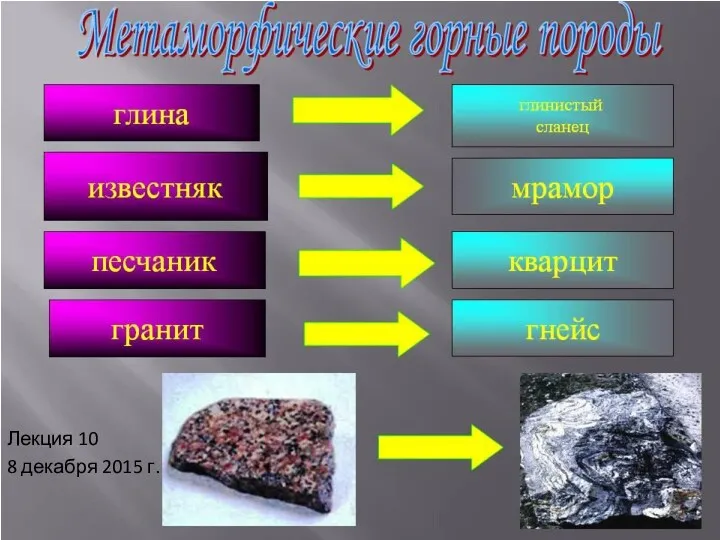 Метаморфические породы. (Лекция 10)
Метаморфические породы. (Лекция 10) Химический состав и физические свойства продовольственных товаров
Химический состав и физические свойства продовольственных товаров Контрольная работа. Разбор. 9 класс
Контрольная работа. Разбор. 9 класс Камни и Козерог
Камни и Козерог Поляризация электродов
Поляризация электродов Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Количество вещества. 8 класс
Количество вещества. 8 класс Методы определения механических свойств полимерных композиционных материалов
Методы определения механических свойств полимерных композиционных материалов Благородные металлы
Благородные металлы Золото. Что о нём мы можем рассказать?
Золото. Что о нём мы можем рассказать? Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл Скорость химических реакций
Скорость химических реакций Галогены (солеобразующие)
Галогены (солеобразующие) Техника безопасности для учащихся в кабинете химии
Техника безопасности для учащихся в кабинете химии Гидролиз солей
Гидролиз солей Влияние циклогексанола селективную очистку масляных фракций нефти N-метилпирролидоном (N-МП)
Влияние циклогексанола селективную очистку масляных фракций нефти N-метилпирролидоном (N-МП) Фенолдар. Анықтама
Фенолдар. Анықтама Витаминные препараты
Витаминные препараты 20230419_gidroliz_soley
20230419_gidroliz_soley Реакции ионного обмена
Реакции ионного обмена Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей
Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Химическая связь. Виды химической связи
Химическая связь. Виды химической связи Коррозия металлов. Методы защиты металлов от коррозии
Коррозия металлов. Методы защиты металлов от коррозии