Содержание
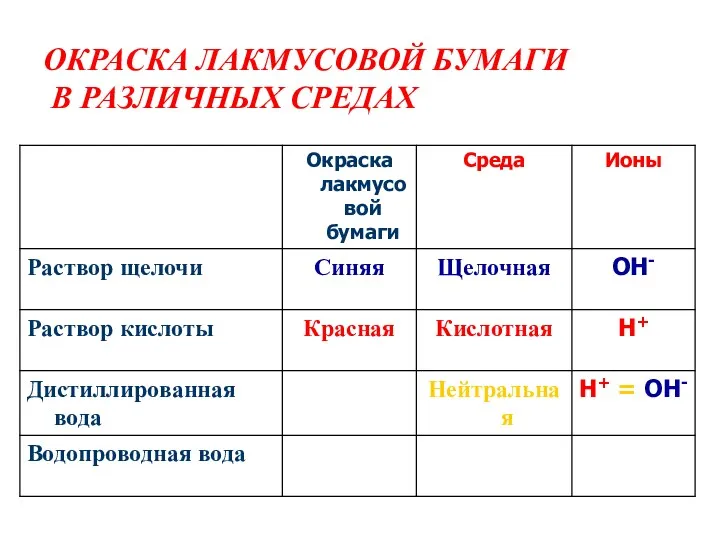
- 3. ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ
- 4. Гидролиз солей определение понятия «гидролиз» Цели: научиться объяснять химические процессы, протекающие в водных растворах солей записывать
- 5. «ГИДРОЛИЗ» - от греческого «гидро» - вода «лизис» - разложение
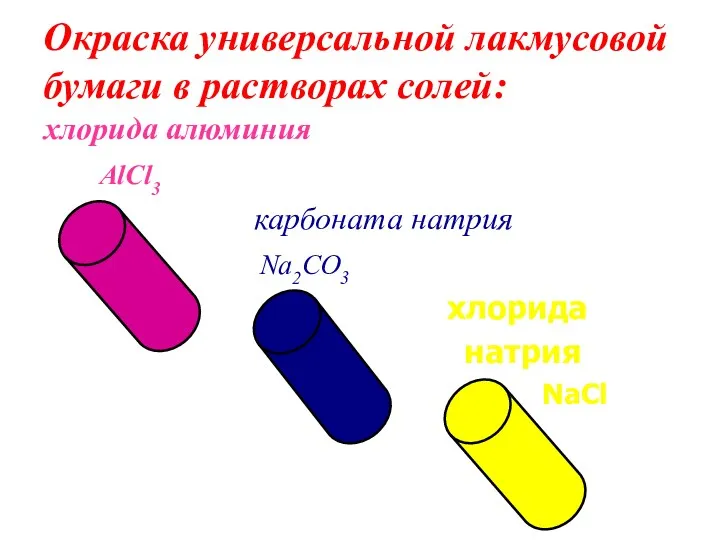
- 6. Окраска универсальной лакмусовой бумаги в растворах солей: хлорида алюминия AlCl3 карбоната натрия Na2CO3 хлорида натрия NaCl
- 7. Механизм гидролиза хлорида алюминия 1) Диссоциация молекул воды: H2O H+ + OH- 2) Диссоциация молекул соли
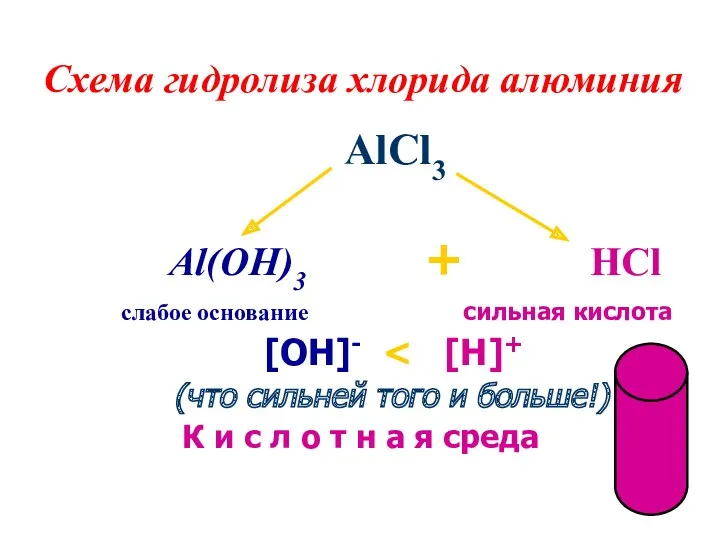
- 8. Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 + HCl слабое основание сильная кислота [OH]- (что сильней того
- 9. СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ Определить состав соли, то есть указать, каким по силе основанием и
- 10. Al3+ + HOH AlOH2+ + H+ AlCl3 + H2O AlOHCl2 + HCl Одним из продуктов данной
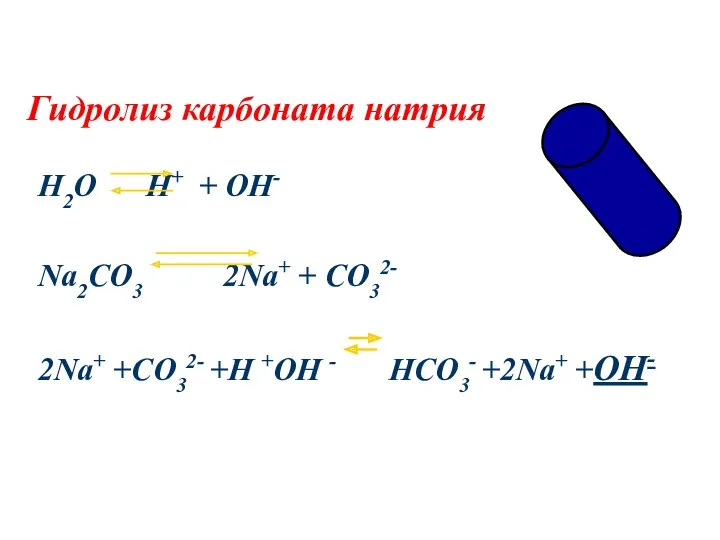
- 11. Гидролиз карбоната натрия H2O H+ + OH- Na2CO3 2Na+ + CO32- 2Na+ +CO32- +H +OH -
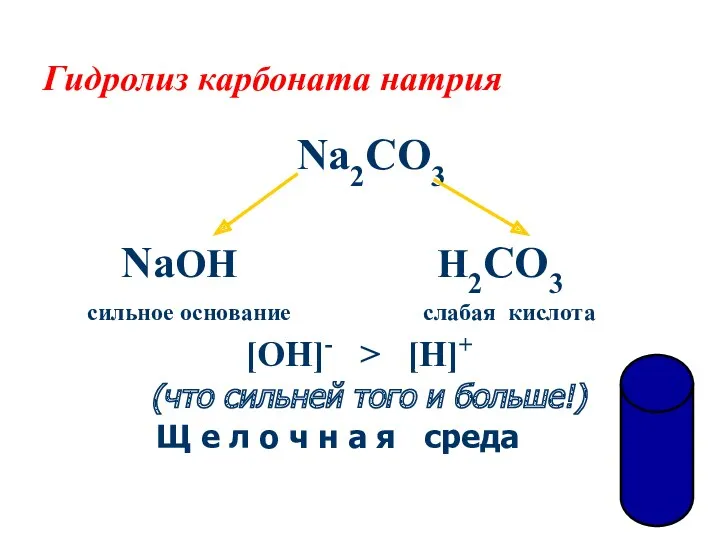
- 12. Гидролиз карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней того
- 13. СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА солей ПО АНИОНУ СЛАБОЙ КИСЛОТЫ Определить состав соли, то есть указать, каким
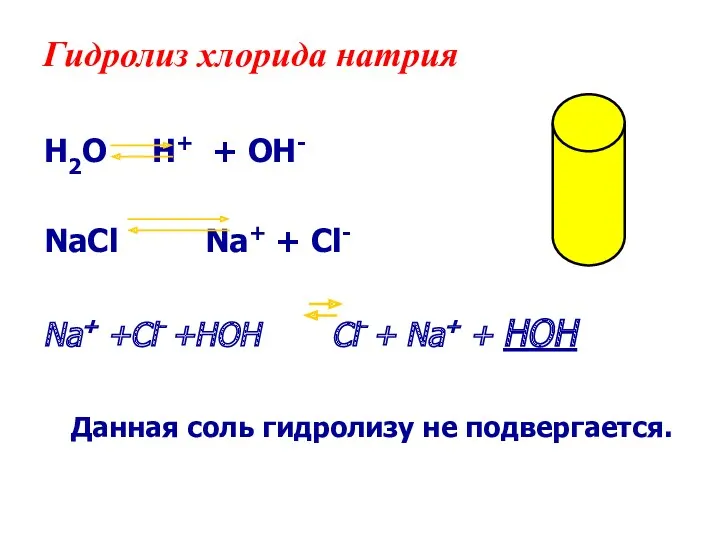
- 14. Гидролиз хлорида натрия H2O H+ + OH- NaСl Na+ + Cl- Na+ +Cl- +HOH Cl- +
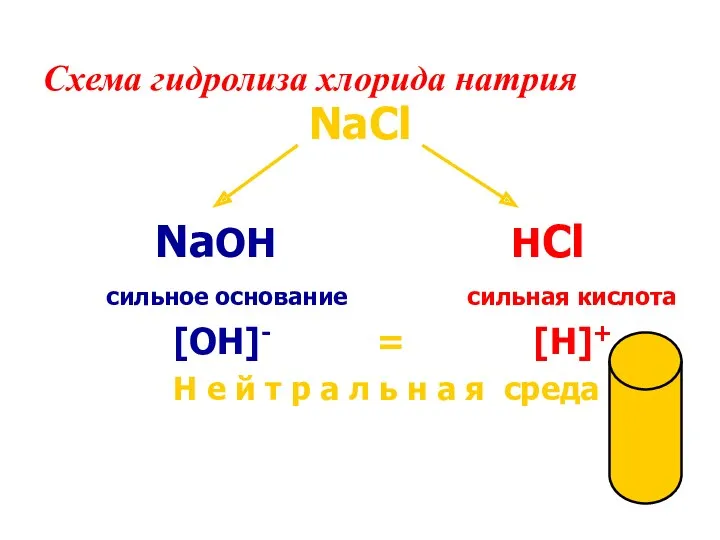
- 15. Схема гидролиза хлорида натрия NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е
- 16. NaCl + Н2О = Вывод: Раствор соли, образованной катионом сильного основания и анионом сильной кислоты, имеет
- 17. ГИДРОЛИЗ – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.
- 20. Роль гидролиза в природе Преобразование земной коры Обеспечение слабощелочной среды морской воды
- 21. Роль гидролиза в народном хозяйстве Порча производственного оборудования Выработка из непищевого сырья ценных продуктов (бумага, мыло,
- 22. Гидролиз в повседневной жизни человека Стирка Мытье посуды Умывание с мылом Процессы пищеварения
- 24. Скачать презентацию














 Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс
Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс Природные источники углеводородов
Природные источники углеводородов Теория диаграмм состояния
Теория диаграмм состояния Удобрения и их классификация
Удобрения и их классификация Растворы. Термодинамическая теория растворов
Растворы. Термодинамическая теория растворов Неметаллы – простые вещества
Неметаллы – простые вещества Серебро
Серебро Комплексиметрическое титрование
Комплексиметрическое титрование Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Закон сохранения массы веществ
Закон сохранения массы веществ Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) Строение атома, изотопы
Строение атома, изотопы Йод. Йодтың ашылуы
Йод. Йодтың ашылуы Етери та естери
Етери та естери Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции
Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Періодична система хімічних елементів
Періодична система хімічних елементів Ионные уравнения
Ионные уравнения Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури
Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури Изотопная геохимия
Изотопная геохимия Полифункциональные органические соединения
Полифункциональные органические соединения Бинарные соединения
Бинарные соединения Органическая химия. Лекция - Оксокислоты
Органическая химия. Лекция - Оксокислоты Борьба с биологической коррозией
Борьба с биологической коррозией Состав, строение и свойства натурального каучука
Состав, строение и свойства натурального каучука Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9
Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9 Обед под микроскопом. Минеральные вещества
Обед под микроскопом. Минеральные вещества Классификация минералов в соответствии с систематикой, утвержденной IMA
Классификация минералов в соответствии с систематикой, утвержденной IMA