Содержание
- 2. Йод, I – элементтердің периодтық жүйесінің VІІ тобындағы химиялық элемент. Йодтың 53 электроны бес электрондық қабаттарға
- 3. Йод (I2) грек тілінен «иодес» күлгін деген мағыныны білдіреді. Йодты 1811 жылы француз кәсіпкері Куртуа ашты.
- 4. Йод – өткір иісті, металдық жылтыы бар, қара сұр, кристлдық зат (ρ-4,93 г/см³). Оны қыздырған кезде
- 5. Йод химиялық белсенді элемент, ол металдармен әрекеттесіп, йодидтер түзеді: 2Na+I₂=>2NaI Йод пен алюминий ұнтақтарының қоспасына катализатор
- 6. Бос йодқа тән сапалық реакция-крахмалды көгертуі. Бұл реакция үшін йодтың сұйық ерітіндісін алған жөн. Йод сутекпен
- 7. Йодты йодидтерден, олардың ерітінділеріне хлормен әсер ету арқылы алады: 2NaІ+СI₂=I₂+2NaСI Реакция йод І иондарының бесендірек элемент
- 8. Йодсутек тұздарының ішінде көбірек қолданылатыны– калий йодиді. Ол медицинада бірқатар ауруларды емдеуде қолданылады. Йод тұндырмасы деп
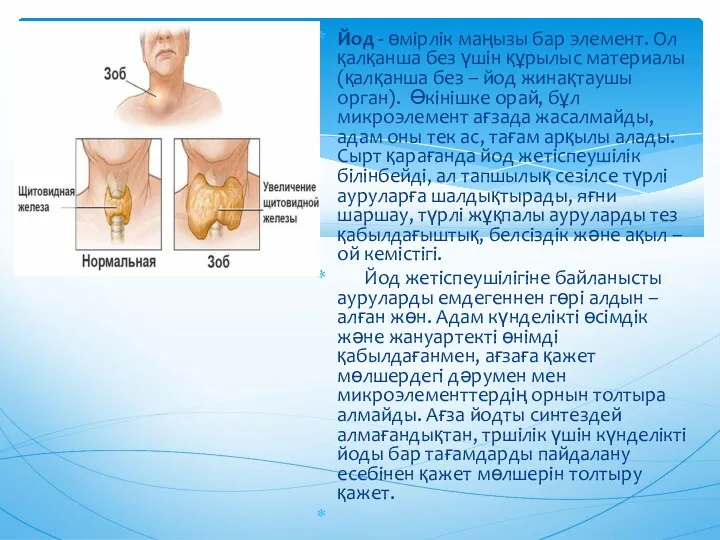
- 10. Йод - өмірлік маңызы бар элемент. Ол қалқанша без үшін құрылыс материалы (қалқанша без – йод
- 11. Йодтың күндік нормасы
- 13. Скачать презентацию








 Металлы, их свойства и область применения
Металлы, их свойства и область применения Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Тяжелые металлы
Тяжелые металлы Гидрокси(окси) кислоты
Гидрокси(окси) кислоты Значение пищи и ее состав
Значение пищи и ее состав Коррозия металлов
Коррозия металлов Изучение процесса коррозии железа (домашний эксперимент)
Изучение процесса коррозии железа (домашний эксперимент) Борьба с биологической коррозией
Борьба с биологической коррозией Реакции ионного обмена
Реакции ионного обмена Спирты
Спирты Газовые смеси
Газовые смеси Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Титриметрический анализ. Кривые титрования
Титриметрический анализ. Кривые титрования Адсорбция
Адсорбция Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Химические реакции или химические явления
Химические реакции или химические явления Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение
Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение Хром, марганец
Хром, марганец Химическая кинетика и катализ
Химическая кинетика и катализ Свойства фосфора
Свойства фосфора Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Тұндыру әдістері
Тұндыру әдістері Термодинамика химических процессов
Термодинамика химических процессов Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Обед под микроскопом. Минеральные вещества
Обед под микроскопом. Минеральные вещества Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН