Содержание
- 2. Можно считать молекулы поштучно? неудобно…
- 3. 8 класс Количество вещества
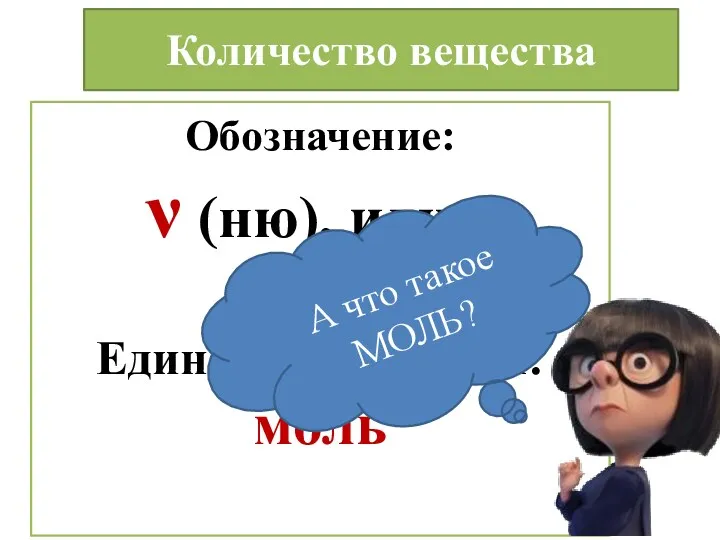
- 4. Количество вещества Обозначение: ν (ню), или n Единица измерения: моль А что такое МОЛЬ?
- 5. Определение Моль – это количество вещества (порция) содержащее 6,02 10 23 частиц (атомов, молекул, ионов) .
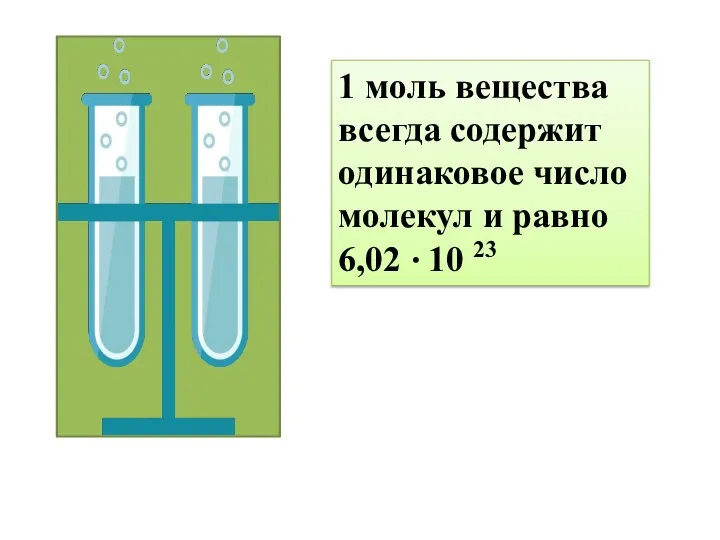
- 6. 1 моль вещества всегда содержит одинаковое число молекул и равно 6,02 10 23 .
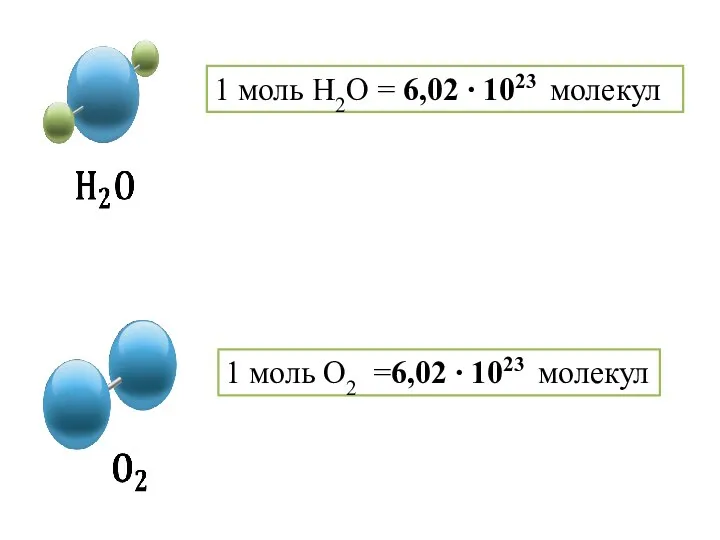
- 7. 1 моль H2O = 6,02 ∙ 1023 молекул 1 моль O2 =6,02 ∙ 1023 молекул
- 8. число Авогадро NА = 6,02 ∙ 1023 моль-1
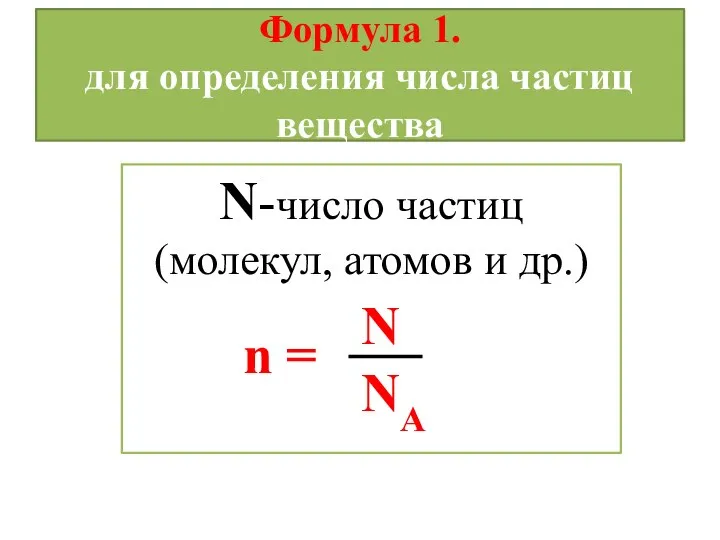
- 9. Формула 1. для определения числа частиц вещества N-число частиц (молекул, атомов и др.) NА
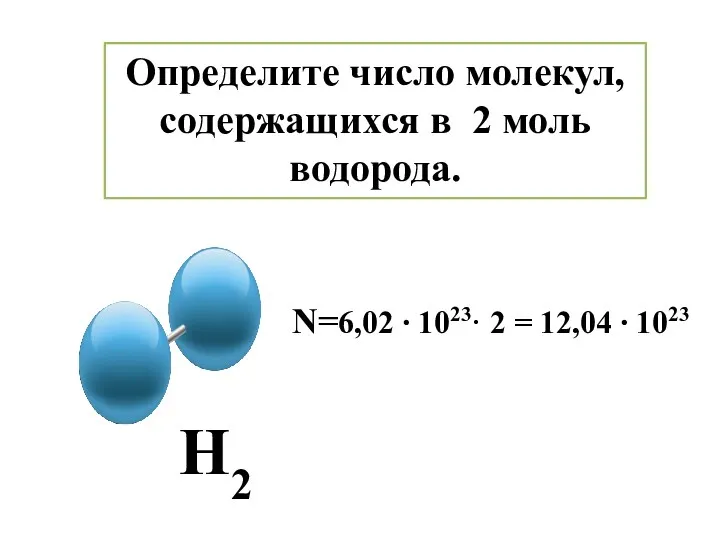
- 10. Определите число молекул, содержащихся в 2 моль водорода. Н2 N=6,02 ∙ 1023· 2 = 12,04 ∙
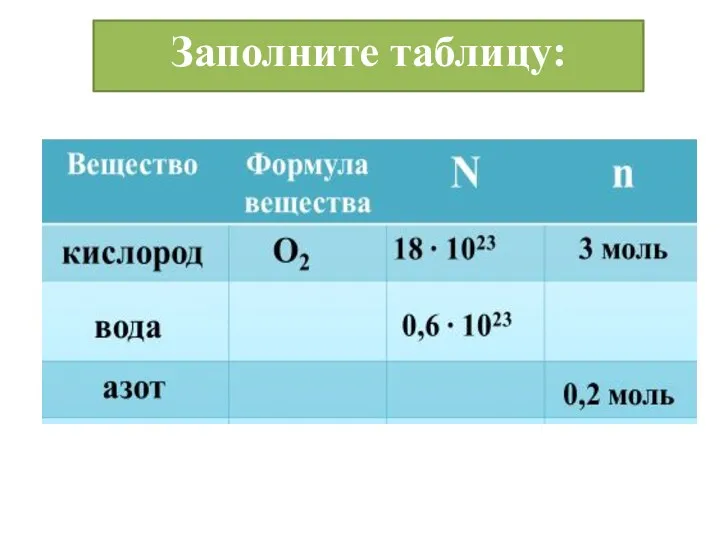
- 11. Заполните таблицу:
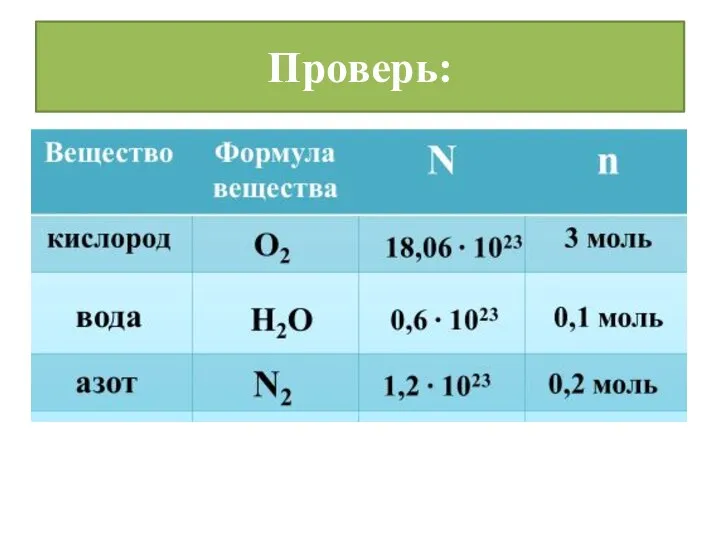
- 12. Проверь:
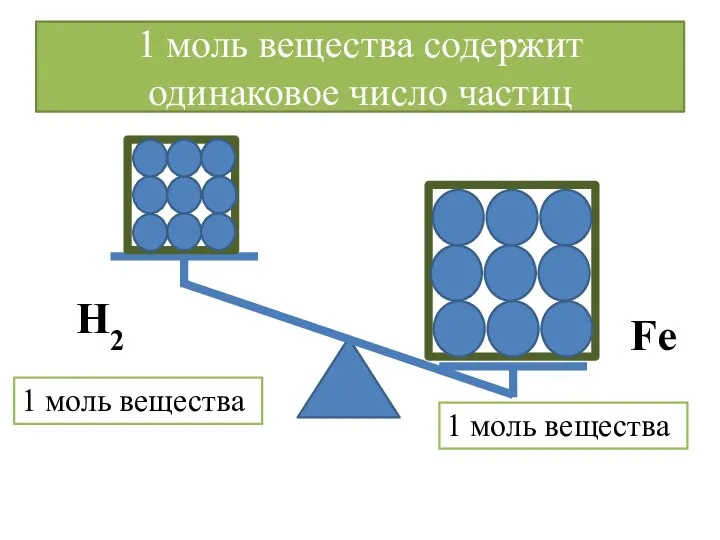
- 13. 1 моль вещества содержит одинаковое число частиц 1 моль вещества 1 моль вещества Н2 Fe
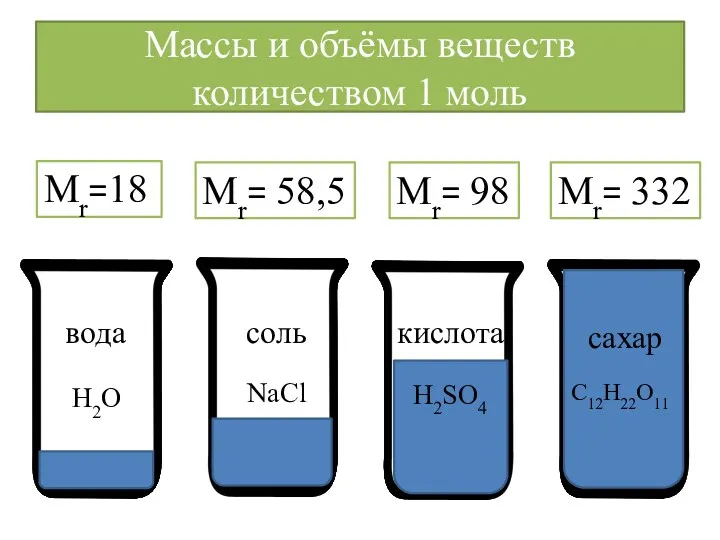
- 14. Массы и объёмы веществ количеством 1 моль вода соль кислота сахар Mr=18 Mr= 58,5 Mr= 98
- 15. Как отмерить 1 моль вещества? 1 г
- 16. Молярная масса вещества Это масса 1 моль вещества. Обозначается - М ед.измерения А сколько весит 1
- 17. Молярная масса вещества численно совпадает с его относительной молекулярной массой. M(Fe2O3) - ? Молярная масса Mr
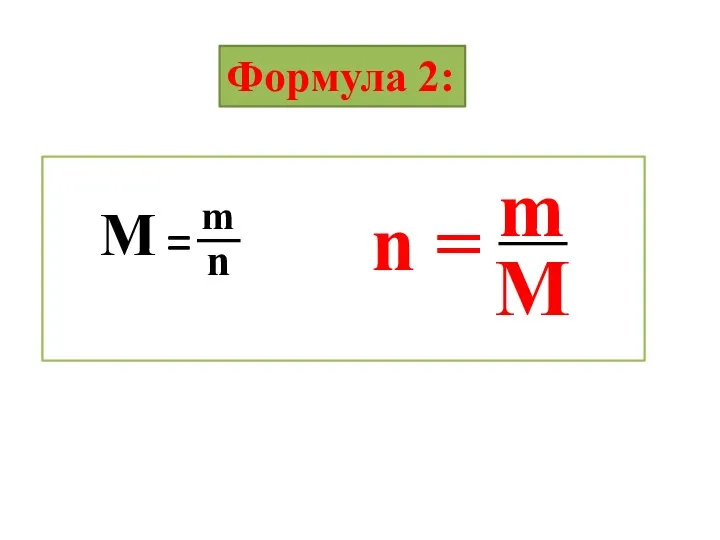
- 18. Формула 2:
- 19. Какую массу имеют 5 моль углекислого газа? Дано: n(CO2) = 5 моль m(CO2) - ? Решение:
- 20. 2. Имеется 585 г поваренной соли (NaCl). Расcчитайте количество вещества NaCl 10 моль 3. Какую массу
- 21. А как же газы? С ними так же?
- 22. Масса 1 моль вещества называется молярной, а как по-вашему называется объем 1 моль газообразного вещества? Объем
- 23. Нормальные условия (н.у.) Т = 0 0С Р = 760 мм. рт. ст. или 1 атм
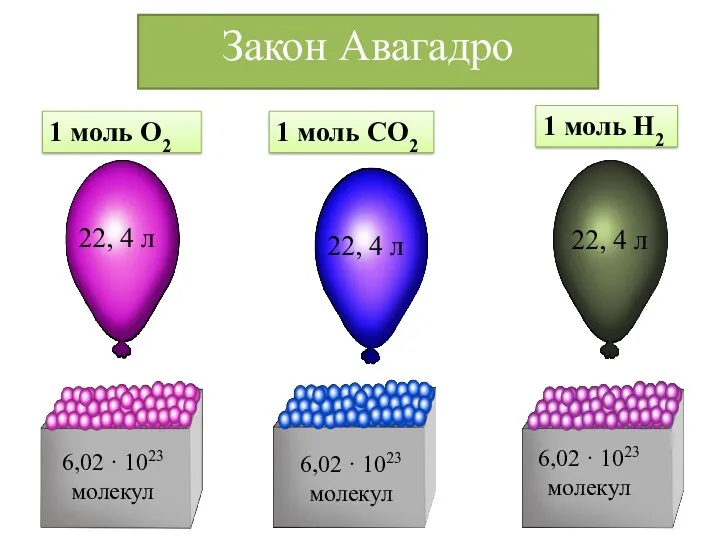
- 24. 1 моль О2 1 моль СО2 1 моль Н2 22, 4 л 6,02 · 1023 молекул
- 25. Объем, который занимает один моль любого газа называется Молярным объемом Молярный объём любого газа при н.у.
- 26. Задача №4 Какой объем занимает 0,2 моль N2 при н.у.? Дано: н.у. Vm = 22, 4
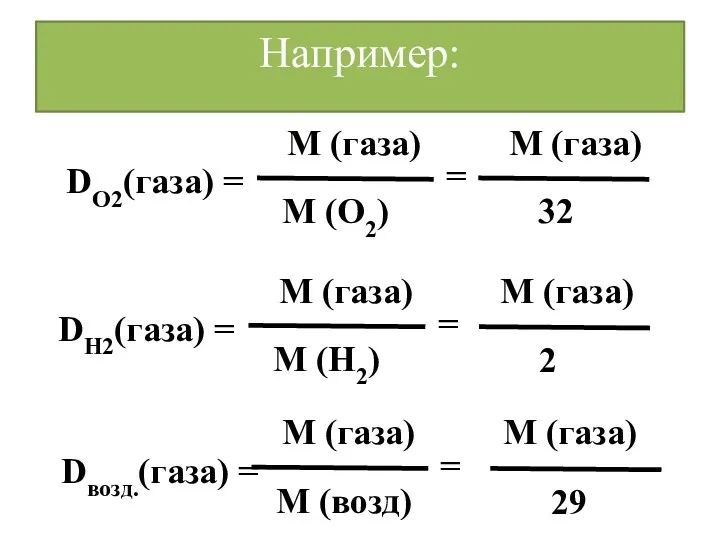
- 27. Относительная плотность Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их молярных масс
- 28. Относительная плотность (D) Она показывает, во сколько раз один газ тяжелее или легче другого
- 29. Например:
- 30. Задача 5 Найдите массу 1 л аммиака NH3 при н.у. Ответ: V(NH3) = 1л m(NH3) -?
- 31. NА - число частиц - объем газа - масса вещества - число Авогадро - молярный объем
- 32. Домашнее задание: §18, 19 читать, таблица в тетради
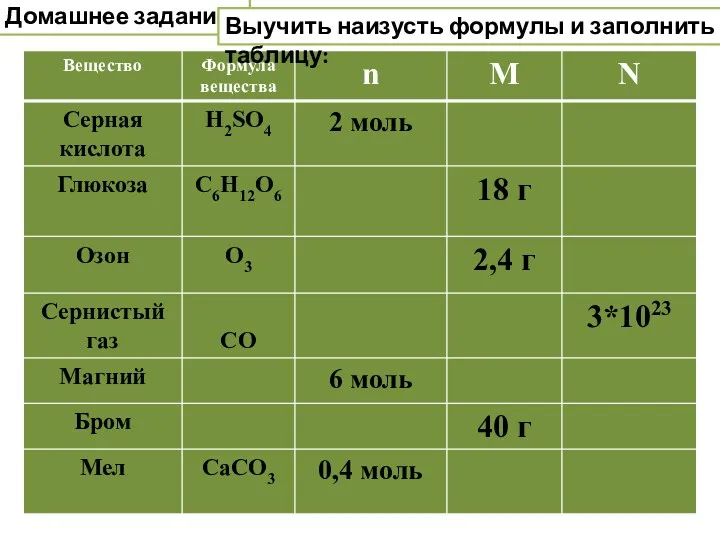
- 33. Домашнее задание: Выучить наизусть формулы и заполнить таблицу:
- 35. Скачать презентацию



















 Газовые смеси
Газовые смеси Химическая связь
Химическая связь Дәріс тақырыбы: Кіріспе. Аналитикалық химия пәні. Сапалық талдау әдістері
Дәріс тақырыбы: Кіріспе. Аналитикалық химия пәні. Сапалық талдау әдістері Стереографическая проекция. Ориентация кристаллов высшей категории
Стереографическая проекция. Ориентация кристаллов высшей категории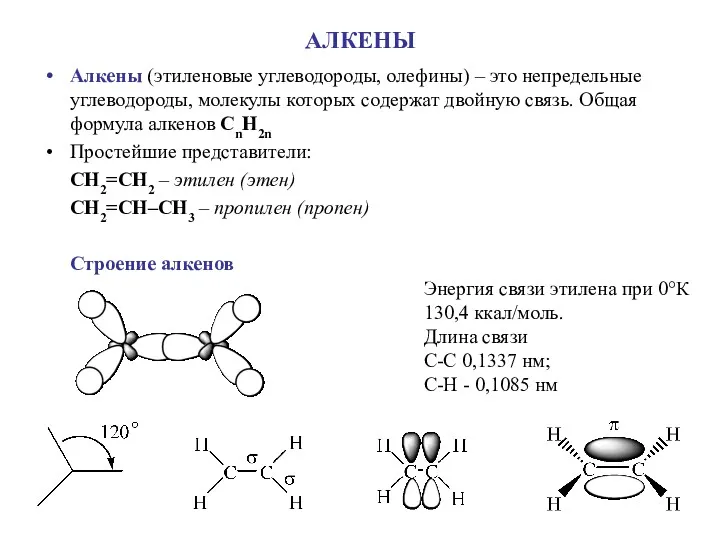 Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Азотная кислота
Азотная кислота Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Кислоты. Классификация кислот
Кислоты. Классификация кислот Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки
Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки Периодический закон и периодическая система Д.И. Менделеева. 9 класс
Периодический закон и периодическая система Д.И. Менделеева. 9 класс Sm-Nd метод
Sm-Nd метод Природній та супутній нафтові гази, їх склад, використання
Природній та супутній нафтові гази, їх склад, використання Химия металлов: влияние металлов на организм человека
Химия металлов: влияние металлов на организм человека 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Олимпиада по учебной дисциплине. Химия
Олимпиада по учебной дисциплине. Химия Современные конструкционные материалы
Современные конструкционные материалы Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1
Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1 Исследование снежного покрова
Исследование снежного покрова Типы расчетных задач, способы их решения. Задания 39-40
Типы расчетных задач, способы их решения. Задания 39-40 Значение органической химии в жизни человека
Значение органической химии в жизни человека Силикат өнеркəсібі
Силикат өнеркəсібі Прикладная химия. Теплоперенос в химических реакторах и теплообменники
Прикладная химия. Теплоперенос в химических реакторах и теплообменники Окислительно-восстановительные реакции. Генетический ряд кальция
Окислительно-восстановительные реакции. Генетический ряд кальция Теоретические основы и технология первичной переработки нефти. Тема 4
Теоретические основы и технология первичной переработки нефти. Тема 4 Щелочной металл натрий
Щелочной металл натрий Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Полимеры. Каучук
Полимеры. Каучук Хімічні властивості кисню
Хімічні властивості кисню