Содержание
- 2. Цель урока: Вскрыть причину образования химической связи Актуализировать знания о видах химической связи Показать относительный характер
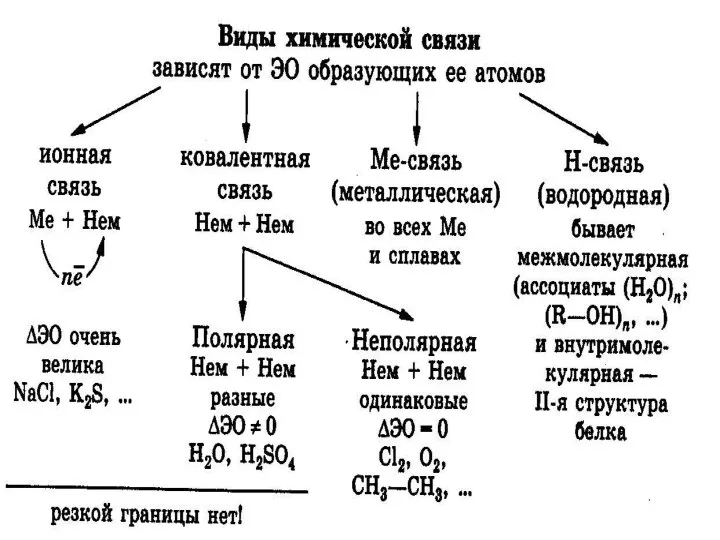
- 3. Химическая связь – это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Различают
- 4. Причиной образования химической связи является стремление системы к минимуму энергии: при её образовании, как правило, энергия
- 5. вывод Химическая связь - взаимодействие между атомами, приводящее к образованию устойчивой системы- молекулы, иона, кристалла.
- 6. Электроотрицательность Электроотрицательность (ЭО)- это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов
- 7. Механизмы образования ковалентной связи Способы образования общей электронной пары: - двумя неспаренными электронами-обменный механизм: А .
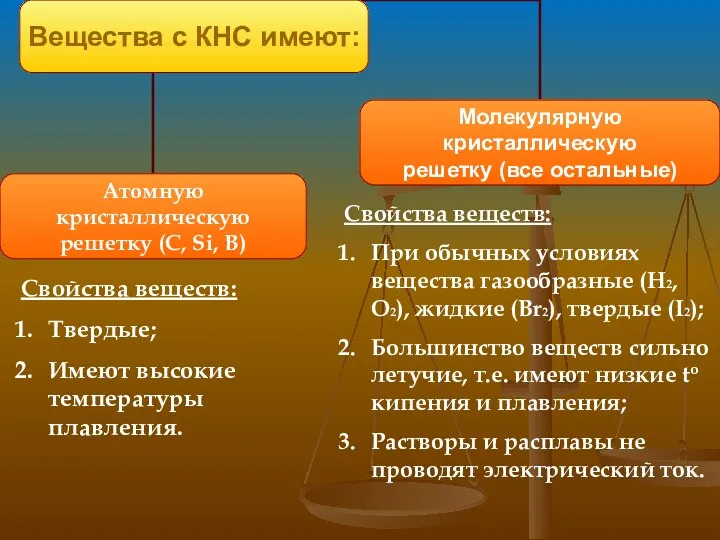
- 8. КНС образуют атомы одного и того же химического элемента. Механизм образования связи Каждый атом неметалла отдает
- 9. Свойства веществ: Твердые; Имеют высокие температуры плавления. Свойства веществ: При обычных условиях вещества газообразные (H2, O2),
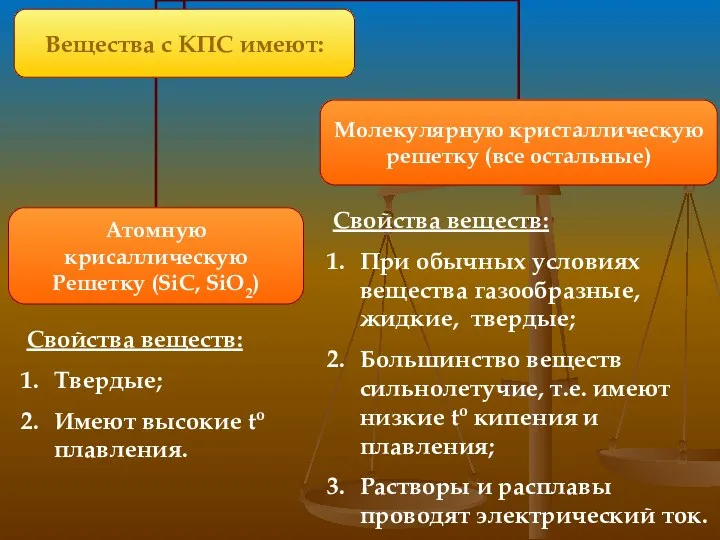
- 10. КПС образуют атомы разных неметаллов (с разной электороотрицательностью). Самый электроотрицательный элемент – F Механизм образования связи
- 12. Свойства веществ: При обычных условиях вещества газообразные, жидкие, твердые; Большинство веществ сильнолетучие, т.е. имеют низкие to
- 13. Полярность ковалентной связи Она определяется разницей значений э.о связанных атомов
- 14. ИС образуется между атомами металлов и неметаллов, т.е. между атомами резко отличающимися друг от друга по
- 15. Ионная связь- электростатическое притяжение между ионами. Ионных соединений немного: элементы + элементы I и IIгр. гл.
- 16. Свойства веществ: Все вещества при обычных условиях твердые. Имеют высокие температуры кипения и плавления. Расплавы и
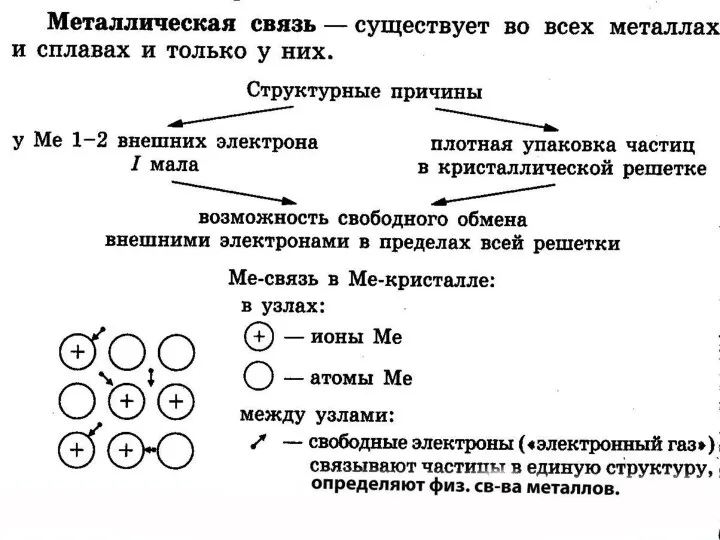
- 17. Металлическая связь – связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов
- 19. Водородная связь – связь между атомами водорода одной молекулы и сильноотрицательными элементами (O, N, F) другой
- 20. Механизм возникновения связи: Протон одной молекулы притягивается неподеленной электронной парой атома другой молекулы. Примеры веществ: водородные
- 21. Водородная связь бывает: Межмолекулярная Внутримолекулярная
- 22. Природа водородной связи - это электростатическое притяжение между положительно поляризованными атомами водорода одной молекулы и отрицательно
- 24. А-1 В каком ряду написаны вещества только с ковалентной полярной связью? а) хлор, аммиак, хлороводород б)
- 25. А-2. Термин «молекула» нельзя употреблять при характеристике строения 1) сероводорода 2) азотной кислоты 3) озона 4)
- 26. А-3 Какая химическая связь образуется между атомами элементов с порядковыми номерами 9 и 19? 1) ионная
- 27. А-4 Различие в значении температур плавления CO2 (- 56,6) и SiO2 (+ 1728) объясняется 1) различием
- 28. А-5 В веществе CH3 – CH3 связь между атомами углерода 1) ковалентная неполярная 2) ковалентная полярная
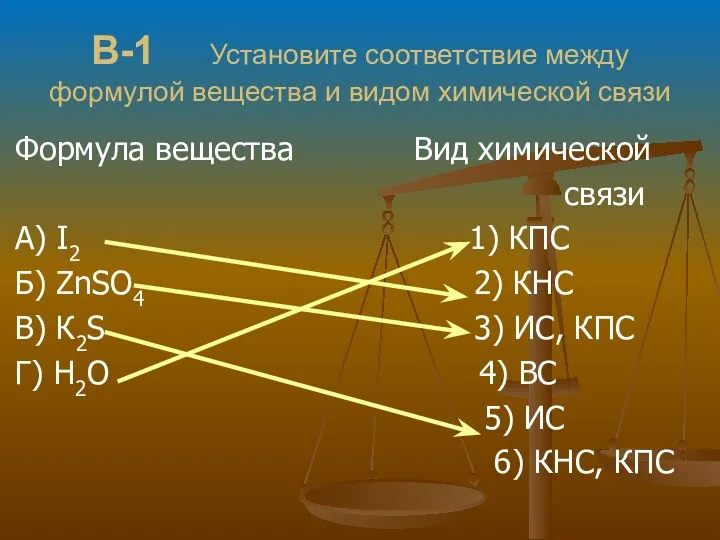
- 29. В-1 Установите соответствие между формулой вещества и видом химической связи Формула вещества Вид химической связи А)
- 30. В-1 Установите соответствие между формулой вещества и видом химической связи Формула вещества Вид химической связи А)
- 31. Домашнее задание Повторить по записям виды хим. связи и типы кристаллических решёток Придумать свой тест по
- 33. Скачать презентацию

























 Крахма́л (C6H10O5)n
Крахма́л (C6H10O5)n Закон сохранения массы. Химические уравнения
Закон сохранения массы. Химические уравнения Химические волокна
Химические волокна Классификация химических реакций
Классификация химических реакций Щелочные металлы
Щелочные металлы Промышленное производство аммиака
Промышленное производство аммиака Л3. Учение о растворах (Химия)
Л3. Учение о растворах (Химия) Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Что такое химия. Техника безопасности. Интересные факты (урок 1)
Что такое химия. Техника безопасности. Интересные факты (урок 1) Создание косметических средств
Создание косметических средств Химия аминокислот, пептидов и белков
Химия аминокислот, пептидов и белков Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы АЛКАНЫ 9 класс
АЛКАНЫ 9 класс Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Калийные Удобрения
Калийные Удобрения Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г
Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г Сплави алюмінію. Характеристики та застосування
Сплави алюмінію. Характеристики та застосування Structural, substructural properties and chemical composition
Structural, substructural properties and chemical composition Количество вещества. Моль
Количество вещества. Моль Общая характеристика углеводов: глюкоза
Общая характеристика углеводов: глюкоза Комплексные соединения и лигандообменные равновесия
Комплексные соединения и лигандообменные равновесия Галогены. Общая характеристика галогенов
Галогены. Общая характеристика галогенов Аммиак
Аммиак Технология переработки полимеров
Технология переработки полимеров Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ)
Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ) Алюминий и его соединения
Алюминий и его соединения Периодический закон Д.И. Менделеева. Периодическая система химических элементов
Периодический закон Д.И. Менделеева. Периодическая система химических элементов Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены