Содержание
- 2. СОДЕРЖАНИЕ Ученые, получившие алюминий Характеристика элемента - алюминия Нахождение в природе Физические свойства Химические свойства Применение
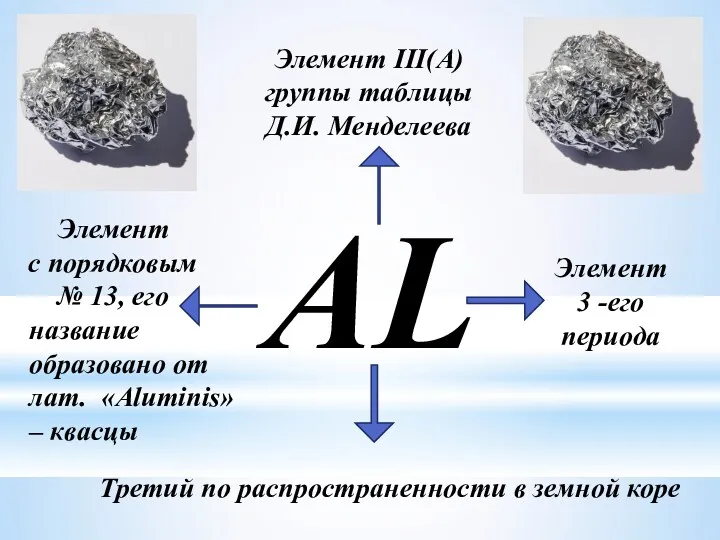
- 3. AL Элемент III(A) группы таблицы Д.И. Менделеева Элемент с порядковым № 13, его Элемент 3 -его
- 4. Датский физик Ганс Эрстед (1777-1851) Впервые алюминий был получен им в 1825 году действием амальгамы калия
- 5. Современное получение алюминия Современные метод получения был разработан независимо друг от друга: американцем Чарльзом Холлом и
- 6. Будучи студентом Оберлинского колледжа, он узнал, что можно разбогатеть и получить благодарность человечества, если изобрести способ
- 7. Поль Эру (1863-1914) – французский инженер - химик В 1889 году открыл алюминиевый завод во Фроне
- 8. Нахождение в природе Важнейшим на сегодня минералом алюминия является боксит Основной химический компонент боксита - глинозем
- 9. Физические свойства мягкий легкий (с малой плотностью – 2,7 г/см3) с высокой тепло- и электропроводностью легкоплавкий
- 10. с серой, образуя сульфид алюминия: 2Al + 3S = Al2S3 с азотом, образуя нитрид алюминия: 2Al
- 11. Химические свойства 1. с водой (после удаления защитной оксидной пленки) 2Al + 6H2O = 2Al(OH)3 +
- 12. ПРИМЕНЕНИЕ АЛЮМИНИЯ Легкий сплав дюраль используется в различных областях В Авиации В Космической технике В Электротехнике
- 13. Соединения алюминия Оксид алюминия (AL2O3) Гидроксид алюминия AL(OH)3
- 14. Химические свойства оксида алюминия Амфотерный оксид Реагирует с кислотами Реагирует с щелочами AL2O3 + 6HCL=2ALCL3 +
- 15. AL2O3 Глинозём Корунд сапфир рубин Боксит
- 16. Применение сапфиров знаменитые сапфиры английской королевской семьи
- 17. Применение рубинов
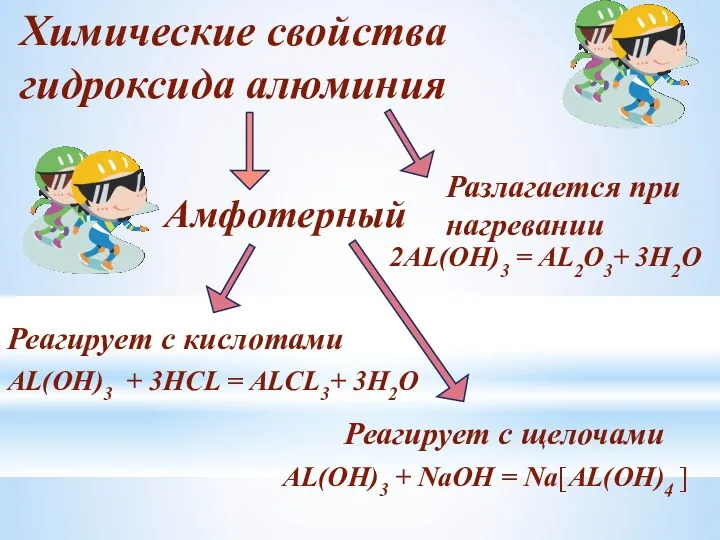
- 18. Химические свойства гидроксида алюминия Амфотерный Реагирует с кислотами Реагирует с щелочами AL(OH)3 + 3HCL = ALCL3+
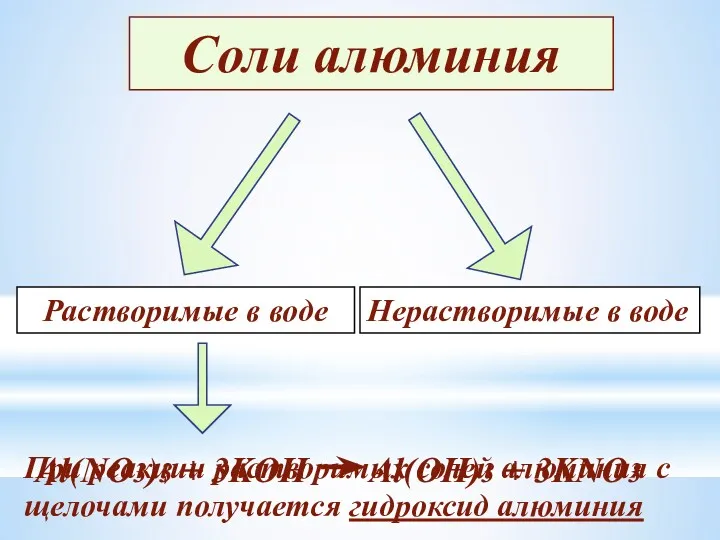
- 19. Соли алюминия Растворимые в воде Нерастворимые в воде При реакции растворимых солей алюминия с щелочами получается
- 20. Вставьте пропущенные слова в текст: Проверьте себя: Алюминий – это металл, у которого в соединениях степень
- 21. Какие из соединений вступят в реакцию с алюминием: Cl2 K2O CuSO4 H2O S BaSO4 HCL Cr
- 23. Скачать презентацию
















 Новое направление в бизнесе компании – катализаторы синтеза метанола
Новое направление в бизнесе компании – катализаторы синтеза метанола Водород. Химические свойства
Водород. Химические свойства Электрохимия. Электродика
Электрохимия. Электродика Кислород, азот, водород и инертные газы. Раздел 3
Кислород, азот, водород и инертные газы. Раздел 3 Валентность химических элементов. 8 класс
Валентность химических элементов. 8 класс Алюминий и его соединения
Алюминий и его соединения Кислородные соединения азота
Кислородные соединения азота Химические свойства кислот
Химические свойства кислот Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Оксиды. Классификация. Получение. Свойства
Оксиды. Классификация. Получение. Свойства Предельные одноатомные спирты
Предельные одноатомные спирты Органическая химия. Лекция - Гидроксикислоты
Органическая химия. Лекция - Гидроксикислоты Изучение физико-химических показателей качества макаронных изделий
Изучение физико-химических показателей качества макаронных изделий Валентность и степень окисления
Валентность и степень окисления Химико-лесной комплекс
Химико-лесной комплекс Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Почва. Интегрированный урок по химии и географии
Почва. Интегрированный урок по химии и географии Железо. Строение атома, химические и физические свойства. Урок №1
Железо. Строение атома, химические и физические свойства. Урок №1 Учение о растворах
Учение о растворах Производные фурана, пиррола, тиофена
Производные фурана, пиррола, тиофена Минерализация, иммобилизация, нитрификация және денитрификация процестері
Минерализация, иммобилизация, нитрификация және денитрификация процестері Тема 7-Карбоновые кислоты
Тема 7-Карбоновые кислоты Соляная кислота. Хлориды
Соляная кислота. Хлориды Поверхностно-активные вещества
Поверхностно-активные вещества Методика обучения решению задач на соотношение атомов в школьном курсе химии
Методика обучения решению задач на соотношение атомов в школьном курсе химии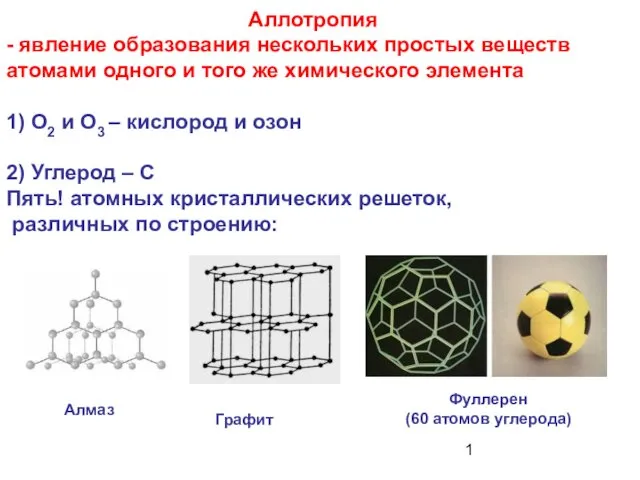 Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента
Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента Кристаллические решетки
Кристаллические решетки Respiration Module
Respiration Module