Содержание
- 2. Электродика Теория возникновения равновесных электродных и окислительно-восстановительных потенциалов Определение направления окислительно-восстановительного процесса
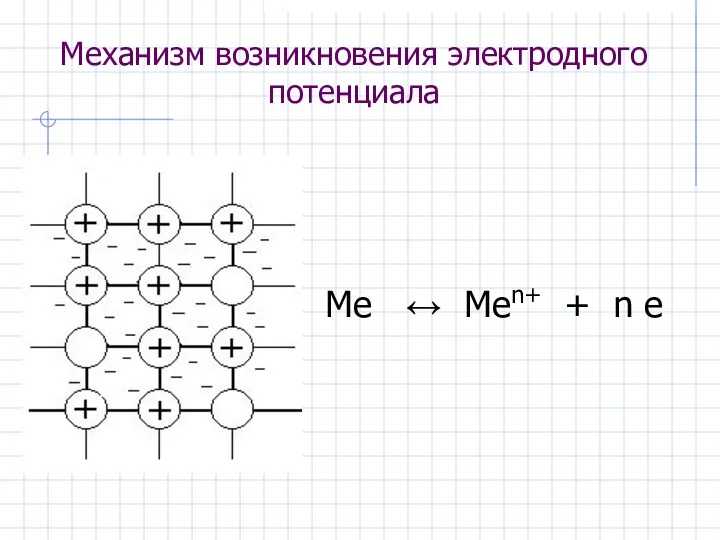
- 3. Механизм возникновения электродного потенциала Ме ↔ Меn+ + n e
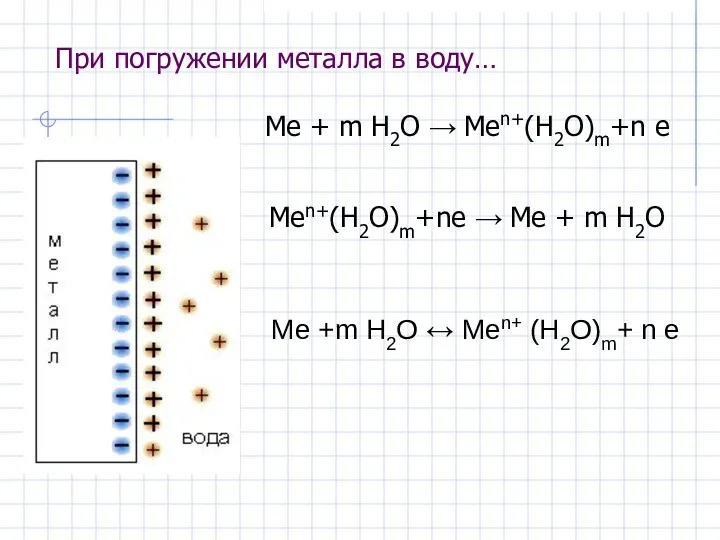
- 4. При погружении металла в воду… Ме + m Н2О → Меn+(Н2О)m+n e Ме +m Н2О ↔
- 5. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
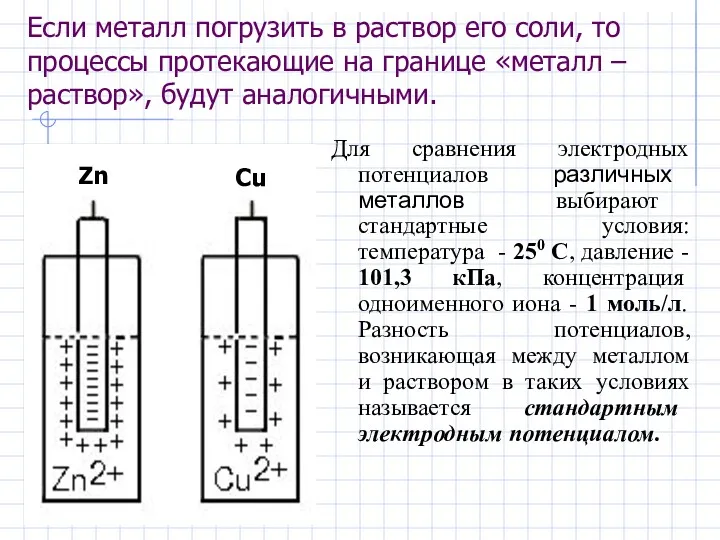
- 6. Если металл погрузить в раствор его соли, то процессы протекающие на границе «металл – раствор», будут
- 7. Стандартный электродный потенциал
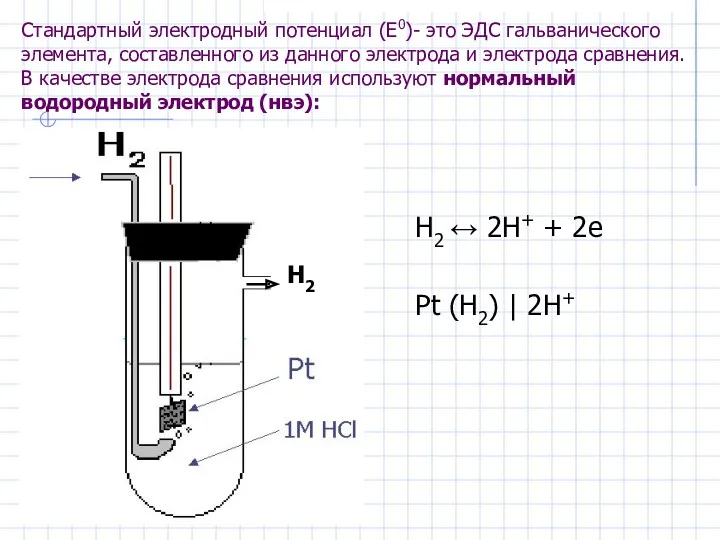
- 8. Стандартный электродный потенциал (Е0)- это ЭДС гальванического элемента, составленного из данного электрода и электрода сравнения. В
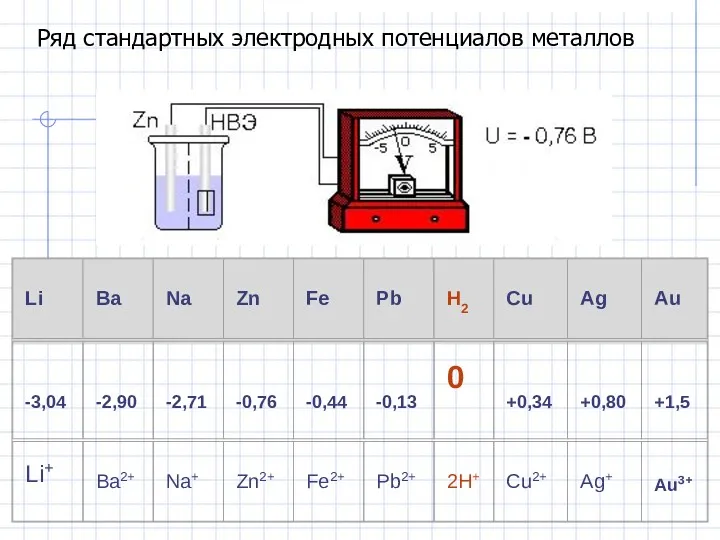
- 9. Ряд стандартных электродных потенциалов металлов
- 10. Величина потенциала в реальных условиях рассчитывается по уравнению Нернста:
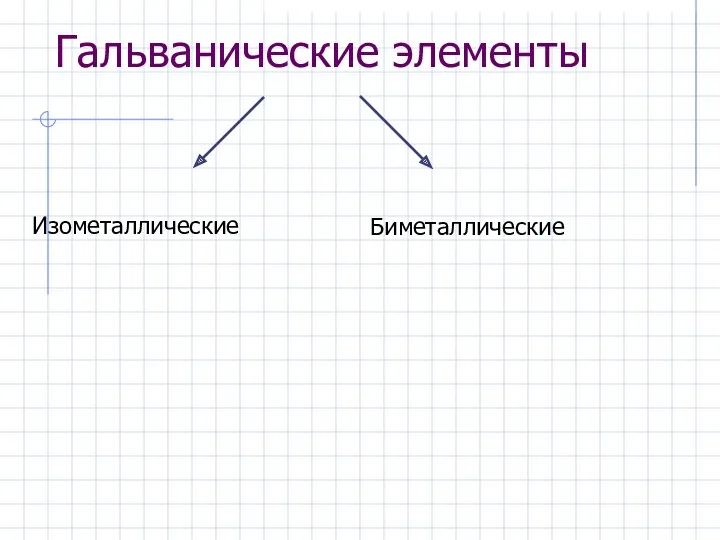
- 12. Гальванические элементы Изометаллические Биметаллические
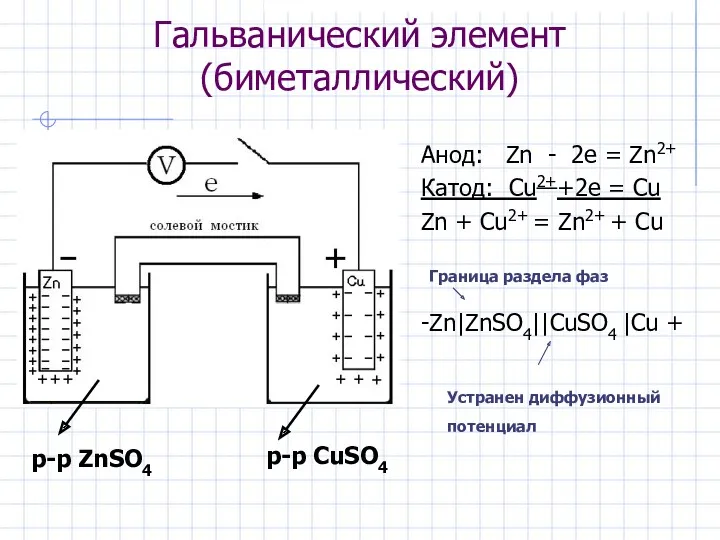
- 13. Гальванический элемент (биметаллический) Анод: Zn - 2e = Zn2+ Катод: Cu2++2e = Cu Zn + Cu2+
- 14. Мерой работоспособности ГЭ элемента является ЭДС или разность потенциалов электродов:
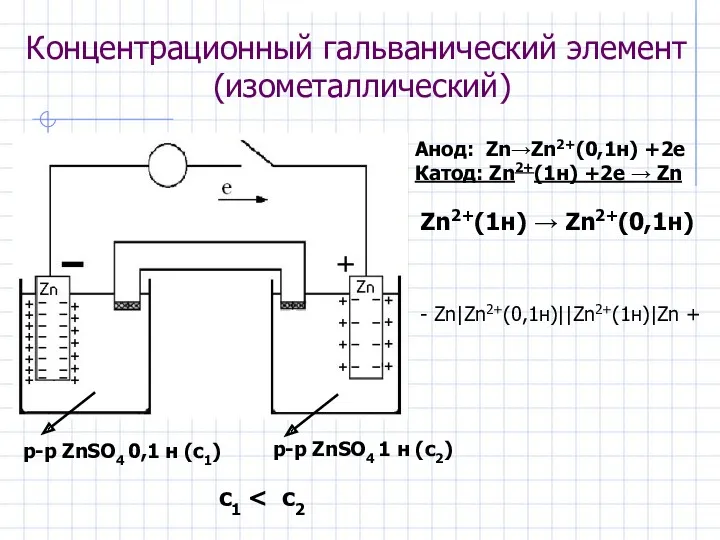
- 15. Концентрационный гальванический элемент (изометаллический) Анод: Zn→Zn2+(0,1н) +2e Катод: Zn2+(1н) +2e → Zn Zn2+(1н) → Zn2+(0,1н) -
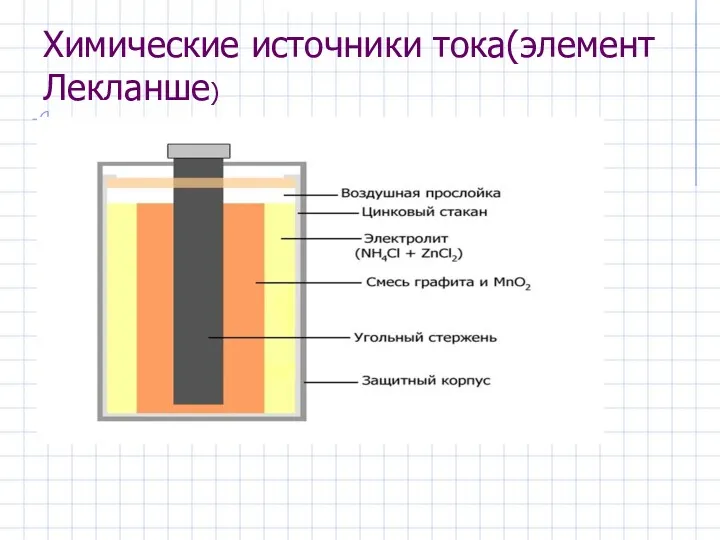
- 17. Химические источники тока(элемент Лекланше)
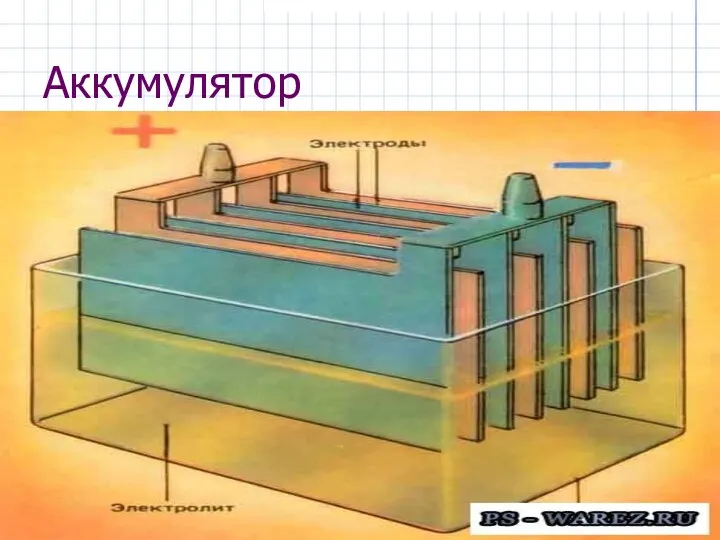
- 19. Аккумулятор
- 20. Уравнения работы аккумулятора
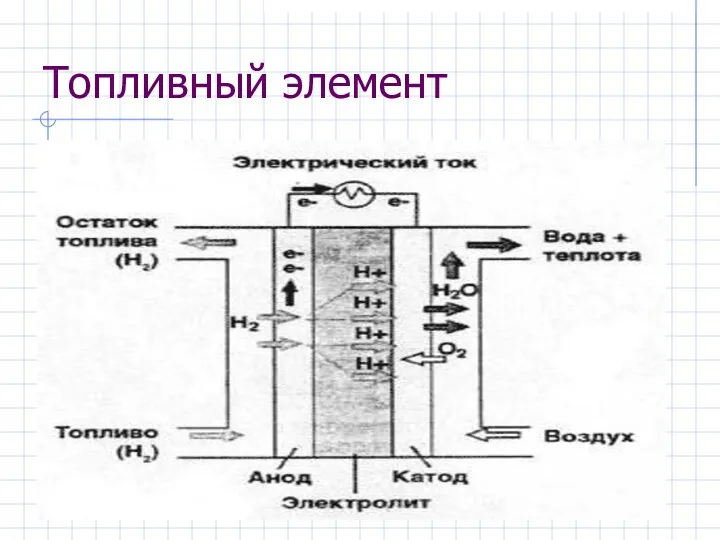
- 21. Топливный элемент
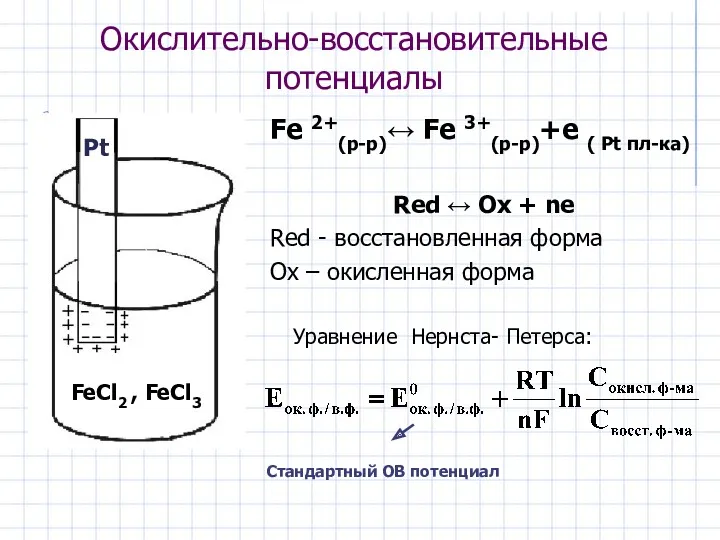
- 22. Окислительно-восстановительные потенциалы Fe 2+(р-р)↔ Fe 3+(р-р)+е ( Pt пл-ка) Red ↔ Ox + ne Red -
- 23. ОВ потенциал зависит от: температуры природы окислителя и восстановителя концентрации окисленной и восстановленной форм рН среды
- 24. Стандартный ОВ потенциал ЭДС ГЭ, составленного из окислительно-восстановительной системы, содержащей окисленную и восстановленную формы в концентрациях
- 25. Если составить ГЭ из MnO4-/Mn2+ и (Pt),H2|2H+, то стандартный ОВ потенциал = +1,51 В. MnO4- +
- 26. В реальных условиях расчет ОВ потенциала системы MnO4-/Mn2+ производится по уравнению Нернста-Петерса:
- 27. Чем больше стандартный ОВ потенциал системы, тем в большей степени выражены ее окислительные свойства в стандартных
- 28. Критерии самопроизвольного протекания ОВ реакций
- 29. Пример:
- 30. Глубина протекания ОВ реакций
- 31. Окислительно-восстановительные ГЭ
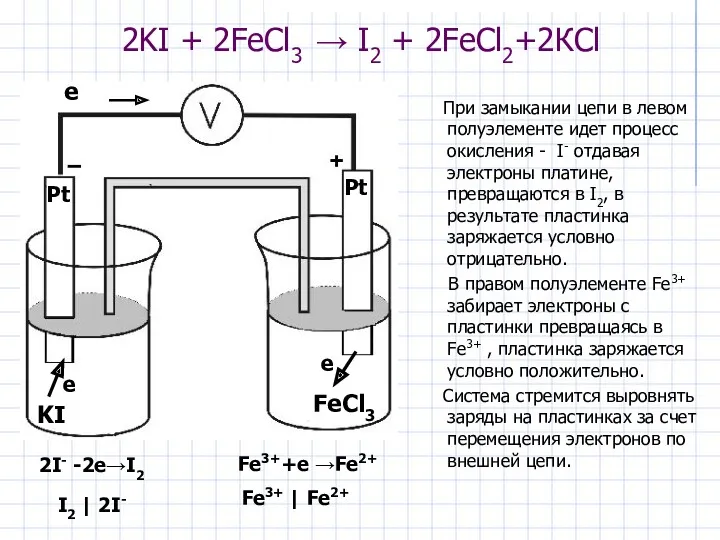
- 32. 2KI + 2FeCl3 → I2 + 2FeCl2+2КCl При замыкании цепи в левом полуэлементе идет процесс окисления
- 33. Ионоселективные электроды
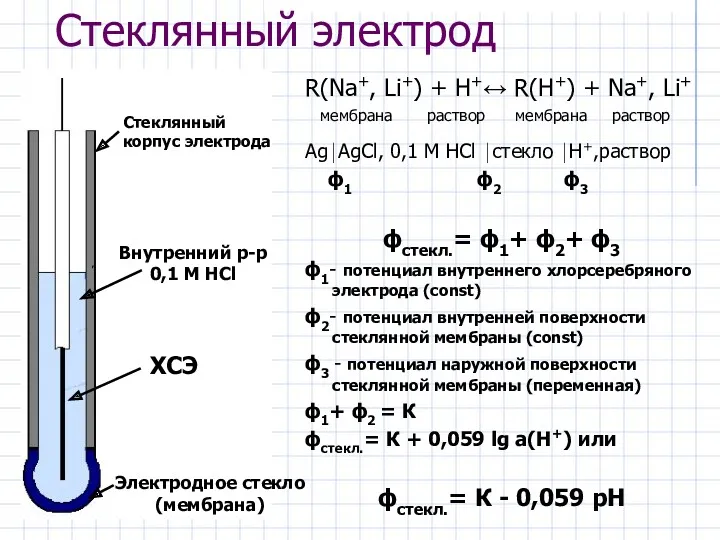
- 34. Стеклянный электрод R(Na+, Li+) + H+↔ R(H+) + Na+, Li+ мембрана раствор мембрана раствор Ag⏐AgCl, 0,1
- 36. Скачать презентацию



















 Углерод и его свойства
Углерод и его свойства Получение и химические свойства оснований
Получение и химические свойства оснований Энергетика химических процессов
Энергетика химических процессов Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений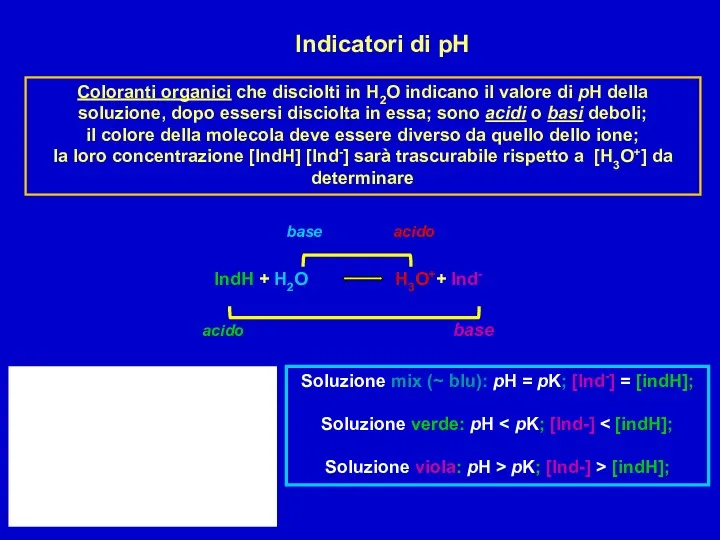 Indicatori di pH
Indicatori di pH Сложноэфирная конденсация Кляйзена-Шмидта
Сложноэфирная конденсация Кляйзена-Шмидта Кислоты. Общая характеристика, химические свойства
Кислоты. Общая характеристика, химические свойства 20231004_agregatnye_sostoyaniya_-_kopiya
20231004_agregatnye_sostoyaniya_-_kopiya Углерод. Carbon
Углерод. Carbon Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения
Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения Коррозия и защита строительных материалов
Коррозия и защита строительных материалов Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу
Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу Минералы и горные породы
Минералы и горные породы Аммиак. Соли аммония
Аммиак. Соли аммония Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс)
Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс) Соединения химических элементов
Соединения химических элементов Химический КВИЗ
Химический КВИЗ 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Простые вещества. Игра Счастливый случай
Простые вещества. Игра Счастливый случай Ертінділер. Ерітінді концентрациясын білдіру тәсілдері
Ертінділер. Ерітінді концентрациясын білдіру тәсілдері Конструкционные функциональные волокнистые композиты. Стеклопластики
Конструкционные функциональные волокнистые композиты. Стеклопластики Фазовые равновесия в растворах
Фазовые равновесия в растворах Занимательные опыты
Занимательные опыты Химические свойства кислот
Химические свойства кислот Алюминий и его соединения. Строение атома
Алюминий и его соединения. Строение атома Этил спирті және оның адам ағзасына әсері
Этил спирті және оның адам ағзасына әсері Химический дискуссионный клуб. Викторина
Химический дискуссионный клуб. Викторина