Содержание
- 2. Физические свойства: Бесцветный газ, с резким запахом, едким вкусом, легче воздуха, хорошо растворяется в воде с
- 3. Способы получения: В промышленности: Прямой синтез N2 + H2 → (t∘, p, kat(Fe)) NH3 – Метод
- 4. Химические свойства Взаимодействие с водой: NH3 + H2O ⇄ NH4OH ⇄ NH3∙H2O Водный раствор аммиака –
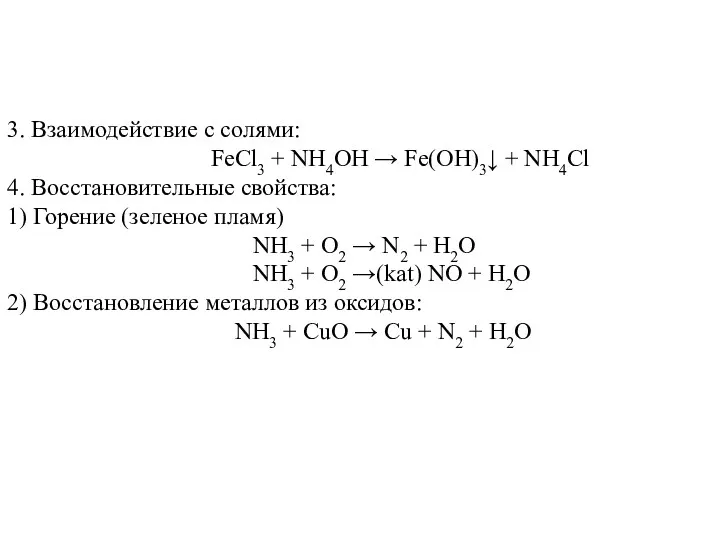
- 5. 3. Взаимодействие с солями: FeCl3 + NH4OH → Fe(OH)3↓ + NH4Cl 4. Восстановительные свойства: 1) Горение
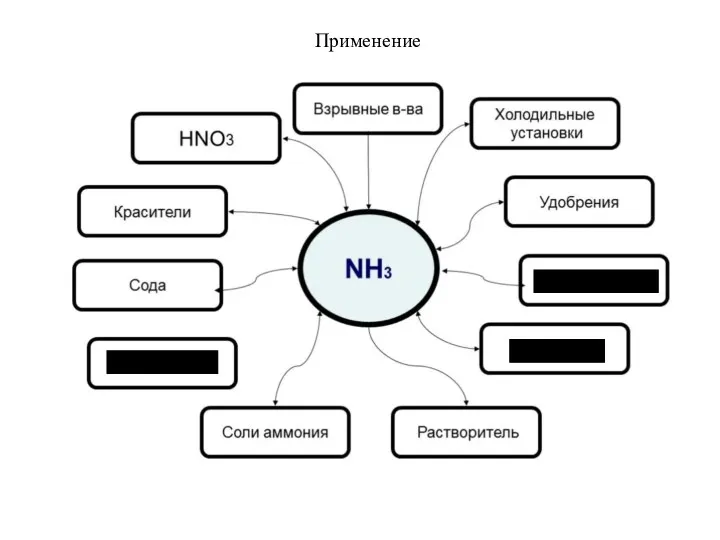
- 6. Применение
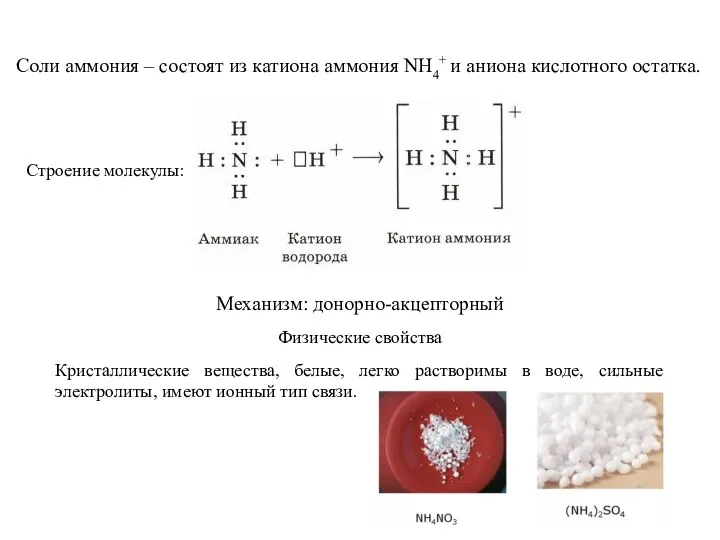
- 7. Соли аммония – состоят из катиона аммония NH4+ и аниона кислотного остатка. Строение молекулы: Механизм: донорно-акцепторный
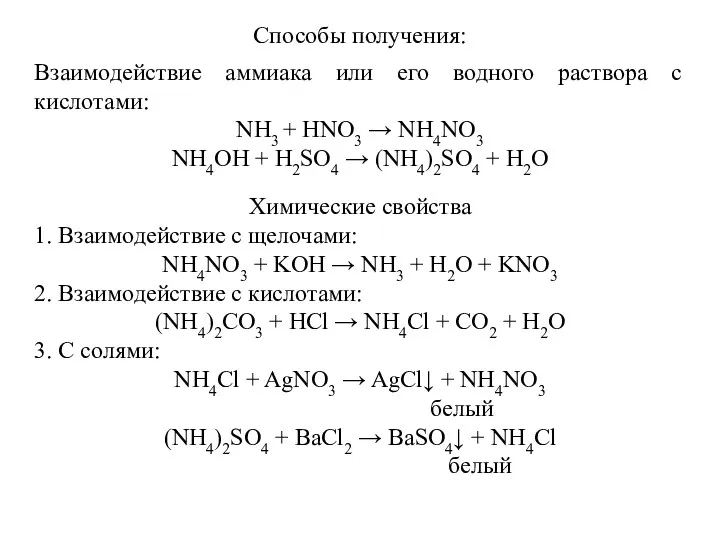
- 8. Способы получения: Взаимодействие аммиака или его водного раствора с кислотами: NH3 + HNO3 → NH4NO3 NH4OH
- 9. 4. Разложение (под действием t∘): NH4Cl → NH3 + Cl2 NH4NO2 → N2 + H2O NH4NO3
- 11. Скачать презентацию



 Вода-растворитель. Работа воды в природе
Вода-растворитель. Работа воды в природе Бутадиеновые каучуки
Бутадиеновые каучуки Общая характеристика авиационных материалов, тенденции их развития
Общая характеристика авиационных материалов, тенденции их развития Водород
Водород Азотная кислота
Азотная кислота Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Периодический закон и Периодическая система химических элементов Д.И. Менделеева Альдегиды и карбоновые кислоты
Альдегиды и карбоновые кислоты Углеводы. Общая характеристика углеводов
Углеводы. Общая характеристика углеводов Алкадиены
Алкадиены Атомы химических элементов
Атомы химических элементов Спирти. Історична довідка
Спирти. Історична довідка Минералогия литофильных редких элементов. Цирконий и гафний
Минералогия литофильных редких элементов. Цирконий и гафний Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение) Additives for Polymeric Materials
Additives for Polymeric Materials Ионная химическая связь
Ионная химическая связь Основные свойства и механизмы упрочнения КМ
Основные свойства и механизмы упрочнения КМ Геохимические поиски. Региональные работы
Геохимические поиски. Региональные работы Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров
Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров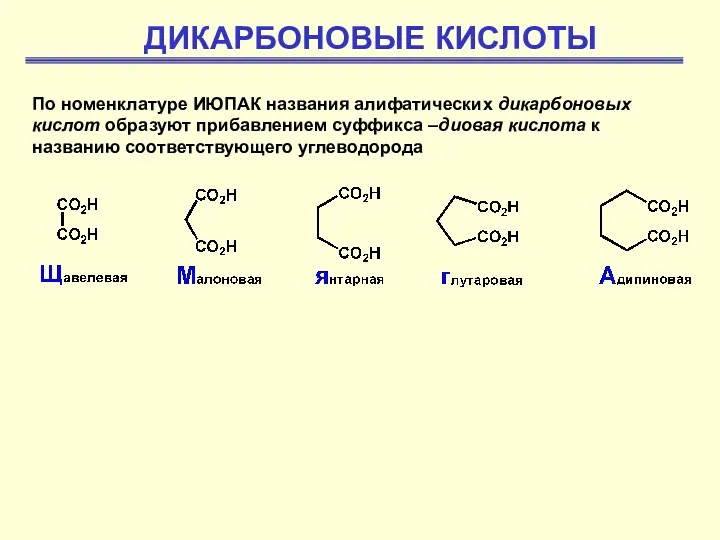 Дикарбоновые кислоты
Дикарбоновые кислоты Мыла и синтетические моющие средства
Мыла и синтетические моющие средства ПВХ
ПВХ Предмет аналитической химии, ее структура
Предмет аналитической химии, ее структура Азот и его соединения. Повторение
Азот и его соединения. Повторение Значення хімічних процесів у природі
Значення хімічних процесів у природі Органічні розчинники
Органічні розчинники Псевдоморфозы. Образование псевдоморфоз
Псевдоморфозы. Образование псевдоморфоз Расчеты по химическим уравнениям. 8 класс
Расчеты по химическим уравнениям. 8 класс Механические свойства минералов
Механические свойства минералов