Содержание
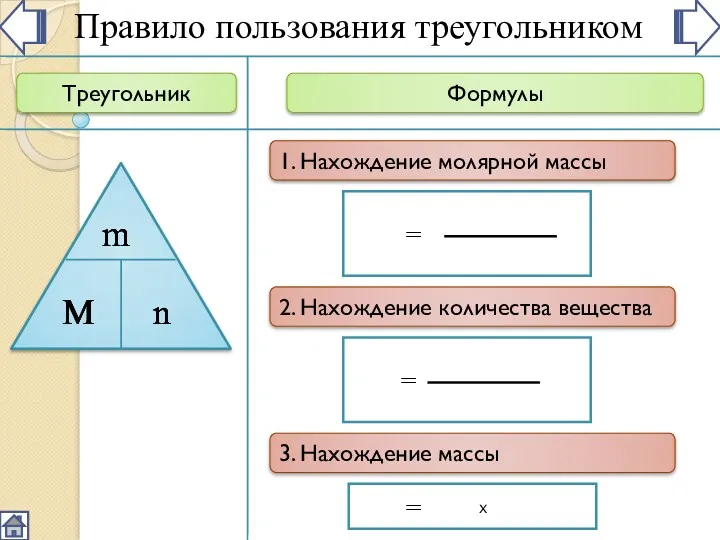
- 2. Треугольник Формулы M Правило пользования треугольником = 1. Нахождение молярной массы m n 2. Нахождение количества
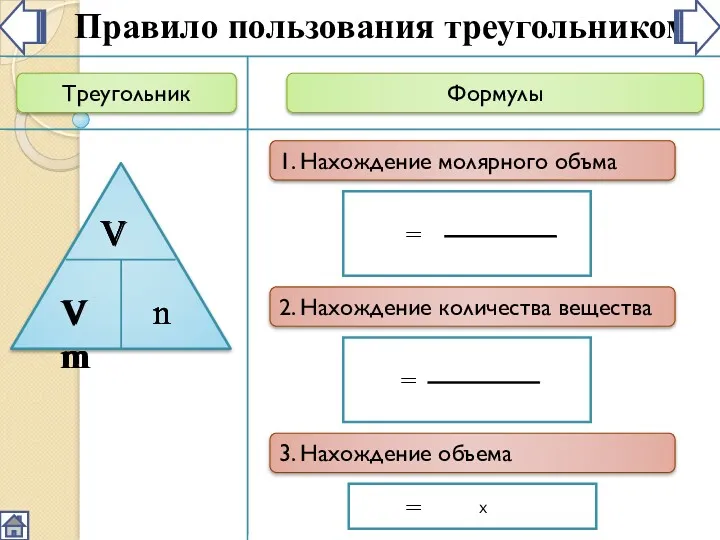
- 3. Треугольник Формулы Vm Правило пользования треугольником = 1. Нахождение молярного объма V n 2. Нахождение количества
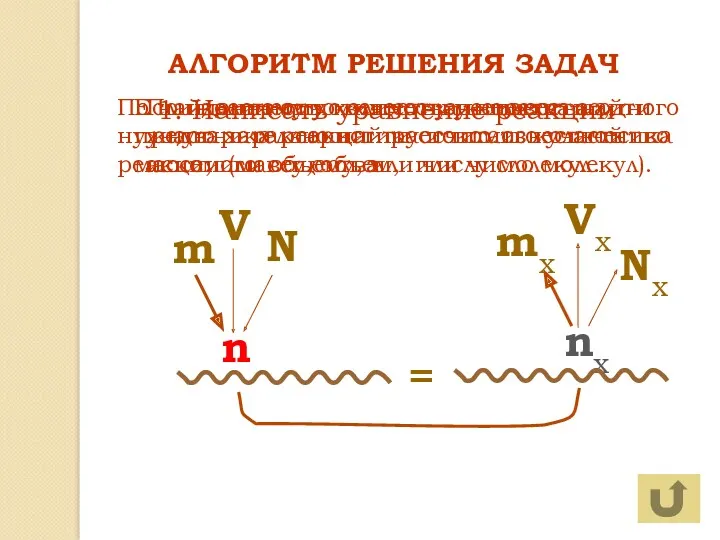
- 4. ? АЛГОРИТМ РЕШЕНИЯ ЗАДАЧ N m V n Nx mx Vx nx 1. Написать уравнение реакции
- 5. Рассчитайте количество вещества алюминия, который потребуется для получения 1,5 моль водорода при реакции с соляной кислотой.
- 6. Дано: n(Al2S3) =2,5 моль n(S) – ? Решение: x моль 2,5 моль 2Al + 3S =
- 7. Дано: m(Cu(OH)2)=14,7 г m(CuO) – ? M(Cu(OH)2) = 64+(16+1)·2 = 98г/моль M(CuO) = 64 +16 =
- 8. Дано: m(Zn)=13 г m(ZnCl2) – ? M(Zn) = 65 г/моль M(ZnCl2 =65 +35,5·2 = 136 г/моль
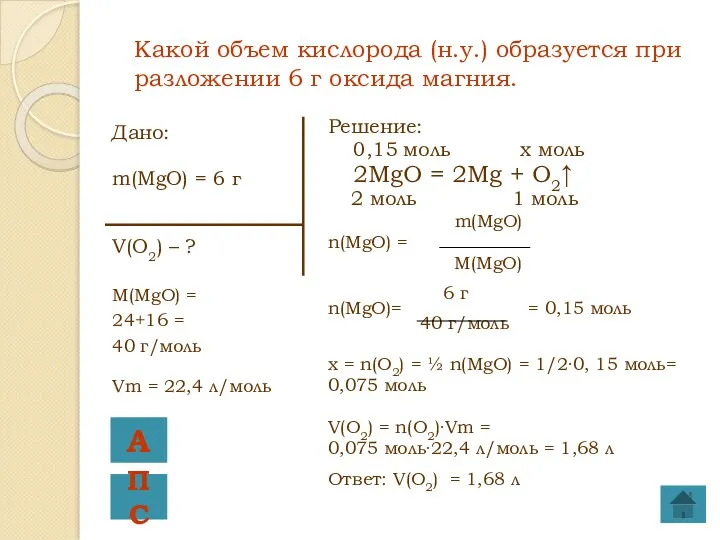
- 9. Дано: m(MgO) = 6 г V(O2) – ? M(MgO) = 24+16 = 40 г/моль Vm =
- 10. Дано: m(Cu)=32 г V(H2) – ? M(Cu) = 64 г/моль Vm = 22,4 л/моль Решение: x
- 11. САМОСТОЯТЕЛЬНАЯ РАБОТА: ВАРИАНТ 1: Вычислите массу меди, которая образуется при восстановлении избытком водорода 4 г оксида
- 12. ДОМАШНЕЕ ЗАДАНИЕ: Рассчитайте, какая масса кислорода образуется при разложении 108 г воды. Вычислите объем (н.у.) газа,
- 14. Скачать презентацию







 Металлы – простые вещества
Металлы – простые вещества Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения
Оксид фосфора(V). Ортофосфорная кислота и ее соли. Минеральные удобрения Органическая химия
Органическая химия Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Коррозия и защита материалов
Коррозия и защита материалов Изучение физико-химических показателей качества макаронных изделий
Изучение физико-химических показателей качества макаронных изделий Хром. Строение атома
Хром. Строение атома Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi
Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi Виды деструкции
Виды деструкции Химиялық тепе-теңдік
Химиялық тепе-теңдік Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Количество вещества. 8 класс
Количество вещества. 8 класс Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс Зависимость свойств веществ от типа химической связи и кристаллической решетки
Зависимость свойств веществ от типа химической связи и кристаллической решетки Получение галогенов. Биологическое значение и применение галогенов
Получение галогенов. Биологическое значение и применение галогенов Периодический закон и периодическая система Д.И. Менделеева
Периодический закон и периодическая система Д.И. Менделеева Общая и неорганическая химия
Общая и неорганическая химия Амины. Анилин
Амины. Анилин Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Поняття про неорганічні та органічні речовини
Поняття про неорганічні та органічні речовини Atomic mass
Atomic mass Окислительновосстановительные реакции (ОВР)
Окислительновосстановительные реакции (ОВР) Зелёная химия
Зелёная химия Химические свойства основных неорганических соединений в свете ЭД и ОВР (9 класс)
Химические свойства основных неорганических соединений в свете ЭД и ОВР (9 класс) Химия и производство
Химия и производство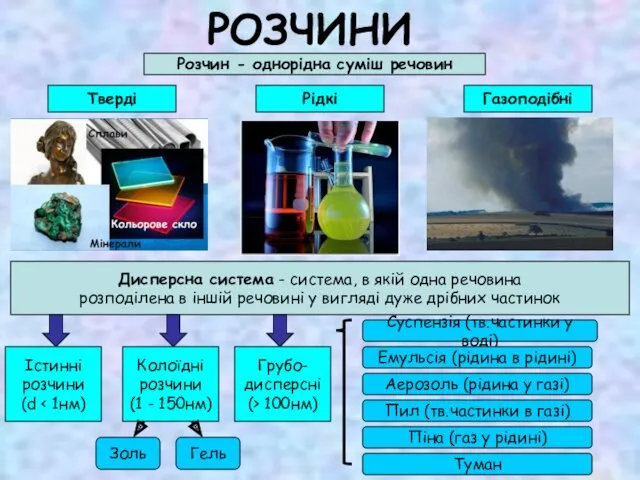 Розчини
Розчини Реакции SR в ряду алканов
Реакции SR в ряду алканов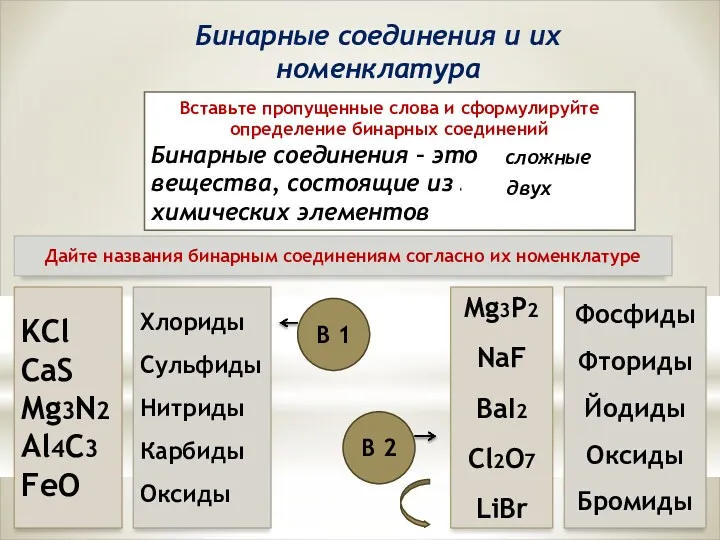 Бинарные соединения и их номенклатура
Бинарные соединения и их номенклатура