Содержание
- 2. 1. Периодический закон (ПЗ) Свойства химических элементов, а также формы и свойства образуемых ими простых веществ
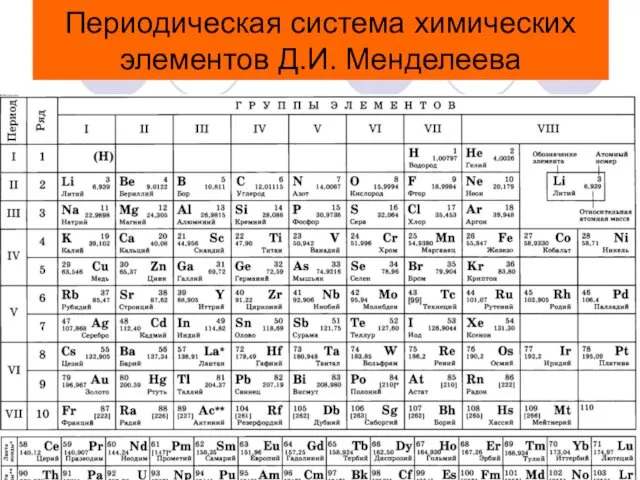
- 3. Периодическая система химических элементов Д.И. Менделеева
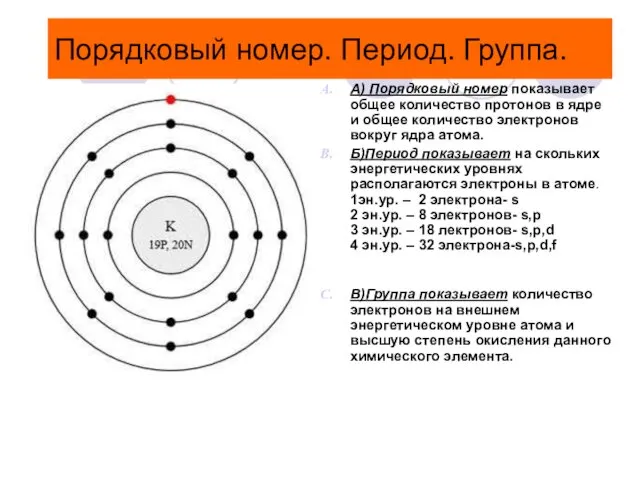
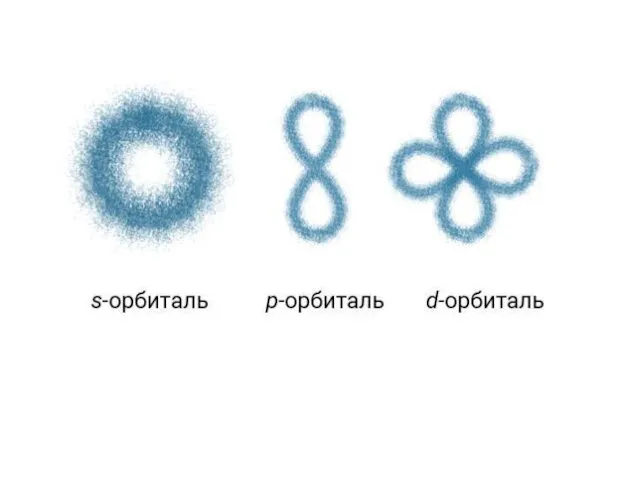
- 4. Порядковый номер. Период. Группа. А) Порядковый номер показывает общее количество протонов в ядре и общее количество
- 6. Практика по первому блоку 1. Охарактеризуйте элементы номер 11,13, 20 по положению в периодической системе. 2.
- 7. 2.Закономерности устанавливаемые ПЗ. а) Металлические свойства – способность химического элемента отдавать электроны с внешнего уровня на
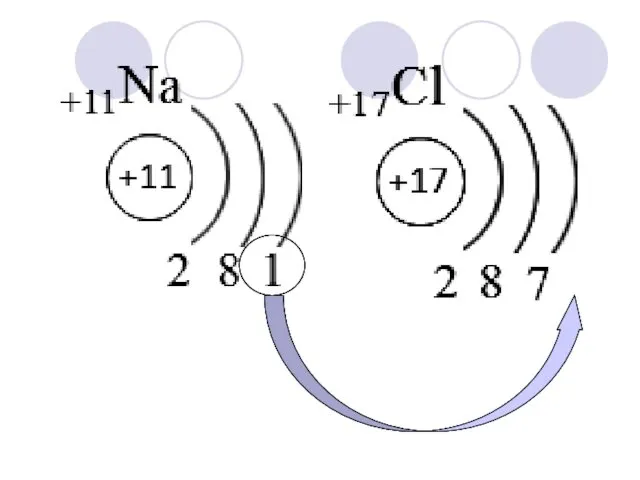
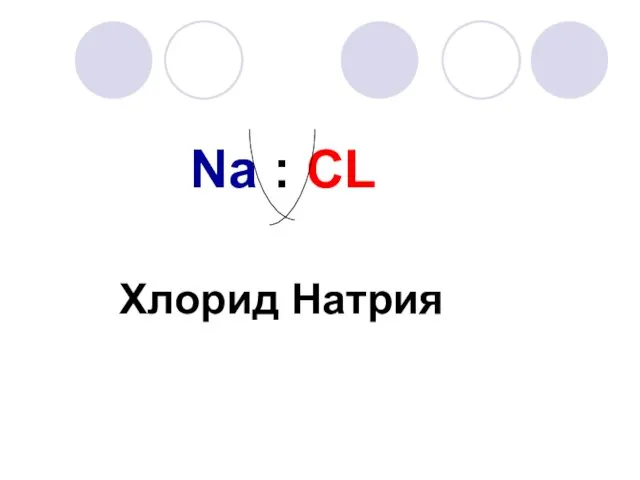
- 9. Na : CL Хлорид Натрия
- 10. – способность принимать электроны. Синоним Неметаллических свойств. Следовательно изменяется также, как Неметаллические свойства элементов в периодической
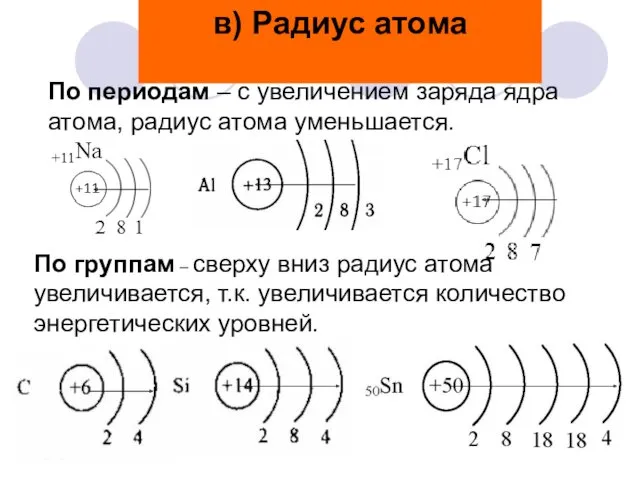
- 11. По периодам – с увеличением заряда ядра атома, радиус атома уменьшается. По группам – сверху вниз
- 12. г) Окислительно-восстановительные свойства химических элементов Восстановительные свойства – способность химического элемента отдавать электроны в ходе химической
- 13. Практика по второму блоку 1.Mg,Si,P,Sr,Mn,Cu,Na - В предсталенном ряду веществ какие из них Ме, а какие
- 14. Как это применить???? 1.
- 15. Задания ЕГЭ. А1.А2.
- 19. Скачать презентацию










 Углеводы. Сn(H2O)m – общая формула углеводов
Углеводы. Сn(H2O)m – общая формула углеводов Химия в косметологии
Химия в косметологии Диеновые углеводороды или алкадиены (тема 4)
Диеновые углеводороды или алкадиены (тема 4) Гибридизация атомных орбиталей
Гибридизация атомных орбиталей Методы получения порошков карбидов
Методы получения порошков карбидов Облагораживание тяжелых нефтей и природных битумов
Облагораживание тяжелых нефтей и природных битумов Строение атома
Строение атома Сполуки неметалічних елементів з Гідрогеном
Сполуки неметалічних елементів з Гідрогеном Вуглеводні. Лекція 11
Вуглеводні. Лекція 11 Дисперсные системы (продолжение)
Дисперсные системы (продолжение) Значення хімії у житті людини
Значення хімії у житті людини Материаловедение и технология обработки материалов
Материаловедение и технология обработки материалов Студенттің өзіндік жұмысы
Студенттің өзіндік жұмысы Применение солей
Применение солей Строение вещества. Химическая связь
Строение вещества. Химическая связь Хімічна рівновага
Хімічна рівновага Почему нефть называют черным золотом
Почему нефть называют черным золотом фосфор
фосфор алкадиены
алкадиены Массовая доля растворенного вещества в растворе
Массовая доля растворенного вещества в растворе Материалы с высокой удельной прочностью
Материалы с высокой удельной прочностью Кристаллические решетки
Кристаллические решетки Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага
Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Фенол и его свойства
Фенол и его свойства Су қоймасындағы тіршілік үшін темірдің рөлі
Су қоймасындағы тіршілік үшін темірдің рөлі Полисахариды. Крахмал
Полисахариды. Крахмал Азотсодержащие органические соединения. Амины (часть 1)
Азотсодержащие органические соединения. Амины (часть 1)