Содержание
- 2. Строение коллоидных частиц лиофобных золей Мицелла – структурная коллоидная единица, состоящая из микрокристалла ДФ, окруженной сольватированными
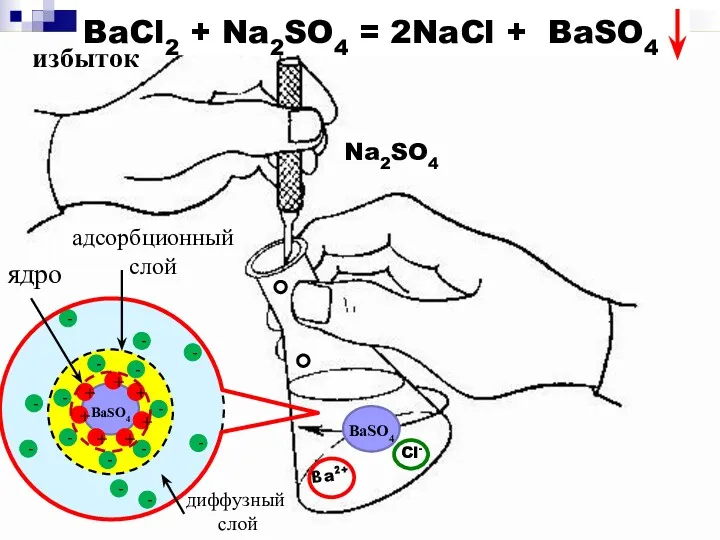
- 4. избыток - BaSO4 BaSO4
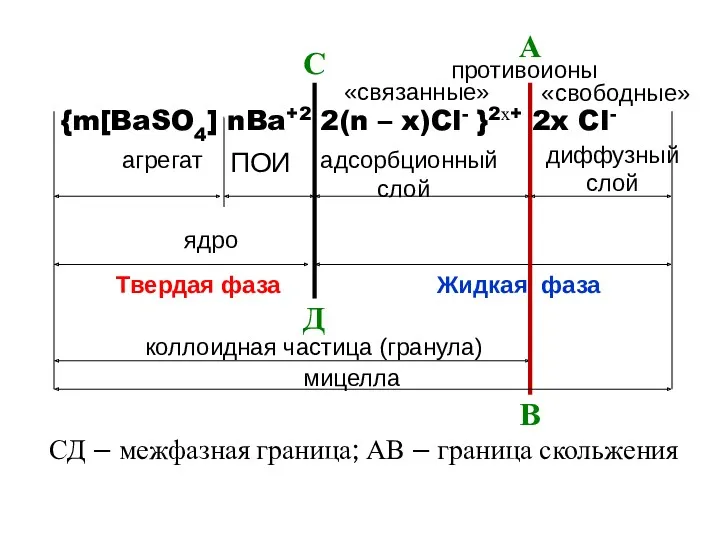
- 5. {m[BaSO4] n Ba2+ 2(n – x) Cl- }2х+ 2xCl- агрегат ПОИ адсорбционный диффузионный слой слой противоионы
- 6. {m[BaSO4] nSO42- 2(n – x) Na+ }2х- 2xNa+ агрегат ПОИ адсорбционный диффузионный слой слой противоионы ядро
- 7. Строение мицеллы слюны Помимо органических веществ в состав слюны входят ионы: Cl-, Mg+2, NH4+, Na+, K+,
- 8. агрегат ПОИ адсорбционный диффузный слой слой противоионы ядро коллоидная частица (гранула) мицелла {m[BaSO4] nBa+2 2(n –
- 9. Граница скольжения (АВ) является той поверхностью, по которой происходит разделений («разрыв») мицеллы на коллоидную частицу (ДФ)
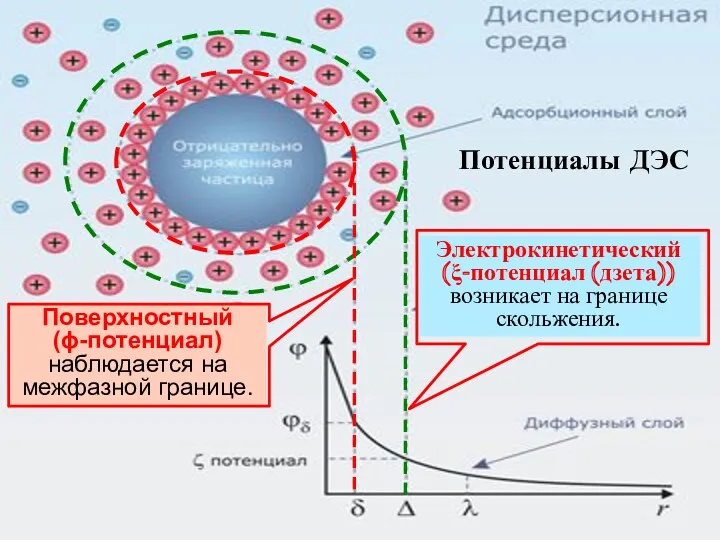
- 10. Потенциалы ДЭС Поверхностный (ϕ-потенциал) наблюдается на межфазной границе.
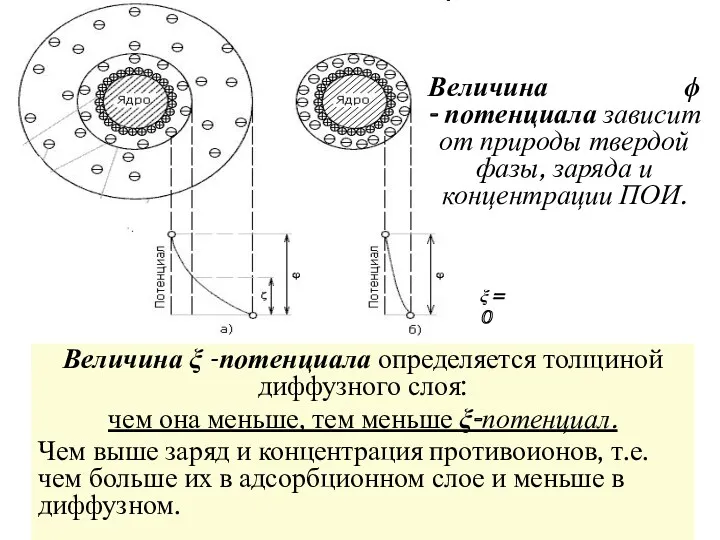
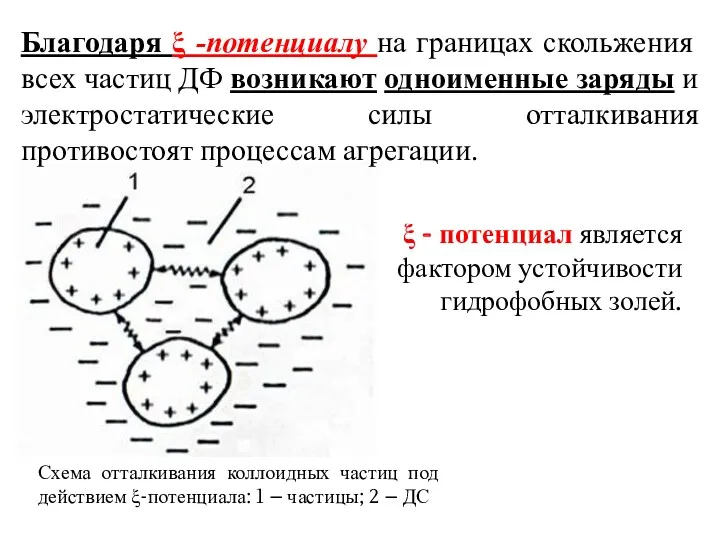
- 11. ξ = 0 Величина ξ -потенциала определяется толщиной диффузного слоя: чем она меньше, тем меньше ξ-потенциал.
- 12. Благодаря ξ -потенциалу на границах скольжения всех частиц ДФ возникают одноименные заряды и электростатические силы отталкивания
- 13. Под устойчивостью коллоидной системы понимают её способность сохранять во времени: средний размер частиц; их равномерное распределение
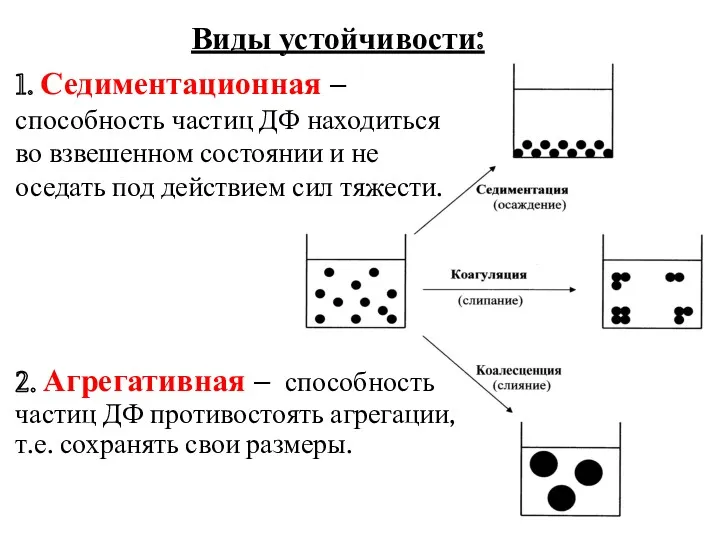
- 14. Виды устойчивости: 1. Седиментационная – способность частиц ДФ находиться во взвешенном состоянии и не оседать под
- 15. Коагуляция дисперсных систем
- 16. Коагуляция - процесс слипания частиц ДФ. Скрытая. Стадия агрегации, при которой не наблюдается каких либо внешних
- 17. Факторы, вызывающие коагуляцию изменение температуры; концентрирование; механическое воздействие; действие света и различного рода излучений, действие электрических
- 18. Коагуляция под действием электролитов Коагуляция отрицательно заряженного золя ионами: а) Fe3+; б) Са2+; в) Na+ а
- 19. Порог коагуляции. Коагулирующая способность Порог коагуляции (СПК) – минимальное количество электролита, которое необходимо добавить к коллоидному
- 20. ЛИОФИЛЬНЫЕ СИСТЕМЫ
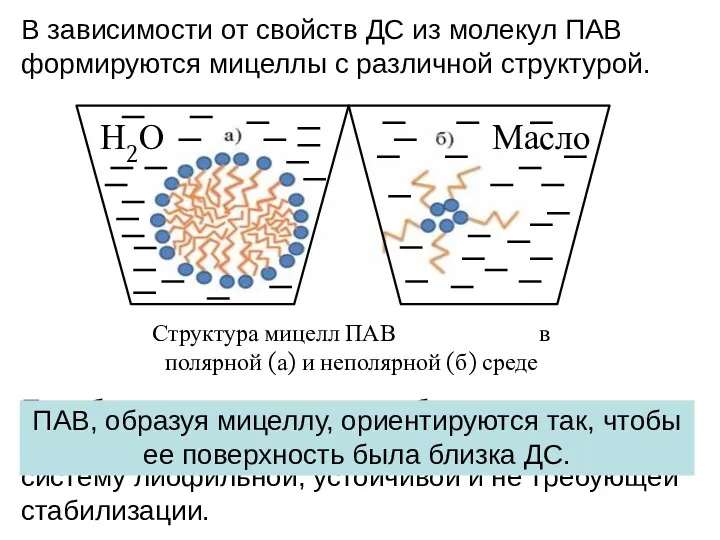
- 21. К лиофильным коллоидным растворам относятся растворы ПАВ и ВМС. Мицеллами лиофильных коллоидных растворов называются ассоциаты из
- 22. В зависимости от свойств ДС из молекул ПАВ формируются мицеллы с различной структурой. Структура мицелл ПАВ
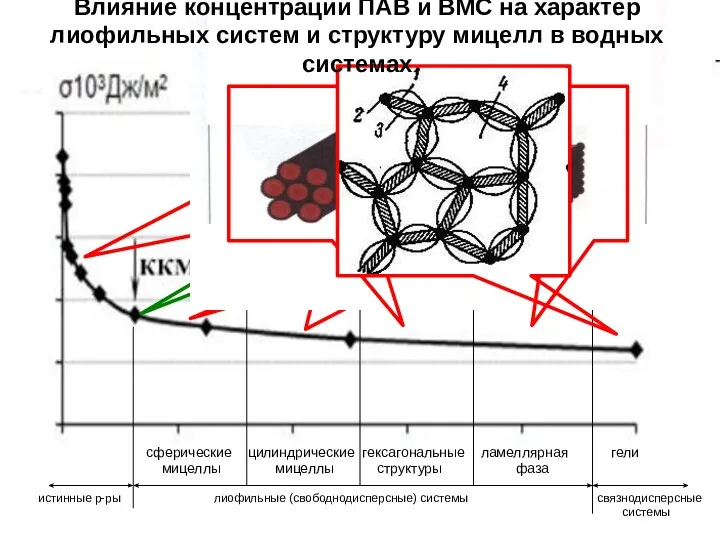
- 23. сферические цилиндрические гексагональные ламеллярная гели мицеллы мицеллы структуры фаза истинные р-ры лиофильные (свободнодисперсные) системы связнодисперсные системы
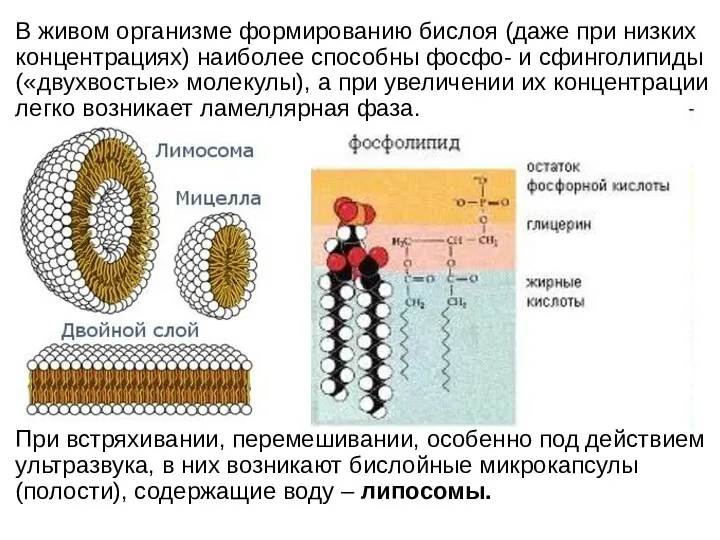
- 24. В живом организме формированию бислоя (даже при низких концентрациях) наиболее способны фосфо- и сфинголипиды («двухвостые» молекулы),
- 26. Скачать презентацию


![{m[BaSO4] n Ba2+ 2(n – x) Cl- }2х+ 2xCl- агрегат](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/269813/slide-4.jpg)
![{m[BaSO4] nSO42- 2(n – x) Na+ }2х- 2xNa+ агрегат ПОИ](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/269813/slide-5.jpg)










 Алкины. Химические свойства и способы получения алкинов
Алкины. Химические свойства и способы получения алкинов Индикаторы окислительно-восстановительного титрования и их применение в анализе лекарственных препаратов
Индикаторы окислительно-восстановительного титрования и их применение в анализе лекарственных препаратов Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2
Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2 Правила техники безопасности при работе в кабинете химии
Правила техники безопасности при работе в кабинете химии Титан. Хром
Титан. Хром Основные разделы химии
Основные разделы химии Субстраты и продукты биохимических реакций
Субстраты и продукты биохимических реакций Хромотография, явления, атомы и молекулы. 8 класс
Хромотография, явления, атомы и молекулы. 8 класс Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Ионная хроматография
Ионная хроматография Валентность химических элементов. 8 класс
Валентность химических элементов. 8 класс Щелочные металлы. 9 класс
Щелочные металлы. 9 класс История органической химии. Характерные особенности органических соединений
История органической химии. Характерные особенности органических соединений Асфальтены в тяжелых нефтях и битумах. Химическое строение и влияние на свойства
Асфальтены в тяжелых нефтях и битумах. Химическое строение и влияние на свойства Электрохимические процессы
Электрохимические процессы Alkynes
Alkynes Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции
Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции Вуглеводні. Підсумковий урок 9 клас
Вуглеводні. Підсумковий урок 9 клас Теория возникновения электродных и ОВ-потенциалов
Теория возникновения электродных и ОВ-потенциалов Аммиак
Аммиак Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс
Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс Химические свойства кислот
Химические свойства кислот Взаємодія кисеню зі складними речовинами
Взаємодія кисеню зі складними речовинами Розрахунки за хімічними рівняннями
Розрахунки за хімічними рівняннями Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Наноструктурные и нанокристаллические материалы
Наноструктурные и нанокристаллические материалы Железо. Строение атома, физические и химические свойства простого вещества
Железо. Строение атома, физические и химические свойства простого вещества Влияние этилового спирта на организм детей
Влияние этилового спирта на организм детей