Содержание
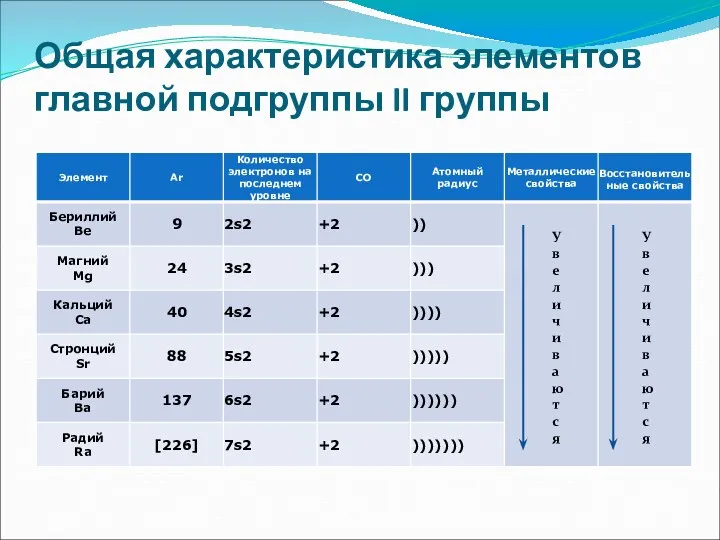
- 2. Общая характеристика элементов главной подгруппы II группы У в е л и ч и в а
- 3. Ве - амфотерный металл, Mg – металл, Сa, Sr,Ba - щёлочноземельные металлы Ra –радиоактивный элемент
- 4. Общая характеристика элементов главной подгруппы II группы Одинаковое строение внешнего электронного слоя Элементы проявляют СО +2
- 5. Be – светло-серый, твердый, хрупкий Ca – твердый, пластичный Mg – относительно мягкий, пластичный, ковкий Sr
- 6. Химические свойства элементов II группы главной подгруппы
- 7. Химические свойства элементов II группы главной подгруппы
- 8. Химические свойства оксидов BeO – амфотерный оксид MgO CaO SrO Основные оксиды BaO Оксид кальция СаО
- 9. Взаимодействие оксида кальция с водой ( гашение извести)
- 10. Химические свойства гидроксидов Ве(ОН)2 – амфотерный гидроксид Mg(OH)2 – нерастворимое основание Ca(OH)2 Sr(OH)2 Ba(OH)2 Растворимые основания
- 13. Напишите уравнения реакций с помощью которых можно осуществить превращения: Са(ОН)2 ←Са→СаО→Са(ОН)2→Са(NO3)2→CaSO4 Be→BeO→BeCl2→Be(OH)2→Na2BeO2 ↓ BeSO4
- 15. Скачать презентацию











 Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Галогены. Положение в периодической системе. Химические свойства
Галогены. Положение в периодической системе. Химические свойства Аммиак. Физические и химические свойства. Получение, применение
Аммиак. Физические и химические свойства. Получение, применение Комплексні сполуки. Комплексоутворення в біологічних системах
Комплексні сполуки. Комплексоутворення в біологічних системах Химические свойства солей
Химические свойства солей Уравнения химических реакций. Алгоритм расстановки коэффициентов
Уравнения химических реакций. Алгоритм расстановки коэффициентов Зелёные камни
Зелёные камни Вчення про розчини. Рівновага в розчинах електролітів
Вчення про розчини. Рівновага в розчинах електролітів Гидролиз солей (11 класс)
Гидролиз солей (11 класс) Технология переработки полимеров
Технология переработки полимеров Карбоновые кислоты. Свойства карбоновых кислот
Карбоновые кислоты. Свойства карбоновых кислот Спирты (алканолы)
Спирты (алканолы) 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Introduction to Periodic Table
Introduction to Periodic Table Ауыр металлдар
Ауыр металлдар Розв’язування розрахункових хімічних задач. Методичні рекомендації для вчителів хімії та школярів
Розв’язування розрахункових хімічних задач. Методичні рекомендації для вчителів хімії та школярів Learning Objectives
Learning Objectives Предельные углеводороды
Предельные углеводороды Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування Элементы подгруппы углерода
Элементы подгруппы углерода Ионная связь
Ионная связь Кристаллические решетки. (8 класс)
Кристаллические решетки. (8 класс) Спирты. Понятие о спиртах
Спирты. Понятие о спиртах Химические реакции
Химические реакции Розв’язання експериментальних задач. Практична робота №2
Розв’язання експериментальних задач. Практична робота №2 Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Пластмассы
Пластмассы