Содержание
- 2. 1. История открытия галогенов 2. Положение в Периодической системе 3. Химические свойства 4. Применение 5.Проверка знаний
- 3. Фтор История открытия галогенов Хлор Бром Йод Астат
- 4. В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в
- 5. В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное вещество и назвал
- 6. В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал
- 7. В 1811 году французский химик Бернар Куртуа открыл иод путём перегонки маточных растворов от своего азотнокислого
- 8. В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»). Впервые астат
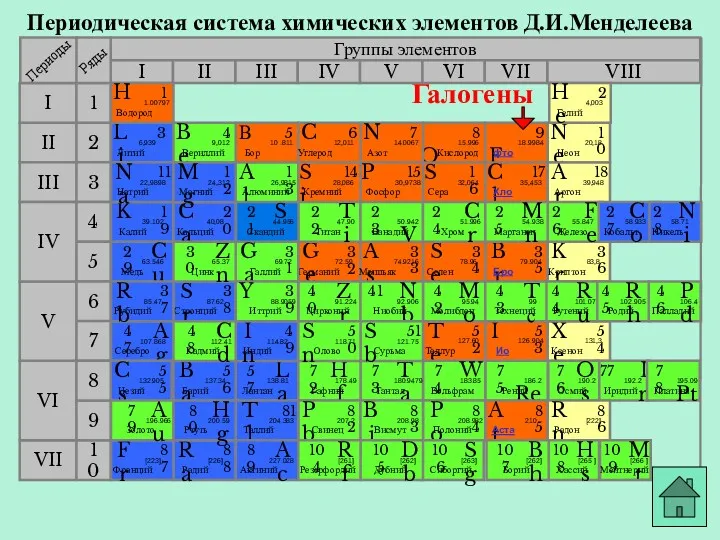
- 9. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 10. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 11. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 12. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 13. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 14. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 15. Химические свойства – ДОПИШИ УРАВНЕНИЯ! 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании
- 16. Химические свойства- ДОПИШИ УРАВНЕНИЯ! Cl2 - сильно реакционноспособен (исключение C, O2, N2 и некот. др.) С
- 17. Химические свойства Br2 - реакционноспособен С простыми веществами: С металлами С неметаллами Al + Br2 →
- 18. Химические свойства- ДОПИШИ УРАВНЕНИЯ! I2 - химически наименее активен С простыми веществами: С металлами С неметаллами
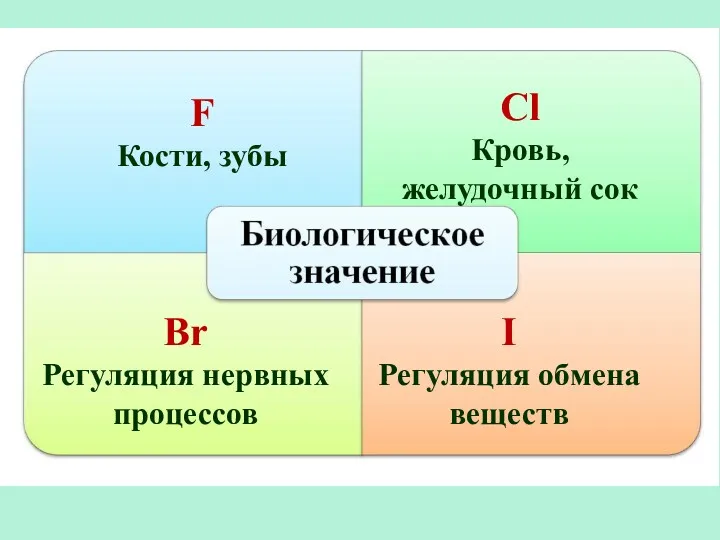
- 19. F Кости, зубы Сl Кровь, желудочный сок Br Регуляция нервных процессов I Регуляция обмена веществ
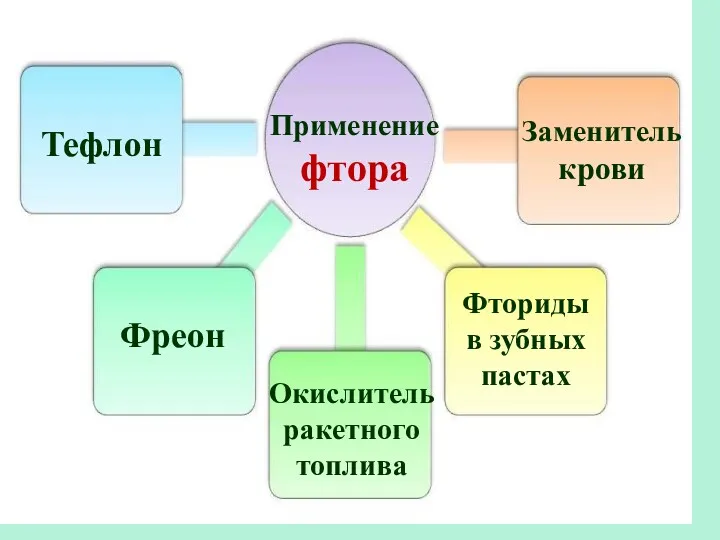
- 20. Применение фтора Тефлон Фреон Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах
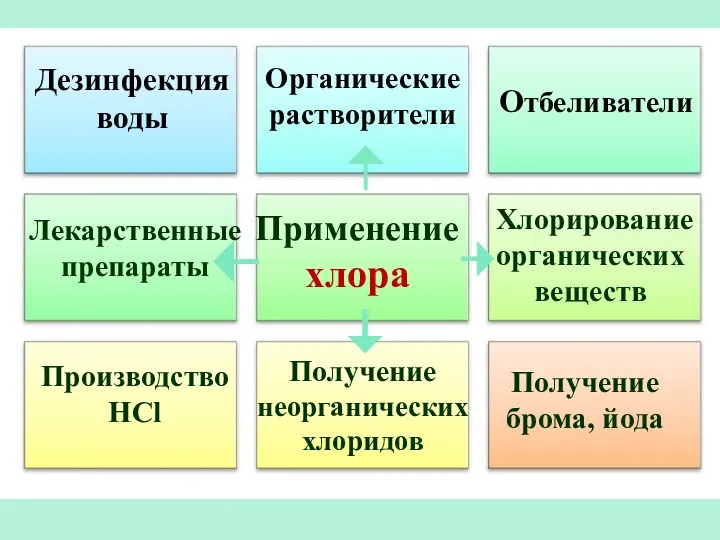
- 21. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
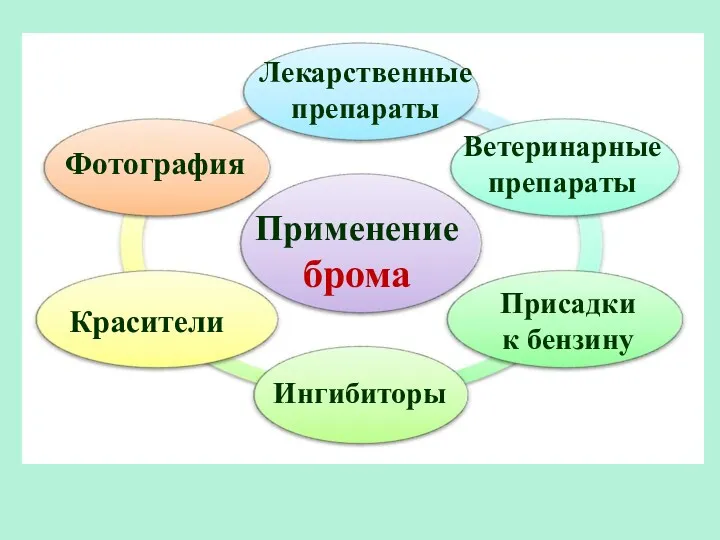
- 22. Применение брома Лекарственные препараты Красители Фотография Ветеринарные препараты Ингибиторы Присадки к бензину
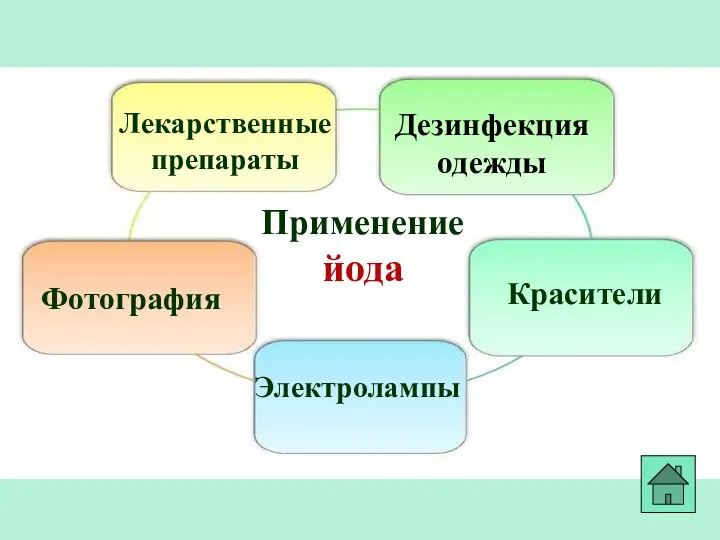
- 23. Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы
- 24. Физические свойства галогенов Заполни пропуски Фтор - , в воде , так как интенсивно с ней
- 25. Химические свойства галогенов Поставь коэффициенты. Для последнего уравнения напиши электронный баланс. Na + Cl2 = NaCl
- 27. Скачать презентацию


















 Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов
Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Классификация химических веществ СГС
Классификация химических веществ СГС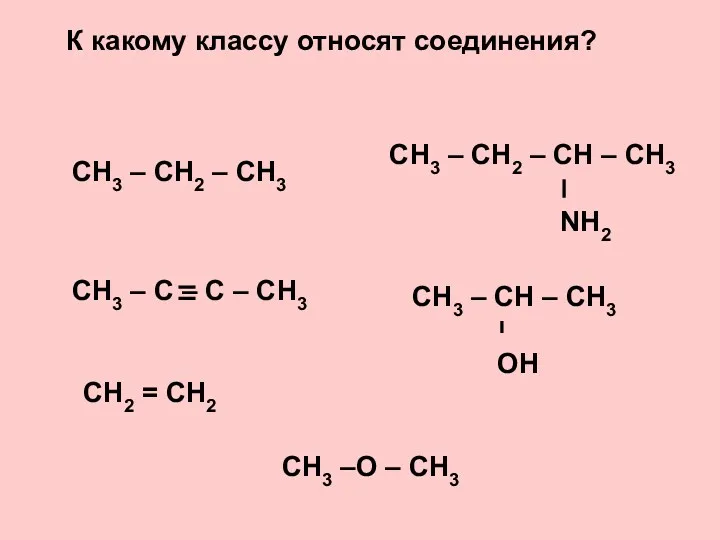 16_OP_05_Alkany
16_OP_05_Alkany Характеристика щелочных металлов
Характеристика щелочных металлов Азотная кислота и ее свойства
Азотная кислота и ее свойства Спирты
Спирты Прочность полимеров
Прочность полимеров Массообменные процессы
Массообменные процессы Фармакология. Окисление
Фармакология. Окисление Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Химиялық ыдыстарды тазалау
Химиялық ыдыстарды тазалау Энергетика химических процессов. Химическая термодинамика
Энергетика химических процессов. Химическая термодинамика Монотерпеноиды. Химическое строение и общая характеристика. Тема № 2
Монотерпеноиды. Химическое строение и общая характеристика. Тема № 2 Классификация химических элементов
Классификация химических элементов Химия и производство
Химия и производство Изучение раздела Углеводороды в курсе органической химии в старшей школе
Изучение раздела Углеводороды в курсе органической химии в старшей школе Химические свойства металлов. Взаимодействие с простыми веществами
Химические свойства металлов. Взаимодействие с простыми веществами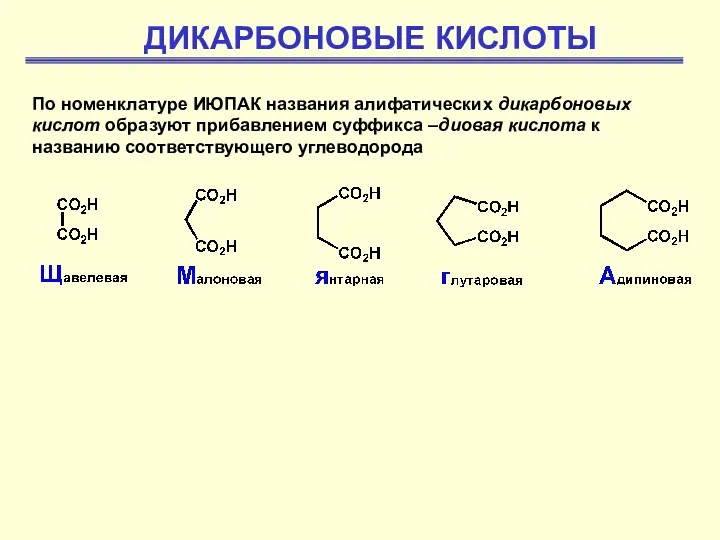 Дикарбоновые кислоты
Дикарбоновые кислоты Химические уравнения
Химические уравнения Химия в искусстве
Химия в искусстве Благородные газы
Благородные газы Руды металлов
Руды металлов Диеновые углеводороды
Диеновые углеводороды Существенные изменения в измерителях ЕГЭ по химии
Существенные изменения в измерителях ЕГЭ по химии Классификация химических элементов в географической оболочке
Классификация химических элементов в географической оболочке Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия
Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы