Слайд 2

План
Сегодня мы рассмотрим:
Основные свойства, историю открытия
Физические и химические свойства
Разберем где они
применяются
И ответим на вопросы, что бы проверить, как вы усвоили материал, запоминайте)
Слайд 3

Основные свойства и
история открытия
Благоро́дные газы (также инертные или редкие газы)
— химические элементы VIII группы. К благородным газам относятся гелий, неон, аргон, криптон, ксенон и радон.
Слайд 4

Аргон
Был открыт в 1894 году. В это время возник научный спор
между двумя британскими учеными - лордом Рэлеем и Вильямом Рамзаем. Релею пришло в голову, что азот, полученный из воздуха после удаления кислорода, имел плотность несколько большую, чем азот, полученный химическим путем.
Слайд 5

Аргон
Все лето 1894 года лорд Релей и Рамзай вели оживленную переписку
и 18 августа сообщили об открытии новой составной части атмосферы – аргона. Рамзай продолжил свои опыты и выяснил, что аргон еще более инертен, чем азот, и, очевидно, вообще не реагирует с каким-либо другим химическим веществом. Именно за это свойство он получил свое название: «аргон» – от греческого «инертный».
Слайд 6

Гелий
Лишь в 1895 году английский физик и химик Уильям Рамзай открыл
впервые гелий на Земле. При нагревании радиоактивного минерала клевеита он увидел в спектре выделенного газа ту же спектральную линию
Слайд 7

Криптон, Ксенон,Неон
Немец Линде и англичанин Хемпсон практически одновременно опубликовали новый способ
сжижения воздуха. Этим методом и воспользовался Рамзай и, действительно, с его помощью смог обнаружить в определенных фракциях сжиженного воздуха недостающие газы: криптон («затаившийся»), ксенон («чужой») и неон («новый»)
Слайд 8

Физические свойства. Химические свойства.
Инертные газы обладают более высокой электропроводностью по сравнению
с другими газами и при прохождении через них тока ярко светятся: гелий ярко-жёлтым светом, потому что в его сравнительно простом спектре двойная жёлтая линия преобладает над всеми другими; неон огненно красным светом, так как самые яркие его линии лежат в красной части спектра. Насыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом.
Слайд 9

В 1962 году Бартлетт ставит опыт и при комнатной температуре из
газообразного гексафторида платины и газообразного ксенона получает твердое оранжево - желтое вещество — гексафторплатинат ксенона XePtF6, поведение которого ничем не отличается от поведения обычных химических соединений. Заставить ксенон вступить в реакцию без участия фтора (или некоторых его соединений) пока не удалось Для гелия, неона и аргона стабильные фторидные соединения пока неизвестны.
Слайд 10

Получение и применение Гелия
В промышленности гелий получают из гелийсодержащих природных газов.
От других газов гелий отделяют методом глубокого охлаждения, используя то, что он сжижается труднее всех остальных газов.
Используется в качестве хладагента для получения сверхнизких температур (в частности, для перевода металлов в сверхпроводящее состояние)
Для наполнения воздухоплавающих судов (дирижабли и аэростаты) — при незначительной по сравнению с водородом потере в подъемной силе гелий в силу негорючести абсолютно безопасен
В дыхательных смесях для глубоководного погружения
Для наполнения воздушных шариков и оболочек метеорологических зондов
Для заполнения газоразрядных трубок
В качестве теплоносителя в некоторых типах ядерных реакторов
Слайд 11

Применение Неона
Неон используется для заполнения ламп накаливания, сигнальных ламп и газоразрядных
трубок, дающих красновато-оранжевое свечение и используемых при изготовлении светящихся реклам.
Слайд 12

Применение Аргона
Аргон все шире применяется в дуговой электросварке. В аргонной струе
можно сваривать тонкостенные изделия и металлы, которые прежде считались трудносвариваемыми. Продуваемый вдоль столба дуги аргон предохраняет кромки разреза и вольфрамовый электрод от образования окисных, нитридных и иных пленок. Одновременно он сжимает и концентрирует дугу на малой поверхности, отчего температура в зоне резки достигает 4000—6000° С.
Слайд 13

Примение Криптона
Криптон применяется в газоразрядных трубках, а также используется как эталон
единицы длины в системе СИ
Слайд 14

Применение
Ксенона
В светотехнике признание получили ксеноновые лампы высокого давления.
Ксеноном пользуются и медики
— при рентгеноскопических обследованиях головного мозга. Ксенон сильно поглощает рентгеновское излучение и помогает найти места поражения. При этом он совершенно безвреден. Активный изотоп ксенона, ксенон - 133, используют при исследовании функциональной деятельности легких и сердца.
Слайд 15

Применение Радона
Радон применяют главным образом в медицине. В радиационной терапии его
используют для обработки злокачественных опухолей. В физиотерапии радоновые ванны назначают для лечения заболеваний центральной нервной системы, а также сердечно-сосудистых и кожных заболеваний.
Слайд 16

Тестовые задания для повторения и контроля
Слайд 17

Криптон
К благородным газам относятся все, кроме:
А. Ксенон Б. Криптон В. Радий
Слайд 18

Вопрос 2
Максимальная валентность благородных газов равна:
А. 1 Б. 8 В.0 Г.
7
Слайд 19

Вопрос 3
Сверкающая желтая линия спектра характерна для:
А. Гелий Б. Аргон В.
Радон Г. Ксенон
Слайд 20

Вопрос 4
Кто первым ввел в Периодическую систему нулевую группу?
А. Релей Б.
Рамзай В. Менделеев Г. Бартлетт
Слайд 21

Вопрос 5
Какой газ используется в основном в медицине?
А. Неон Б. Гелий
В. Радон Г. Криптон
Слайд 22

Вопрос 6
Какой газ используется для определения эталона в системе СИ?
А. Неон
Б. Гелий В. Радон Г. Криптон
Слайд 23

Вопрос 7
Какой газ был впервые открыт на Солнце и лишь затем
на Земле?
А. Неон Б. Гелий В. Радон Г. Криптон






















 Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения Классы неорганических соединений
Классы неорганических соединений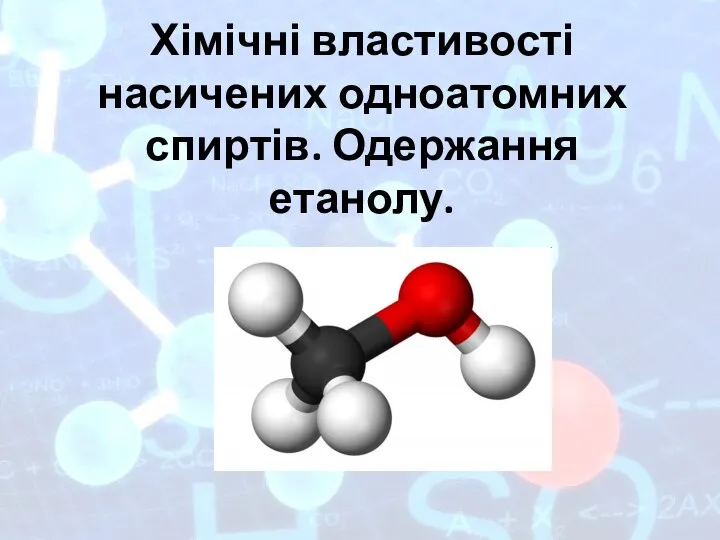 Хімічні властивості насичених одноатомних спиртів. Одержання етанолу
Хімічні властивості насичених одноатомних спиртів. Одержання етанолу Твёрдое агрегатное состояние. Кристалические решетки. Урок 4
Твёрдое агрегатное состояние. Кристалические решетки. Урок 4 Розчини високомолекулярних сполук
Розчини високомолекулярних сполук Кислоты. Определение рН кислоты, щелочи, воды
Кислоты. Определение рН кислоты, щелочи, воды Химия аминокислот, пептидов и белков
Химия аминокислот, пептидов и белков Физико-химия поверхностных явлений
Физико-химия поверхностных явлений Карбонилсодержащие соединения. Строение и химические свойства карбоновых кислот. Липиды. Фосфолипиды
Карбонилсодержащие соединения. Строение и химические свойства карбоновых кислот. Липиды. Фосфолипиды Каменный уголь и методы его переработки
Каменный уголь и методы его переработки Лабораторный штатив
Лабораторный штатив Многоатомные спирты
Многоатомные спирты Алкадиены: строение, номенклатура, гомологи, изомерия
Алкадиены: строение, номенклатура, гомологи, изомерия Азот, фосфор и их соединения
Азот, фосфор и их соединения Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі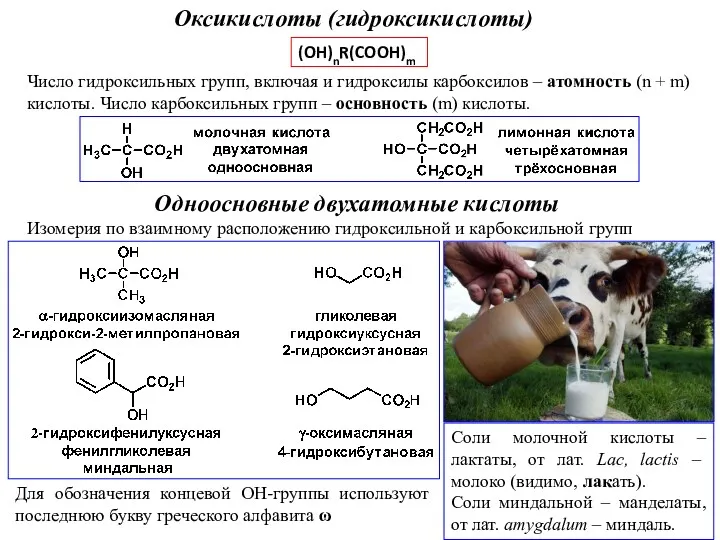 Оксикислоты (гидроксикислоты)
Оксикислоты (гидроксикислоты) Химия и производство
Химия и производство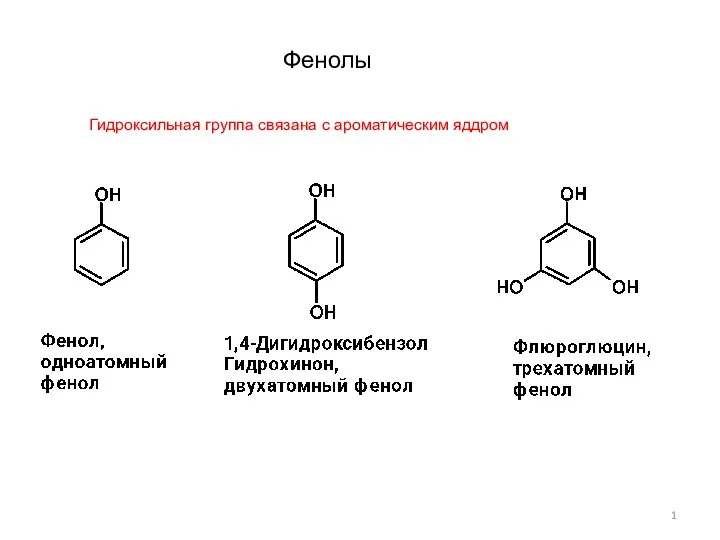 Фенолы-1
Фенолы-1 Азотная кислота
Азотная кислота Жир жиру рознь. Супер омега 3
Жир жиру рознь. Супер омега 3 Функциональные производные карбоновых кислот
Функциональные производные карбоновых кислот Новые катализаторы
Новые катализаторы Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья
Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья Пиролиз углеводородного сырья
Пиролиз углеводородного сырья ГИА-9 Химия. А4
ГИА-9 Химия. А4 Гидролиз солей (11 класс)
Гидролиз солей (11 класс) Лекарственные растения, содержащие простые фенолы, лигнаны и кумарины
Лекарственные растения, содержащие простые фенолы, лигнаны и кумарины Химия. 9 класс
Химия. 9 класс