Содержание
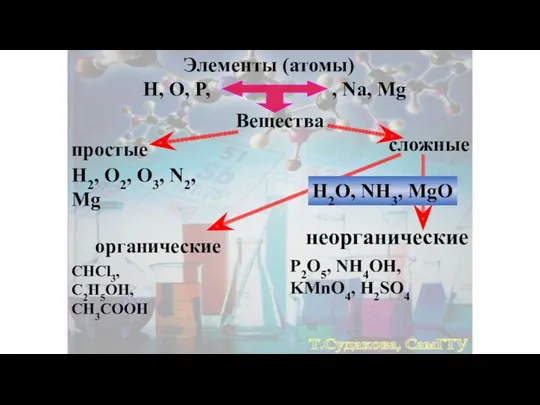
- 2. Элементы (атомы) H, O, P, , Na, Mg Вещества простые сложные H2, O2, O3, N2, Mg
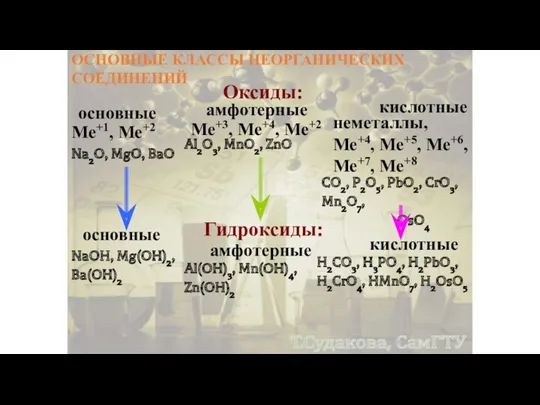
- 3. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Оксиды: основные амфотерные кислотные Ме+1, Ме+2 Ме+3, Ме+4, Ме+2 неметаллы, Ме+4, Ме+5,
- 4. Соли: средние Na2CO3, Na2SO4, MgSO4 кислые NaHCO3, NaHSO4, Mg(HSO4)2 карбонат гидрокарбонат сульфат гидросульфат основные (MgOH)2SO4, (ZnOH)2CO3,
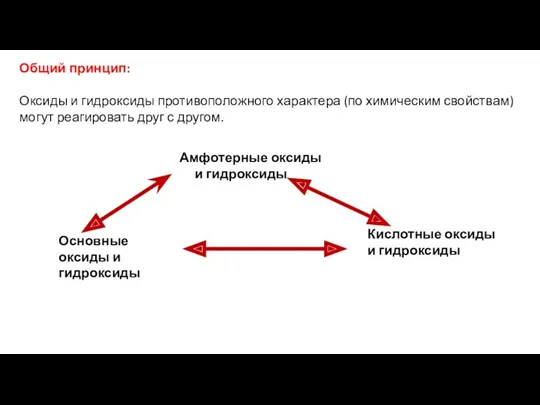
- 5. Общий принцип: Оксиды и гидроксиды противоположного характера (по химическим свойствам) могут реагировать друг с другом. Амфотерные
- 6. Примеры: 1. Взаимодействие основных с кислотными оксидами и кислотами: основный оксид + кислота = соль +
- 7. 3. Взаимодействие с амфотерными оксидами и гидроксидами. При взаимодействии основных оксидов с амфотерными образуются соли: основный
- 8. ОСНОВНЫЕ СВОЙСТВА АМФОТЕРНЫХ Оксид + кислота → соль + вода Только с сильными кислотами ZnO +
- 9. КИСЛОТНЫЕ СВОЙСТВА АМФОТЕРНЫХ 1. При сплавлении с оксидами металлов образует соли, в которых амфотерный металл образует
- 10. Свойства кислотных оксидов и гидроксидов. Кислотный оксид + вода → кислота Оксид реагирует с водой, если
- 11. 3. Кислотный оксид + основание (щелочь) → соль + вода Реакция возможна только со щелочами. (SO3,
- 12. Для приведенных ниже веществ укажите, к какому классу (оксиды, гидроксиды, соли) соединений они относятся: CuSO4 соль
- 13. 4. Для соли, указанной в задании 1, напишите уравнение реакции ее получения и укажите тип соли
- 14. Какие соли можно получить из следующих веществ: CuSO4, AgNO3, K3PO4, BaCl2 CuSO4 + 2AgNO3 = Cu(NO3)2
- 15. Какие кислоты могут быть получены при непосредственном взаимодействии с водой следующих оксидов: Р2О5, СО2, СrО3, SO2,
- 16. 15. Какие из указанных газов вступают в химическое взаимодействие с раствором щелочи: НСl, Н2S, NO2, SО2,
- 17. Напишите уравнения реакций, характеризующих химические свойства указанных соединений: оксид меди (II), гидроксид железа (III). оксид меди
- 19. Скачать презентацию













 Люминесцентный анализ
Люминесцентный анализ Термодинамика химических процессов
Термодинамика химических процессов Вcтуп до курсу Класифікації отрут і отруєнь. Токсикометрія
Вcтуп до курсу Класифікації отрут і отруєнь. Токсикометрія Полимеры (10 класс)
Полимеры (10 класс) Периодический закон и периодическая система химических элементов
Периодический закон и периодическая система химических элементов Серная кислота и её свойства
Серная кислота и её свойства Индикаторы кислотно-основного титрования
Индикаторы кислотно-основного титрования Высокомолекулярные соединения. Общий курс
Высокомолекулярные соединения. Общий курс Химическая промышленность
Химическая промышленность Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості Азотовмісні сполуки
Азотовмісні сполуки Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Хімічні властивості кислот
Хімічні властивості кислот Основные этапы первичного процесса переработки нефти
Основные этапы первичного процесса переработки нефти Методика преподавания химии
Методика преподавания химии Отчет по исследовательской работе Образование АСПО
Отчет по исследовательской работе Образование АСПО Закон сохранения массы веществ. Урок вместе с умной колонкой
Закон сохранения массы веществ. Урок вместе с умной колонкой Получение и применение алканов
Получение и применение алканов Розв'язування задач за рівнянням хімічних реакцій
Розв'язування задач за рівнянням хімічних реакцій Кислород/водород. Повторение
Кислород/водород. Повторение История открытия химических веществ
История открытия химических веществ Некоторые структурные особенности макромолекул
Некоторые структурные особенности макромолекул 20231009_zhyostkost_vody
20231009_zhyostkost_vody Сложные эфиры. 10 класс
Сложные эфиры. 10 класс Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара
Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара Железо и его соединения
Железо и его соединения Особенности сжигания жидкого топлива и топливосжигающие устройства
Особенности сжигания жидкого топлива и топливосжигающие устройства Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері
Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері