Содержание
- 2. Понятия, используемые в термодинамике: Химическая термодинамическая система- часть пространства, содержащее одно или несколько веществ, реально или
- 3. Внутренняя энергия (U) –представляет энергию движения и местоположения молекул, атомов, ядер и электронов, а также энергию
- 4. Абсолютное значение внутренней энергии определить невозможно. Для химии, однако, важно не абсолютное значение, а изменение внутренней
- 5. Система может обмениваться с внешней средой энергией в форме теплоты q и работы А Изменение внутренней
- 6. При постоянном давлении (это большинство химических процессов) работа совершается по изменению объёма системы – работа расширения
- 7. Количество выделенной или поглощённой теплоты называют тепловым эффектом. Тепловой эффект реакции при постоянном давлении называют энтальпией
- 8. Для сравнения энтальпии (тепловых эффектов) различных реакций значения этих величин приводят к одинаковым условиям (давление, температура)
- 9. Энтальпия образования простых веществ принимается равным нулю, если их агрегатные состояния и модификации при стандартных условиях
- 10. Энтальпия реакции Она рассчитывается по следствию закона Гесса: энтальпия реакции зависит только от вида и состояния
- 11. По следствию закона Гесса энтальпия реакции представляет собой разность между суммой энтальпий образования продуктов реакции и
- 12. Энтропия химической реакции Энтропия (S) – мерой неупорядоченности системы. Чем меньше упорядоченность системы, тем выше энтропия
- 13. При данном агрегатном состоянии энтропия тем значительнее, чем больше атомов содержатся в молекуле S°298O3(г) = 298,80
- 14. Согласно второму закону термодинамики «в замкнутой /изолированной/ системе самопроизвольно идут процессы, приводящие к росту энтропии, либо
- 15. Абсолютное значение энергии Гиббса системы определить невозможно и рассчитывают изменение энергии Гиббса /∆G/. Отсюда следует ∆G
- 17. Скачать презентацию














 Кристаллические решетки
Кристаллические решетки Природные источники углеводородов
Природные источники углеводородов Щелочноземельные металлы
Щелочноземельные металлы NaHSO4. Гидросульфат натрия
NaHSO4. Гидросульфат натрия Получение пресной и чистой воды
Получение пресной и чистой воды Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Спирты
Спирты циклоалканы170
циклоалканы170 Напій кока-кола. Активні інгредієнти кока-коли
Напій кока-кола. Активні інгредієнти кока-коли Качественные реакции на органические вещества
Качественные реакции на органические вещества Властивості вуглеводів. Лабораторна робота 3
Властивості вуглеводів. Лабораторна робота 3 Амфотерные соединения
Амфотерные соединения Аспирин: польза или вред?
Аспирин: польза или вред? Опасности среды обитания человека
Опасности среды обитания человека Задачи и методы количественного анализа. Кислотно-основное титрование
Задачи и методы количественного анализа. Кислотно-основное титрование Күрделі эфирлер
Күрделі эфирлер Валентність хімічних елементів
Валентність хімічних елементів Сложные эфиры. Жиры
Сложные эфиры. Жиры Биоорганическая химия
Биоорганическая химия Основные классы неорганических соединений
Основные классы неорганических соединений Соляная кислота. Хлориды
Соляная кислота. Хлориды Конструкционные функциональные волокнистые композиты. Стеклопластики
Конструкционные функциональные волокнистые композиты. Стеклопластики Важнейшие оксиды в природе и жизни человека
Важнейшие оксиды в природе и жизни человека Химия нефти и газа. Переработка нефти
Химия нефти и газа. Переработка нефти Методы в химии
Методы в химии Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс
Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс Железо. Физические свойства
Железо. Физические свойства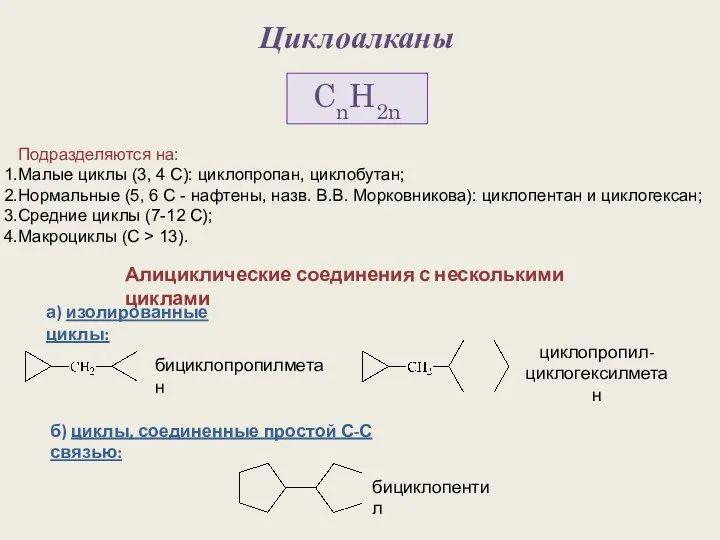 Циклоалканы. Строение алициклов
Циклоалканы. Строение алициклов