Содержание
- 2. Соляная кислота - раствор HCl в воде. Физические свойства 1. Бесцветная жидкость (техническая - жёлто-зелёного цвета)
- 3. Химические свойства HCl 1. Сильная кислота: HCl + H2O → H3O+ + Cl- упрощённо: HCl →
- 4. 2. Взаимодействие с металлами: Fe + 2HCl = FeCl2 + H2 3. Взаимодействие с основными и
- 5. Хлориды металлов - соли соляной кислоты. NaCl, CuCl2, FeCl3, AlCl3 и др. 1. HCl и хлориды
- 6. 2. Качественная реакция на HCl и хлориды: HCl + AgNO3 = AgCl + HNO3 NaCl +
- 8. Скачать презентацию





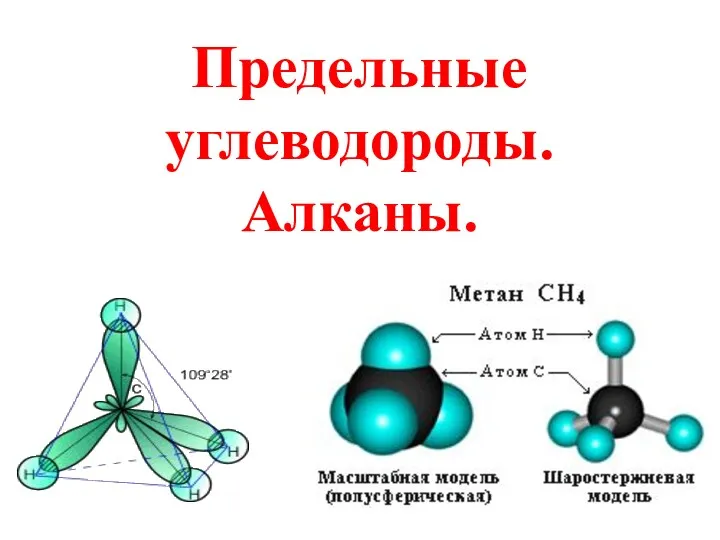 Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Гетерофункциональные соединения, участвующие в процессах жизнедеятельности Галогены (солеобразующие)
Галогены (солеобразующие) Общая характеристика неметаллов
Общая характеристика неметаллов Спирттер мен фенолдар
Спирттер мен фенолдар Химия вокруг нас
Химия вокруг нас Методы определения Тст и Тт полимеров
Методы определения Тст и Тт полимеров Гидролиз. Необратимый гидролиз
Гидролиз. Необратимый гидролиз Кислоты. Химические свойства кислот
Кислоты. Химические свойства кислот Пневмовакуум-формование
Пневмовакуум-формование Строение атома. Периодическая таблица Менделеева. Химическая связь
Строение атома. Периодическая таблица Менделеева. Химическая связь Бордың адам ағзасына әсері. Бор дегеніміз не?
Бордың адам ағзасына әсері. Бор дегеніміз не? Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Жёсткость воды
Жёсткость воды Metal–metal multiple bonded intermediates in catalysis
Metal–metal multiple bonded intermediates in catalysis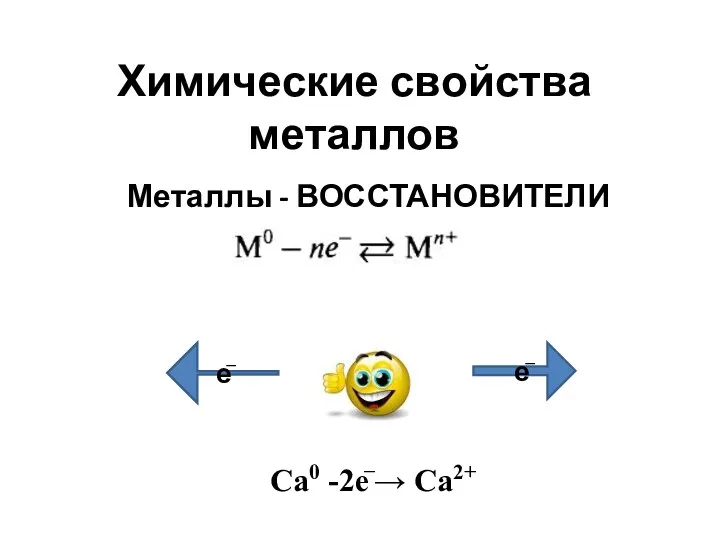 Химические свойства металлов
Химические свойства металлов Биологическая роль макро и микроэлементов. (Лекция 17)
Биологическая роль макро и микроэлементов. (Лекция 17) Химическая связь и ее типы. (11 класс)
Химическая связь и ее типы. (11 класс) Готовимся к экзамену по химии. 9 класс
Готовимся к экзамену по химии. 9 класс Биологически важные 5-ти и 6-ти членные гетероциклические соединения. (Лекция 25)
Биологически важные 5-ти и 6-ти членные гетероциклические соединения. (Лекция 25) Анализ проб воды
Анализ проб воды Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал
Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда Минеральные удобрения
Минеральные удобрения Каменный уголь. Физические и химические свойства
Каменный уголь. Физические и химические свойства Preparation for COP
Preparation for COP Методы пробоотбора воздуха. Лекция 2
Методы пробоотбора воздуха. Лекция 2 Периодические системы химических элементов
Периодические системы химических элементов