Содержание
- 2. Классификация углеводородов. Гомологический ряд алканов. Изомерия алканов. Номенклатура алканов. Строение алканов. Физические свойства алканов. Химические свойства
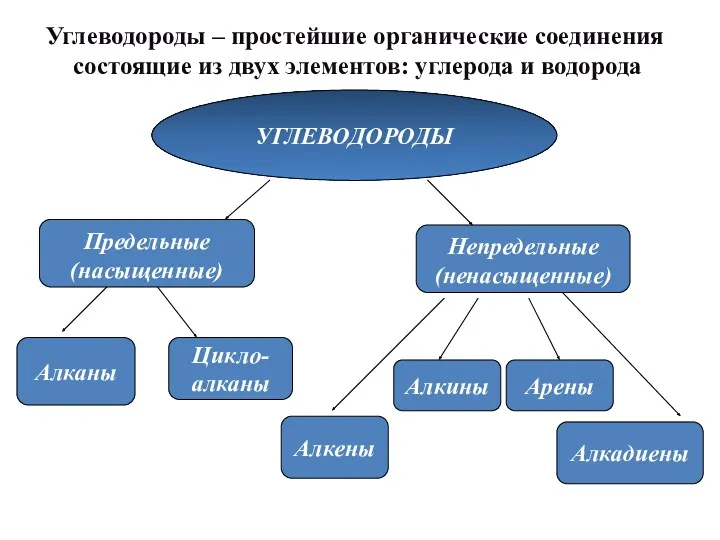
- 3. Углеводороды – простейшие органические соединения состоящие из двух элементов: углерода и водорода УГЛЕВОДОРОДЫ Предельные (насыщенные) Непредельные
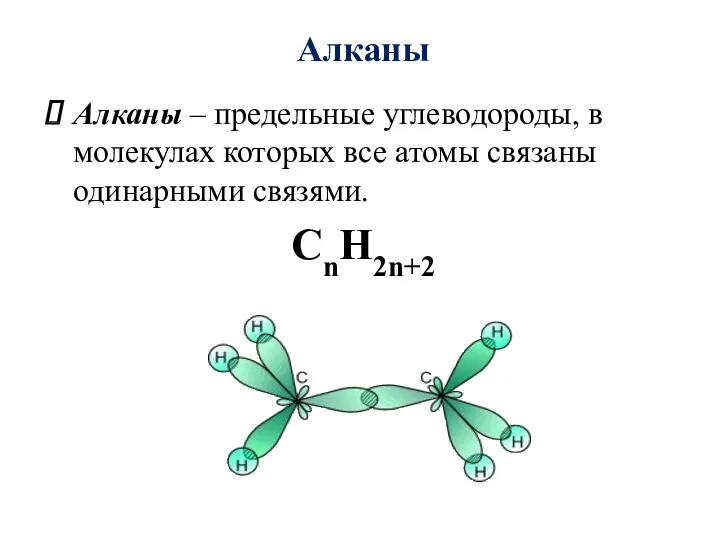
- 5. Алканы Алканы – предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. CnH2n+2
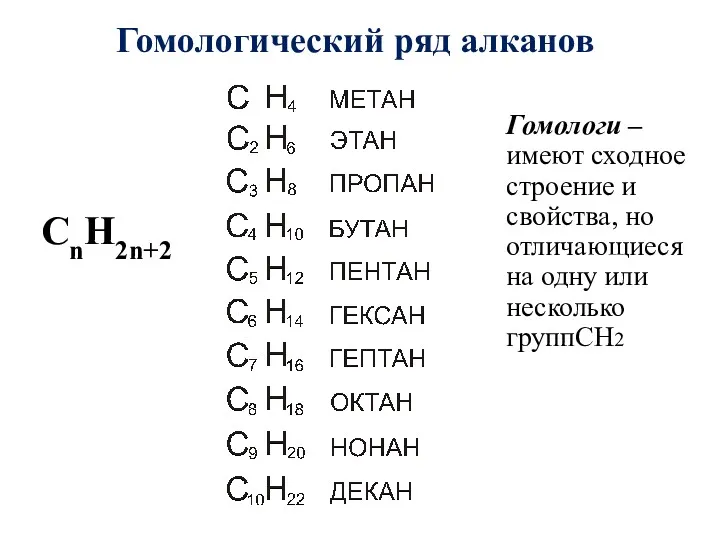
- 6. Гомологический ряд алканов CnH2n+2 Гомологи – имеют сходное строение и свойства, но отличающиеся на одну или
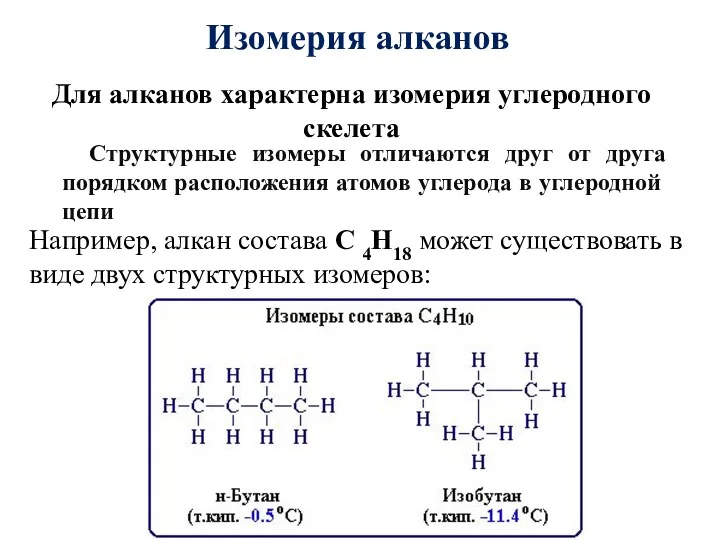
- 7. Изомерия алканов Для алканов характерна изомерия углеродного скелета Структурные изомеры отличаются друг от друга порядком расположения
- 8. Номенклатура органических соединений – система правил, позволяющих дать однозначное название каждому индивидуальному веществу. Это язык химии,
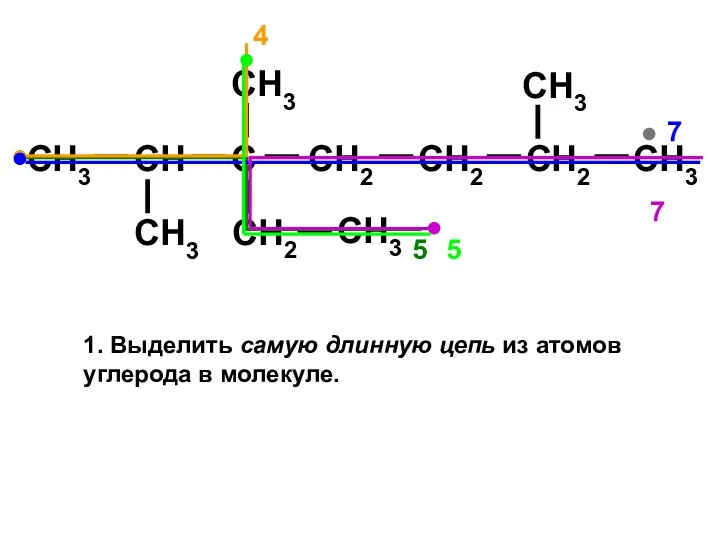
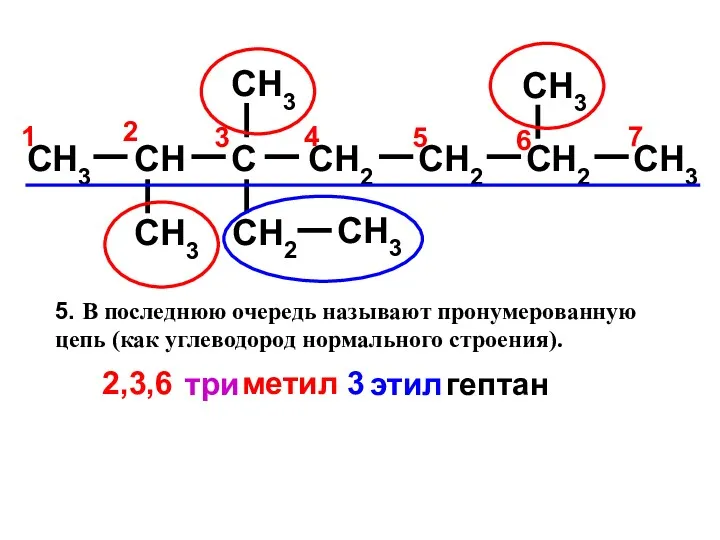
- 9. Правила построения названий алканов по систематической международной номенклатуре ИЮПАК Выбрать самую длинную цепь атомов углерода; Пронумеровать
- 10. CH3 CH C CH2 CH2 CH3 CH3 CH3 CH2 CH3 CH3 CH2 5 4 7 7
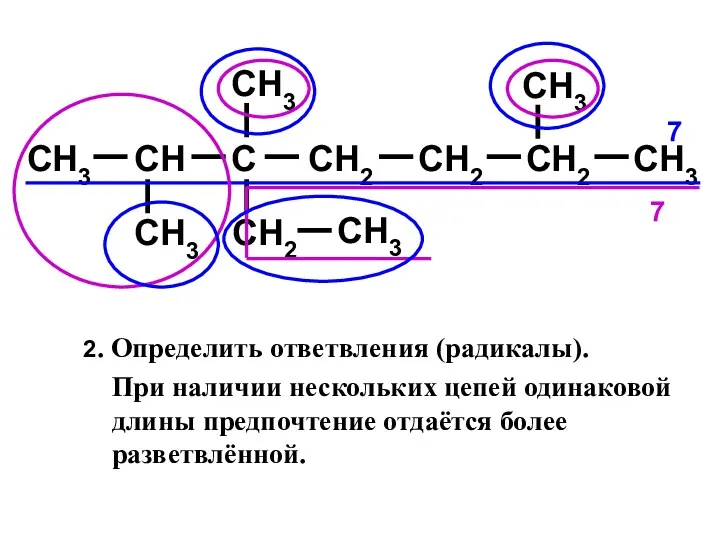
- 11. CH3 CH C CH2 CH2 CH3 CH3 CH3 CH2 CH3 CH3 CH2 7 7 2. Определить
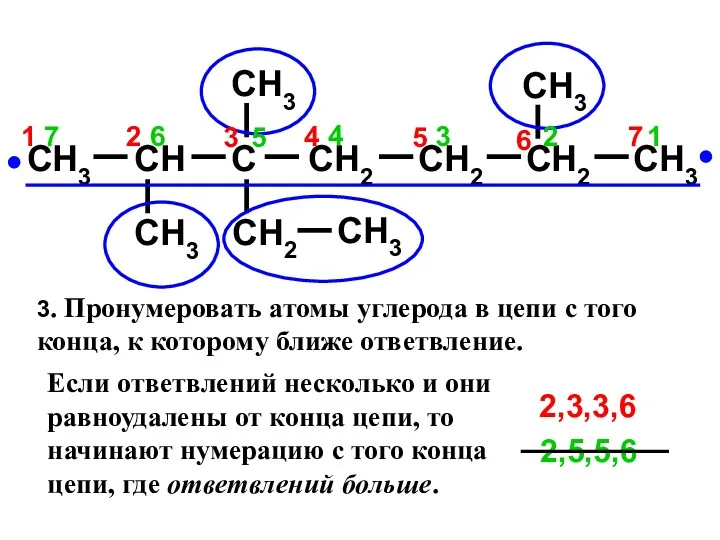
- 12. CH3 CH C CH2 CH2 CH3 CH3 CH3 CH2 CH3 CH3 CH2 7 2 3 1
- 13. CH3 CH C CH2 CH2 CH3 CH3 CH3 CH2 CH3 CH3 CH2 7 6 5 4
- 14. CH3 CH C CH2 CH2 CH3 CH3 CH3 CH2 CH3 CH3 CH2 7 6 5 4
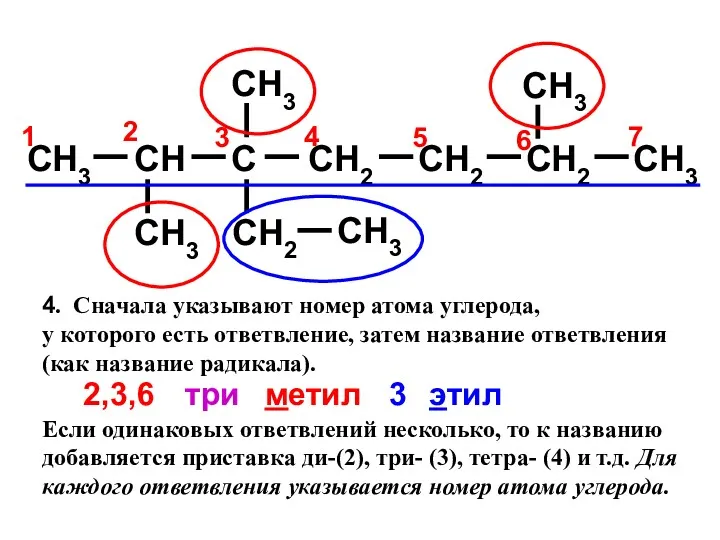
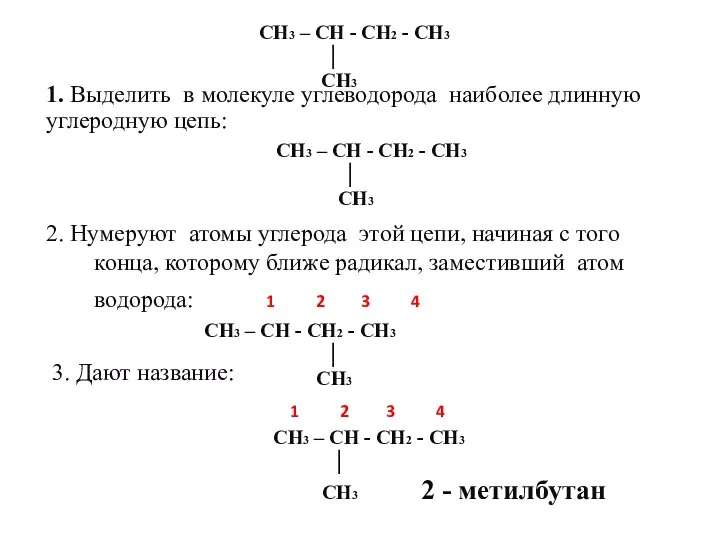
- 15. 1. Выделить в молекуле углеводорода наиболее длинную углеродную цепь: 2. Нумеруют атомы углерода этой цепи, начиная
- 17. В основном состоянии электронная конфигурация атома углерода соответствует 1s2 2s2 2p2, а возбужденном состоянии 2s2 –
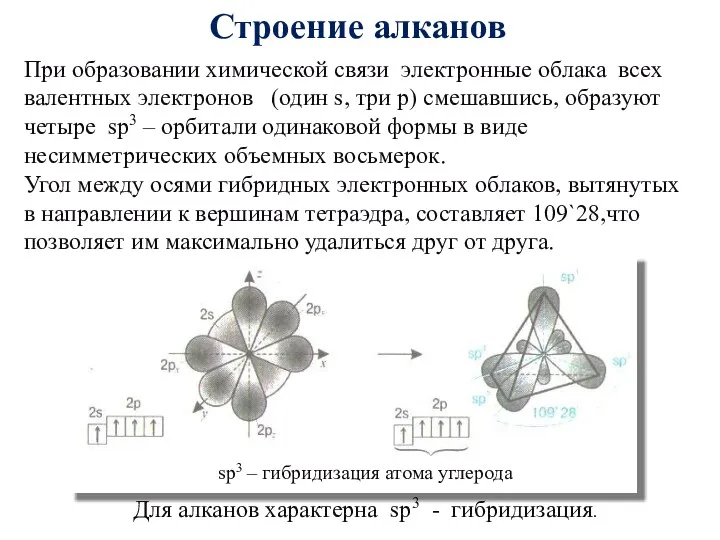
- 18. При образовании химической связи электронные облака всех валентных электронов (один s, три p) смешавшись, образуют четыре
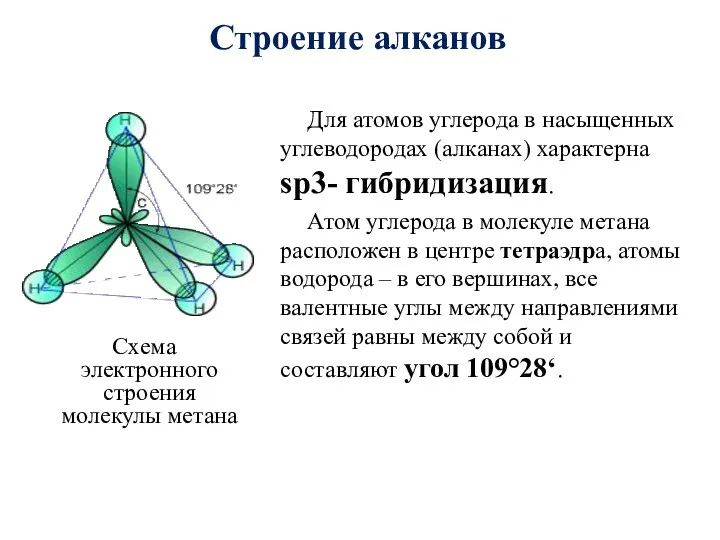
- 19. Для атомов углерода в насыщенных углеводородах (алканах) характерна sp3- гибридизация. Атом углерода в молекуле метана расположен
- 20. Метан – наиболее распространенный в природе углеводород. Метан образуется в результате разложения растительных остатков животных организмов
- 21. Физические свойства алканов
- 22. Химические свойства алканов Алканы вступают в реакцию замещения, разложения и окисления. Реакции замещения 1. Реакция галогенирования:
- 23. 2.Реакция разложения Крекинг При нагревании алканы подвергаются термическому разложению. При сильном нагревании метана (до 1000ºC) без
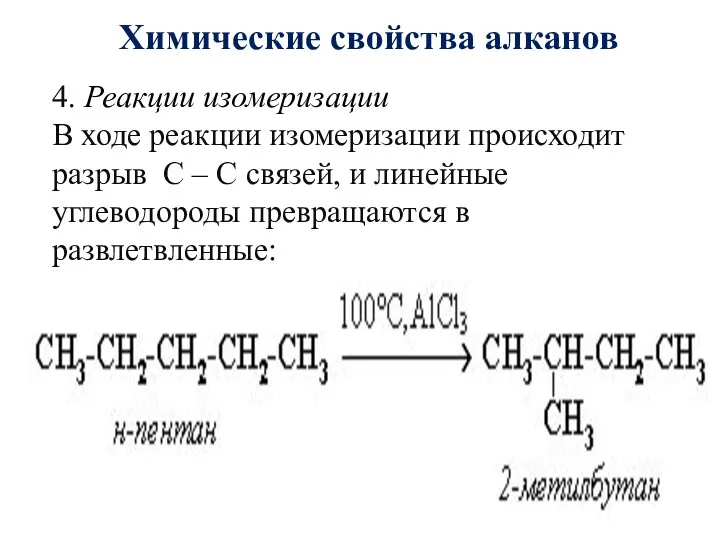
- 24. Химические свойства алканов 4. Реакции изомеризации В ходе реакции изомеризации происходит разрыв С – С связей,
- 25. Получение алканов 1. В лабораторных условиях алканы получают гидрированием ненасыщенных углеводородовв присутствии катализаторов Ni, Pt, Pd:
- 26. Для получения: Резины Типографской краски Синтетического бензина Синтез-газа Растворителей Горючего Хладаагентов Применение алканов
- 29. Скачать презентацию












 Carbohydrates (sugars)
Carbohydrates (sugars) Дисперсные системы в атмосфере
Дисперсные системы в атмосфере Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева Фенолы: понятие, классификация, номенклатура, изомерия, получение, физические свойства, химические свойства, применение
Фенолы: понятие, классификация, номенклатура, изомерия, получение, физические свойства, химические свойства, применение Физические и химические явления. Условия течения и признаки химических реакций
Физические и химические явления. Условия течения и признаки химических реакций Алюминий. Строение
Алюминий. Строение Етери та естери. Хімічні властивості
Етери та естери. Хімічні властивості Азотовмисні та елементоорганічні сполуки
Азотовмисні та елементоорганічні сполуки Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Коллигативные свойства растворов
Коллигативные свойства растворов Элементы теории горения
Элементы теории горения Physiology lab
Physiology lab Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Высокомолекулярные соединения
Высокомолекулярные соединения Сахароза
Сахароза Физико-химия дисперсных систем. Физико-химия поверхностных явлений
Физико-химия дисперсных систем. Физико-химия поверхностных явлений Соединения железа
Соединения железа Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ Значение органической химии в жизни человека
Значение органической химии в жизни человека Степень окисления в органической химии
Степень окисления в органической химии Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Ионная связь
Ионная связь Строение атома
Строение атома Ферменттер. Зерттелу тарихы
Ферменттер. Зерттелу тарихы Химиялық реакциялардың жылдамдығы
Химиялық реакциялардың жылдамдығы Происхождение рибосомы, белкового синтеза и генетического кода
Происхождение рибосомы, белкового синтеза и генетического кода Металлы. Общие свойства металлов
Металлы. Общие свойства металлов Химический элемент титан
Химический элемент титан