Содержание
- 2. Учебники 1. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия (2012, 2008, 1985г.) 2. Степаненко Б.Н. Курс органической
- 3. Органические соединения - углеводороды и их функциональных производных (соединений, содержащих функциональные группы). Биоорганическая химия изучает строение
- 4. Функциональные группы: - атомные группировки – атомы металлов и неметаллов (CH3Cl, CH3Na) - молекулярные группировки –
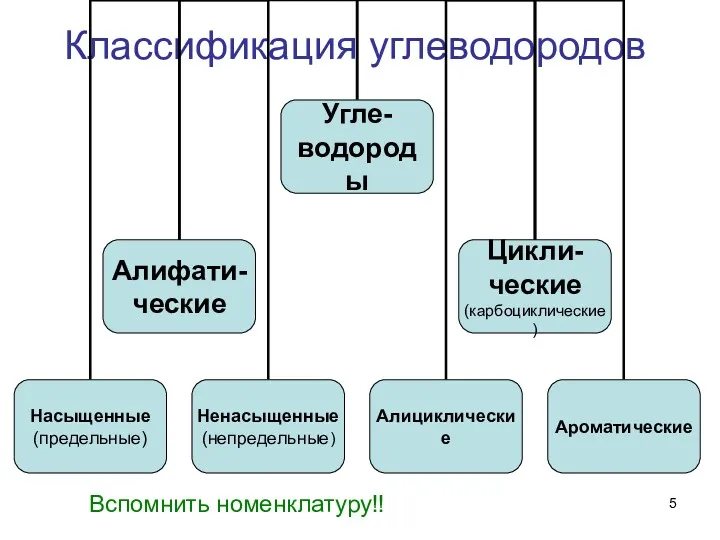
- 5. Классификация углеводородов Вспомнить номенклатуру!!
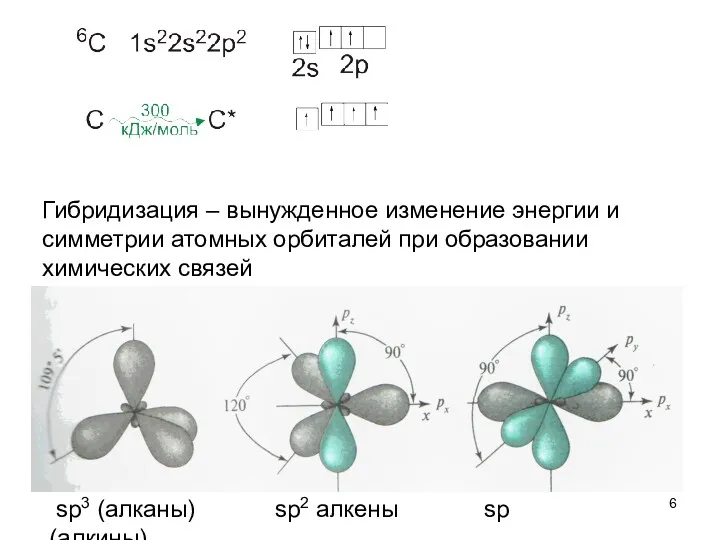
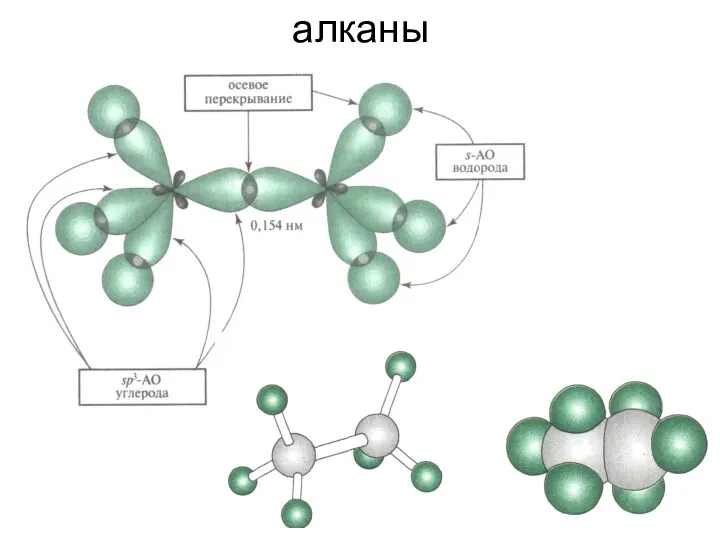
- 7. алканы
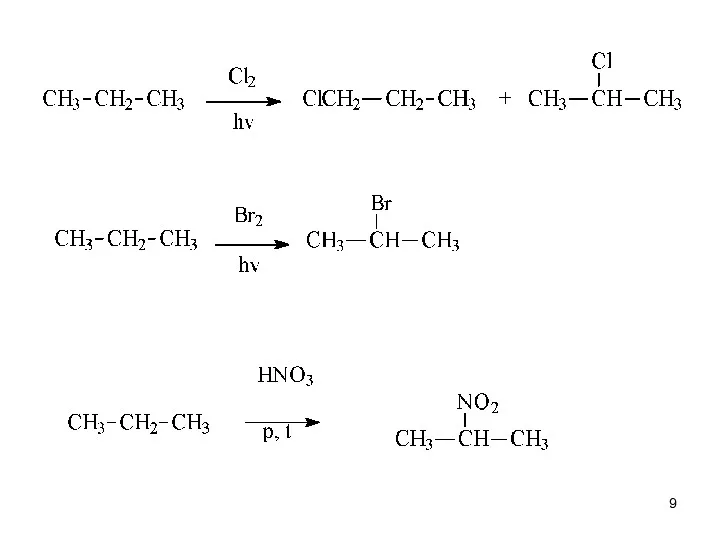
- 8. Алканы – малореакционноспособные соединения, «химические мертвецы». С трудом вступают в реакции радикального замещения атома Н. Для
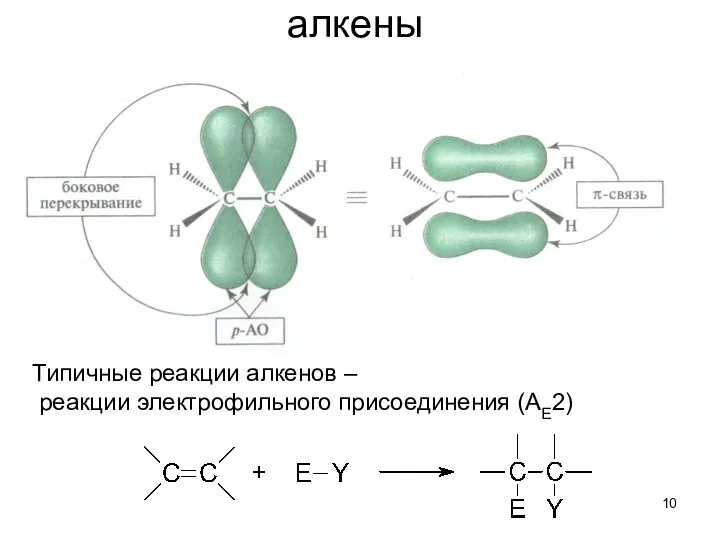
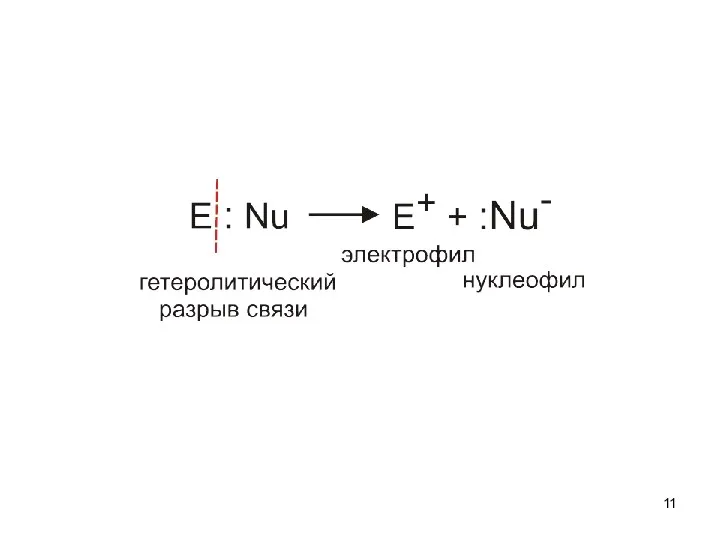
- 10. алкены
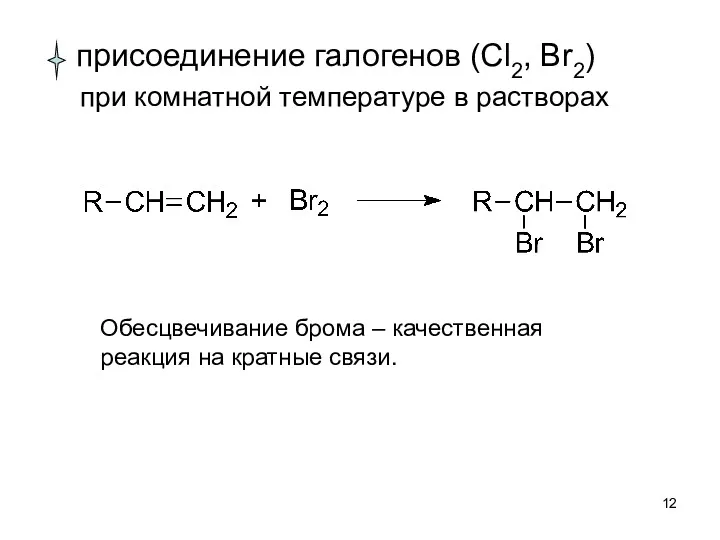
- 12. присоединение галогенов (Cl2, Br2) при комнатной температуре в растворах Обесцвечивание брома – качественная реакция на кратные
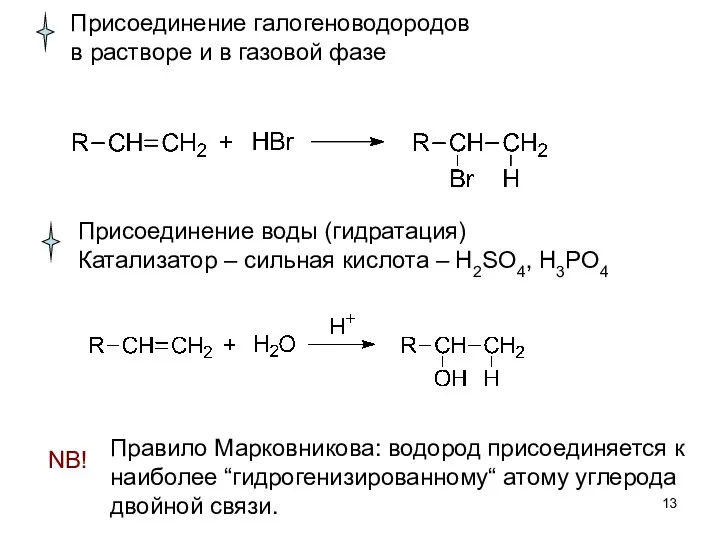
- 13. Присоединение галогеноводородов в растворе и в газовой фазе Присоединение воды (гидратация) Катализатор – сильная кислота –
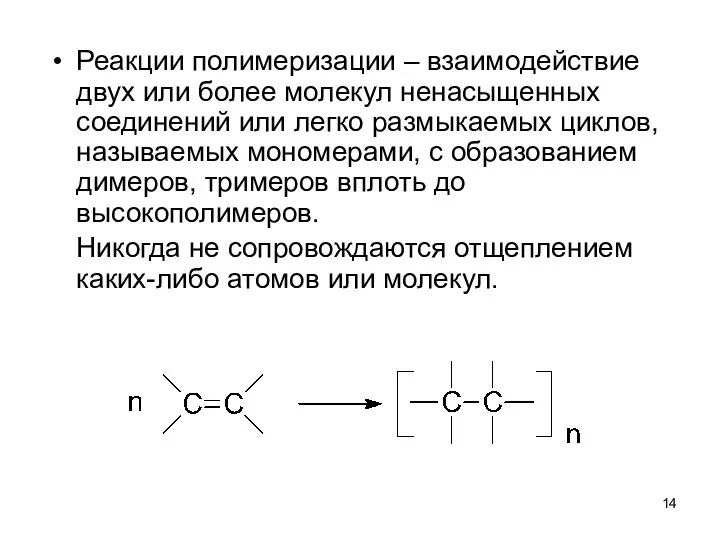
- 14. Реакции полимеризации – взаимодействие двух или более молекул ненасыщенных соединений или легко размыкаемых циклов, называемых мономерами,
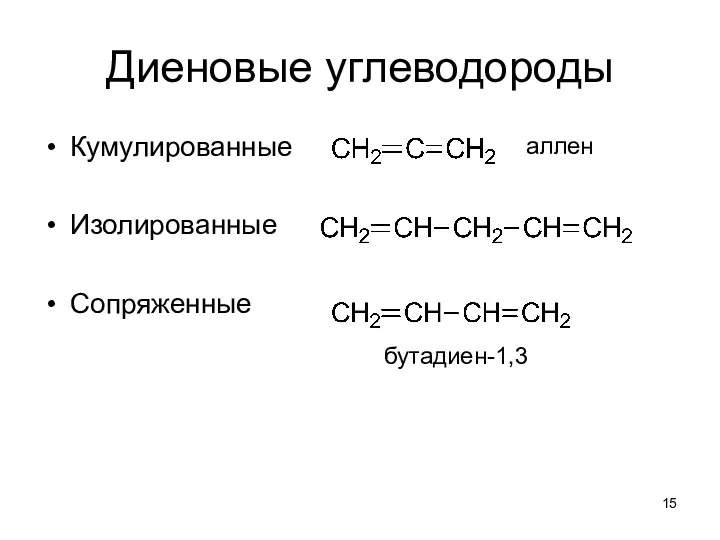
- 15. Диеновые углеводороды Кумулированные Изолированные Сопряженные аллен бутадиен-1,3
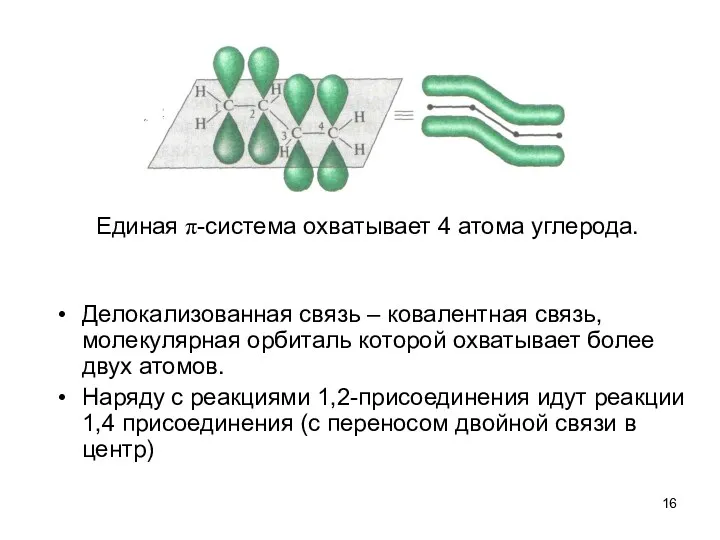
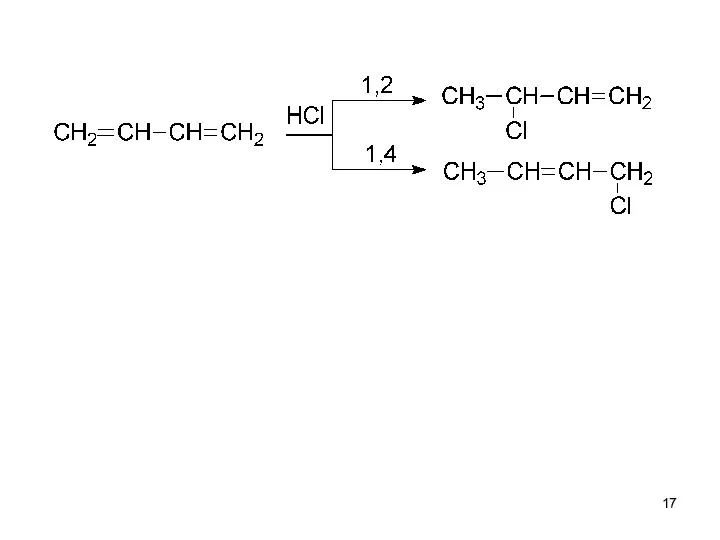
- 16. Делокализованная связь – ковалентная связь, молекулярная орбиталь которой охватывает более двух атомов. Наряду с реакциями 1,2-присоединения
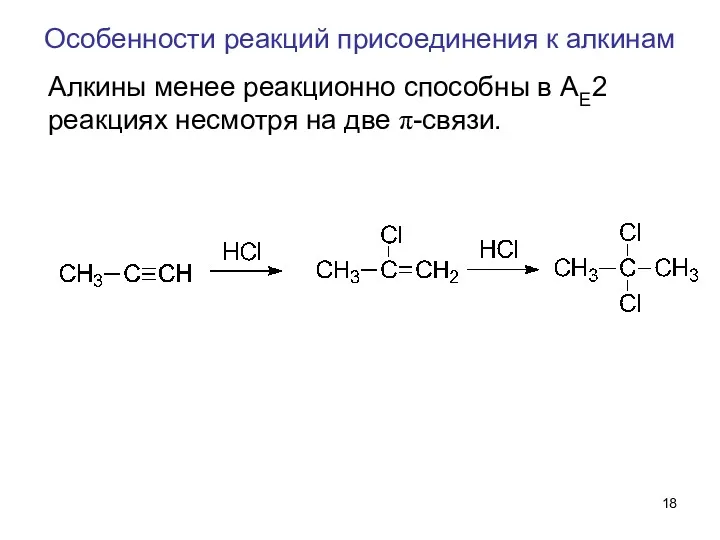
- 18. Особенности реакций присоединения к алкинам Алкины менее реакционно способны в AE2 реакциях несмотря на две π-связи.
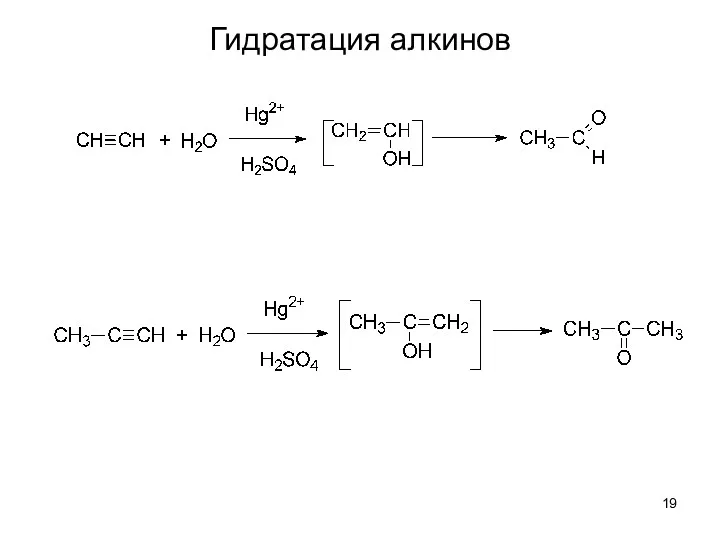
- 19. Гидратация алкинов
- 20. Более важной in vivo является двойная связь. Возникновение двойной связи и её превращения характерны для многих
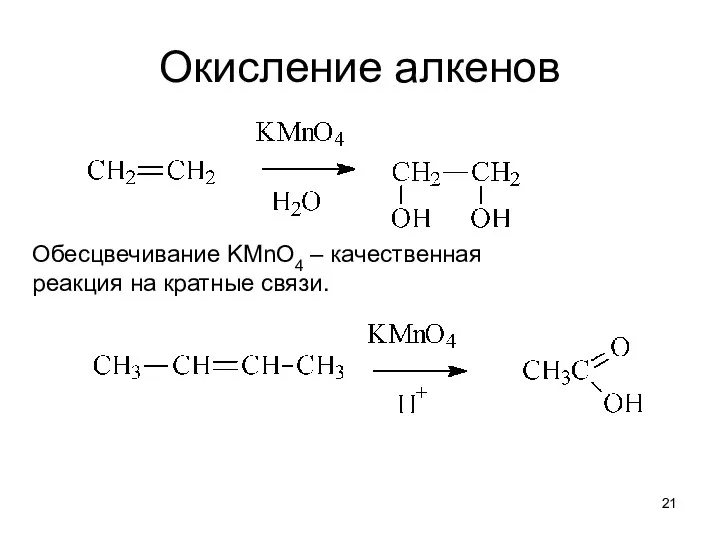
- 21. Окисление алкенов Обесцвечивание KMnO4 – качественная реакция на кратные связи.
- 22. Способы получения алканов, алкенов, алкинов, алкадиенов самостоятельно
- 23. Циклические углеводороды Алициклические углеводороды: - полиметиленовые углеводороды - производные ментана По числу циклов: - моноциклические -
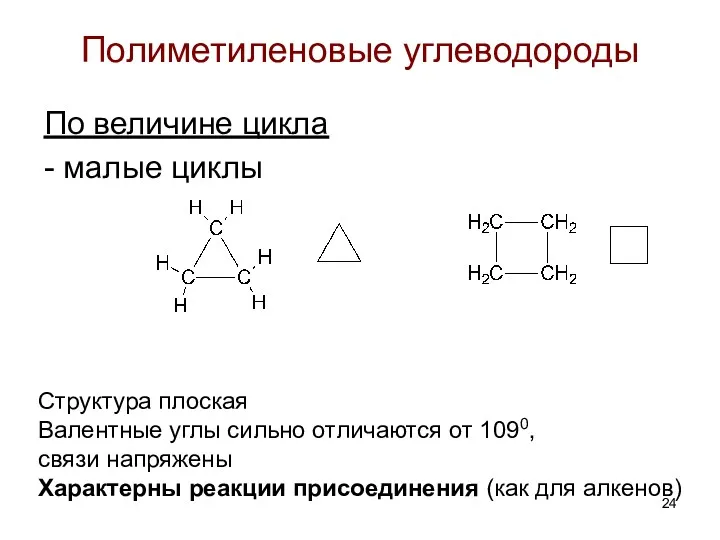
- 24. Полиметиленовые углеводороды По величине цикла - малые циклы Структура плоская Валентные углы сильно отличаются от 1090,
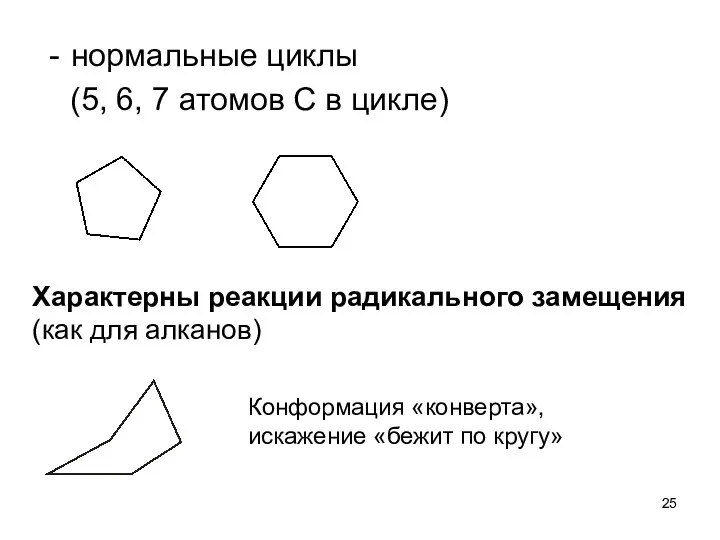
- 25. нормальные циклы (5, 6, 7 атомов С в цикле) Характерны реакции радикального замещения (как для алканов)
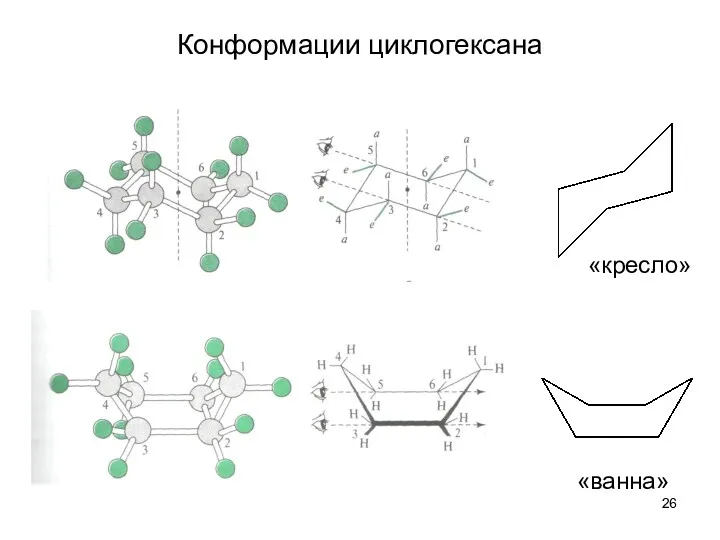
- 26. Конформации циклогексана «кресло» «ванна»
- 27. средние циклы (8 – 11 атомов С) макроциклы (12 и больше атомов С)
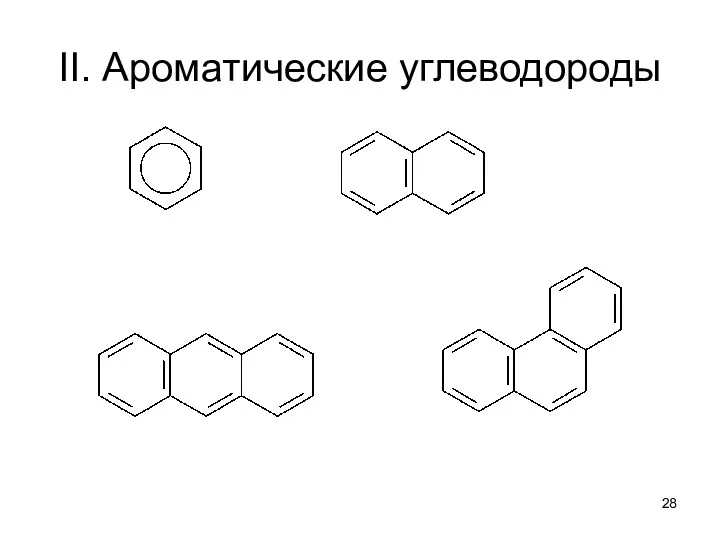
- 28. II. Ароматические углеводороды
- 29. Критерии ароматичности Геометрический: все ароматические системы имеют плоскую замкнутую в цикл сопряжённую систему π-электронов Электронный: число
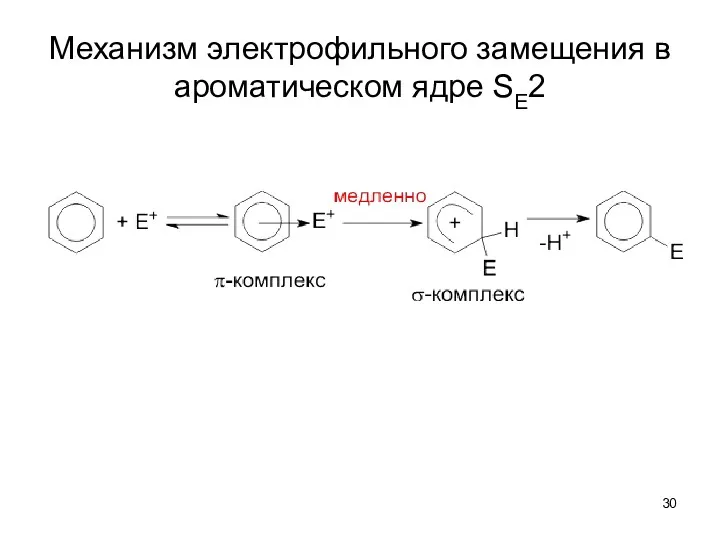
- 30. Механизм электрофильного замещения в ароматическом ядре SE2
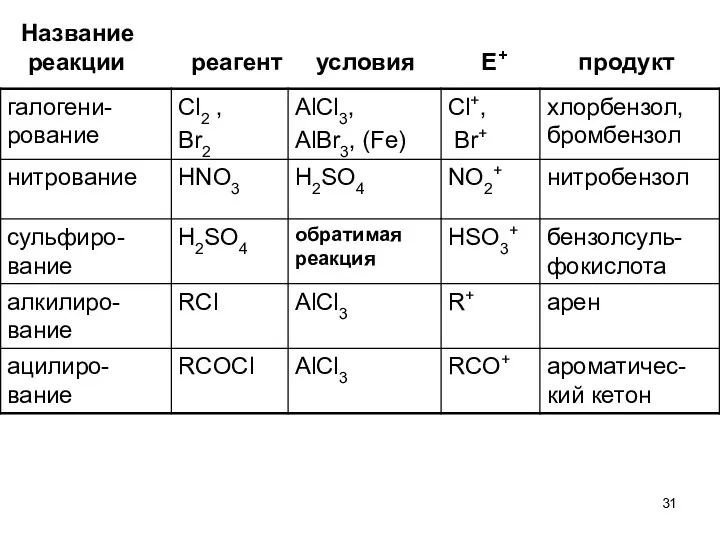
- 31. Название реакции реагент условия Е+ продукт
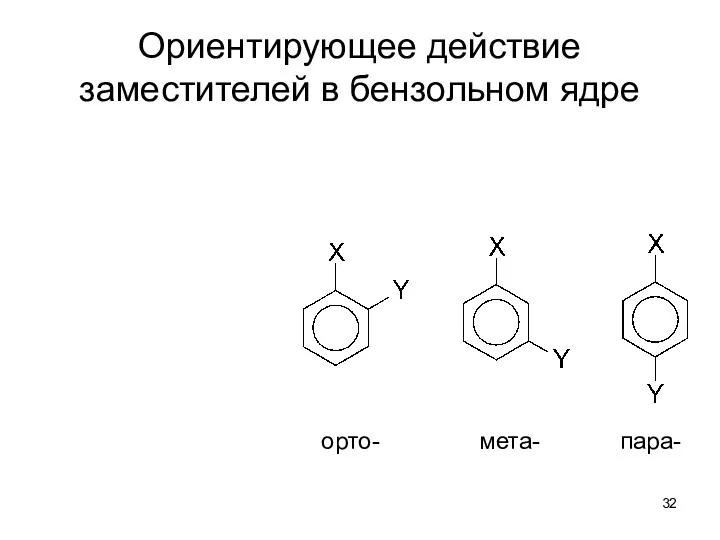
- 32. Ориентирующее действие заместителей в бензольном ядре орто- мета- пара-
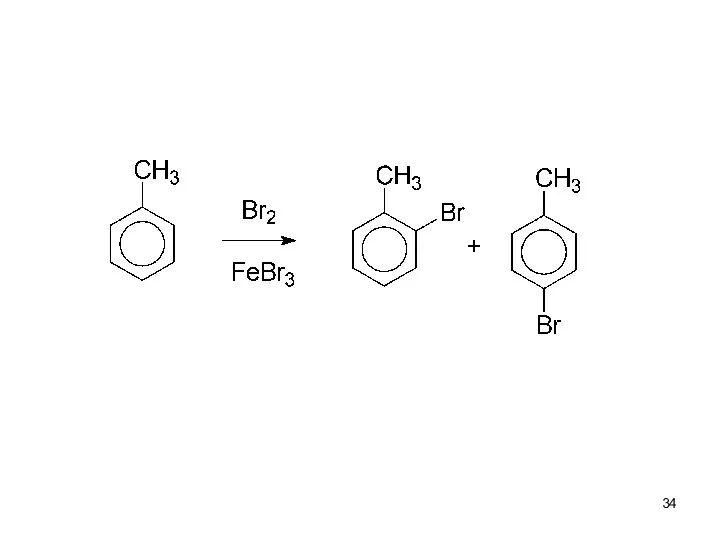
- 33. Заместители I. Активирующие ЭД-заместители. Облегчают ЭФ-замещение по сравнению с незамещённым бензолом, и направляют входящую группу в
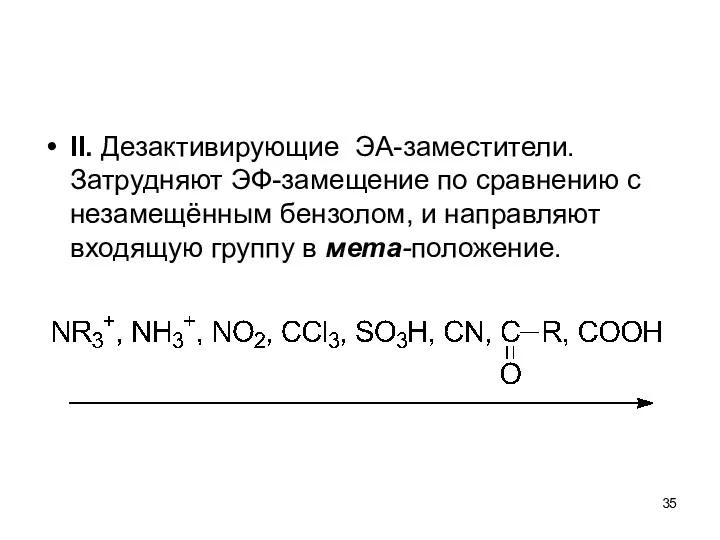
- 35. II. Дезактивирующие ЭА-заместители. Затрудняют ЭФ-замещение по сравнению с незамещённым бензолом, и направляют входящую группу в мета-положение.
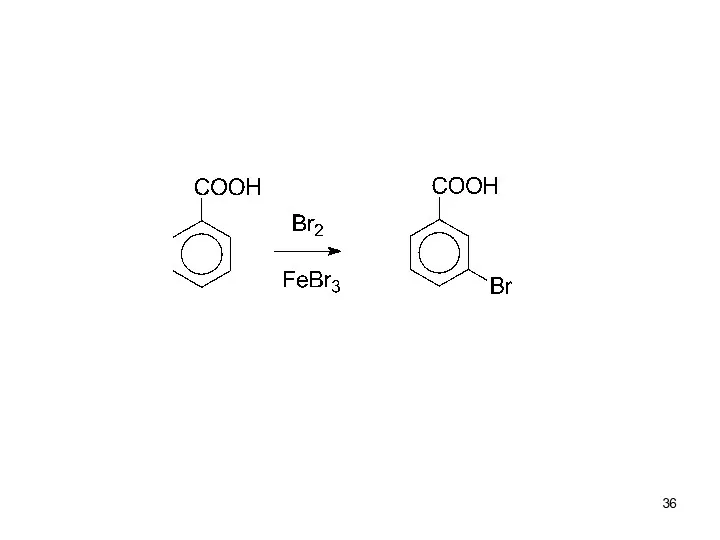
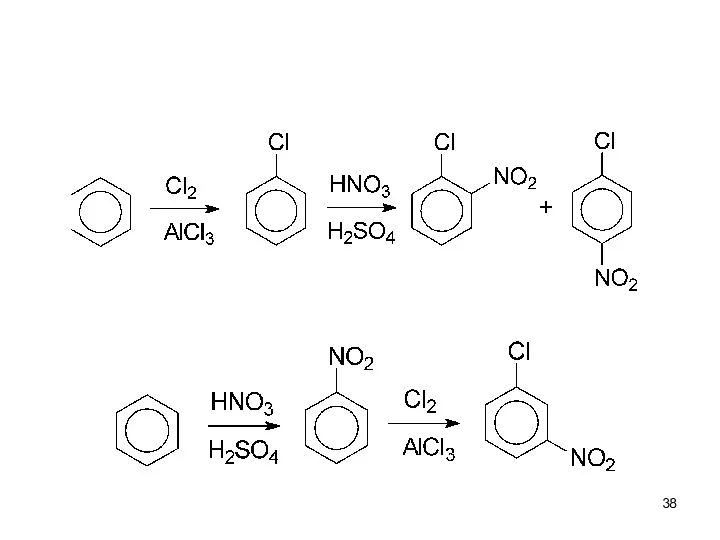
- 37. III. Дезактивирующие орто- и пара-ориентанты: F, Cl, Br, I (-I), (+C)
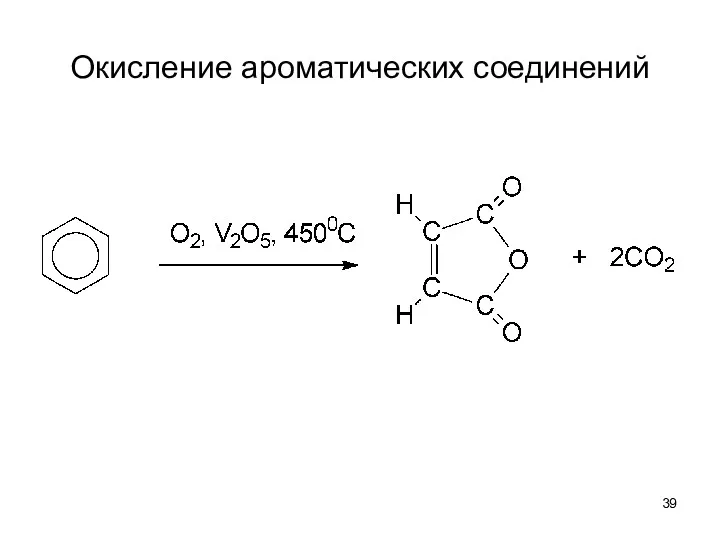
- 39. Окисление ароматических соединений
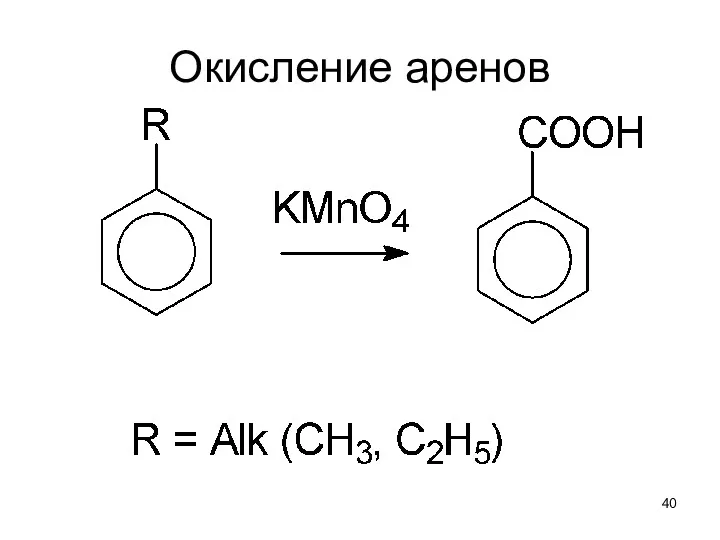
- 40. Окисление аренов
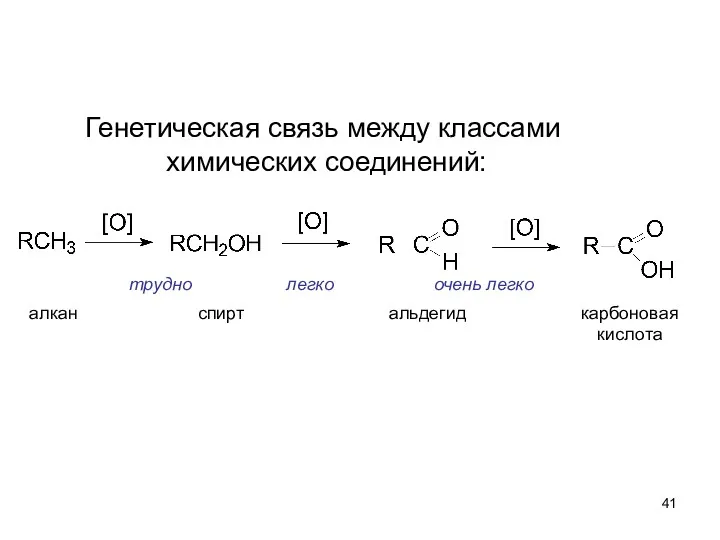
- 41. трудно легко очень легко алкан спирт альдегид карбоновая кислота Генетическая связь между классами химических соединений:
- 42. Гидроксилпроизводные углеводородов Спирты. Фенолы.
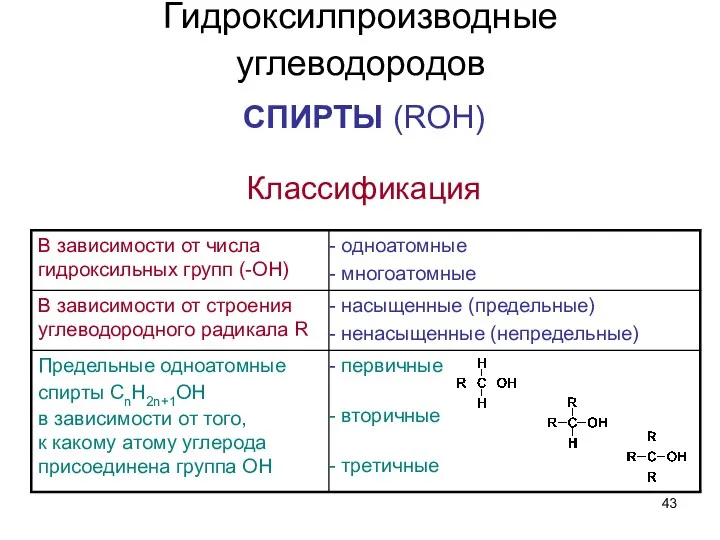
- 43. Гидроксилпроизводные углеводородов СПИРТЫ (ROH) Классификация
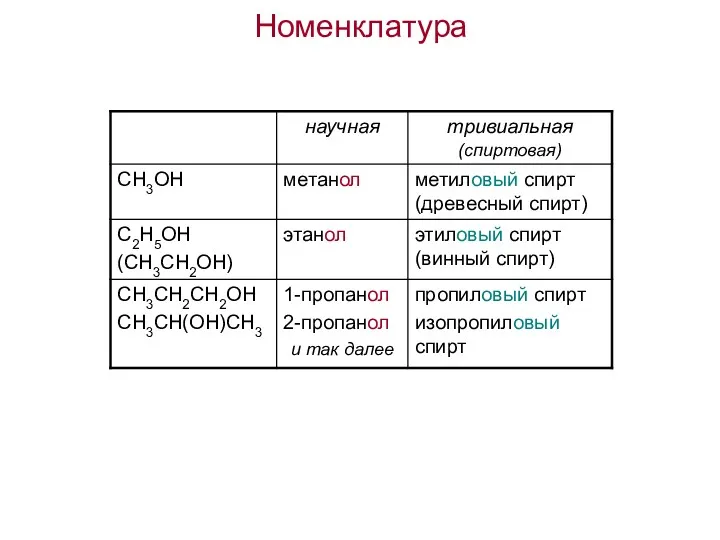
- 44. Номенклатура
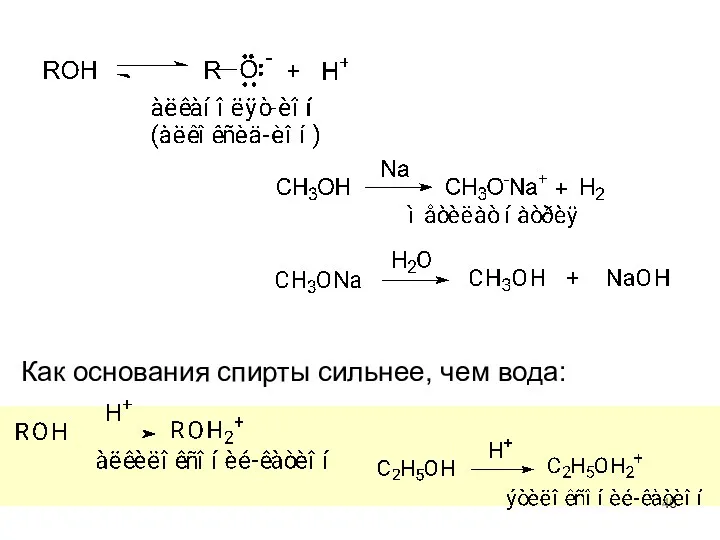
- 45. Химические свойства спиртов I. Реакции с сохранением атома кислорода в молекуле спирта кислотно-основные свойства спиртов. Спирты
- 46. Как основания спирты сильнее, чем вода:
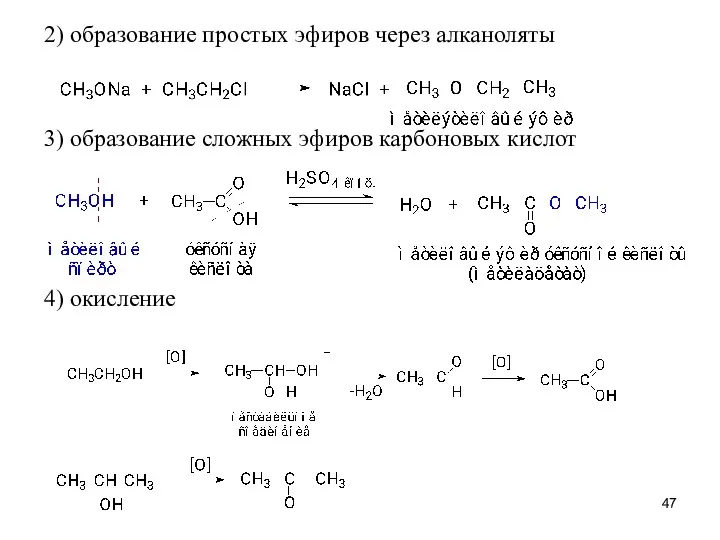
- 47. 2) образование простых эфиров через алканоляты 3) образование сложных эфиров карбоновых кислот 4) окисление
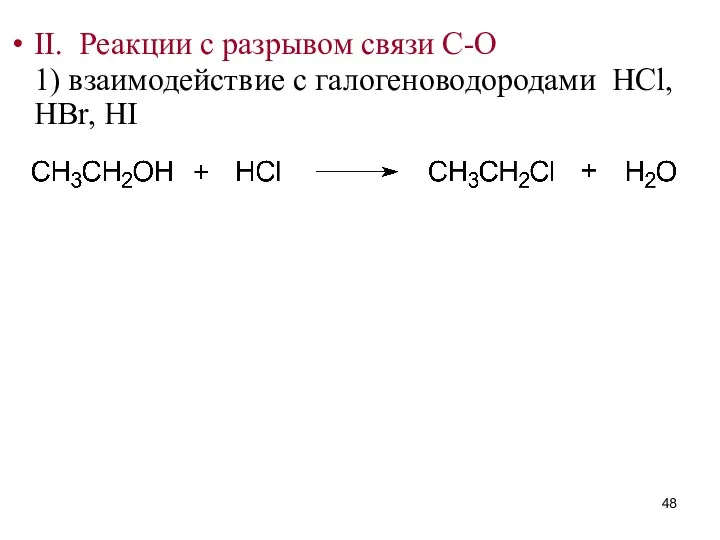
- 48. II. Реакции с разрывом связи C-O 1) взаимодействие с галогеноводородами HCl, HBr, HI
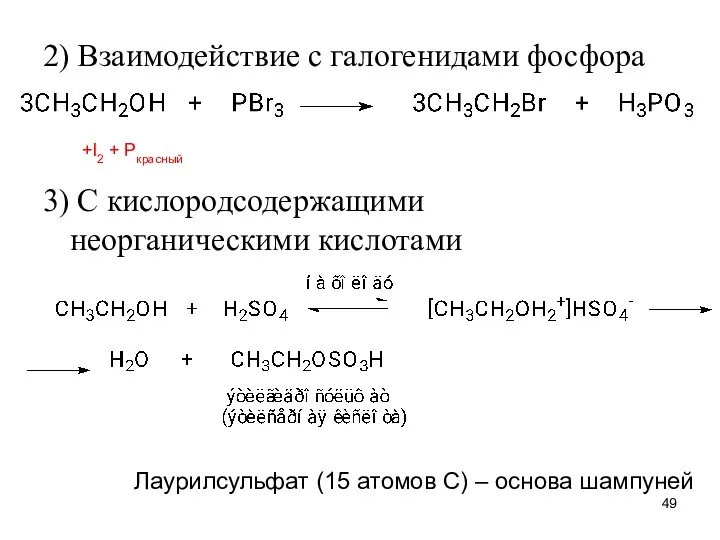
- 49. 2) Взаимодействие с галогенидами фосфора 3) С кислородсодержащими неорганическими кислотами Лаурилсульфат (15 атомов С) – основа
- 50. 4) образование простых эфиров (межмолекулярное отщепление H2O) 5) дегидратация (внутримолекулярное отщепление H2O)
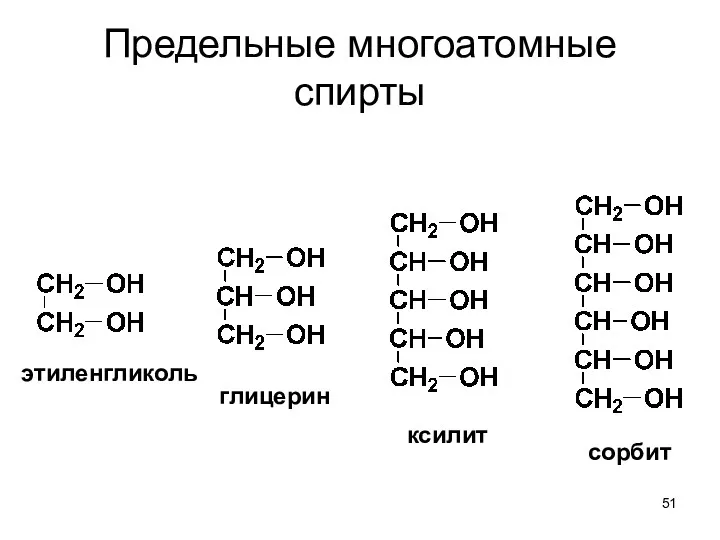
- 51. Предельные многоатомные спирты этиленгликоль глицерин ксилит сорбит
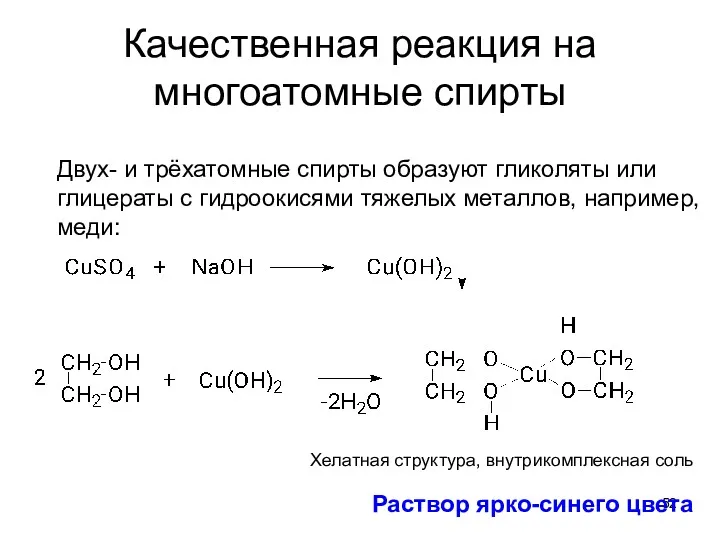
- 52. Качественная реакция на многоатомные спирты Двух- и трёхатомные спирты образуют гликоляты или глицераты с гидроокисями тяжелых
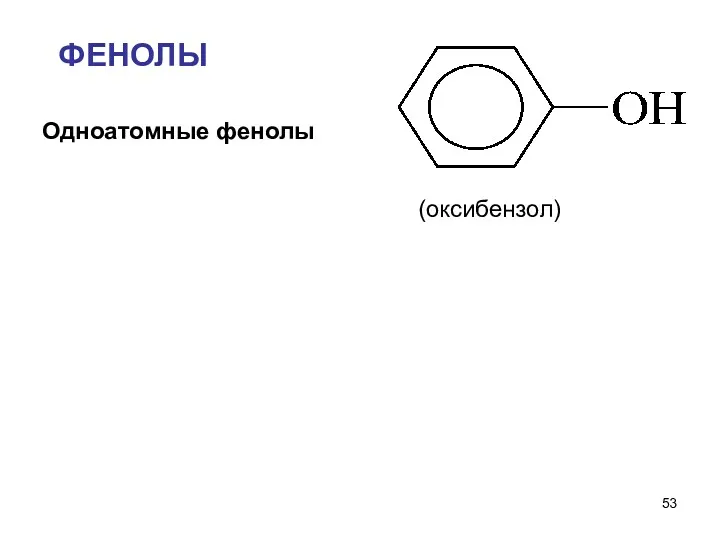
- 53. ФЕНОЛЫ Одноатомные фенолы (оксибензол)
- 54. Химические свойства фенолов
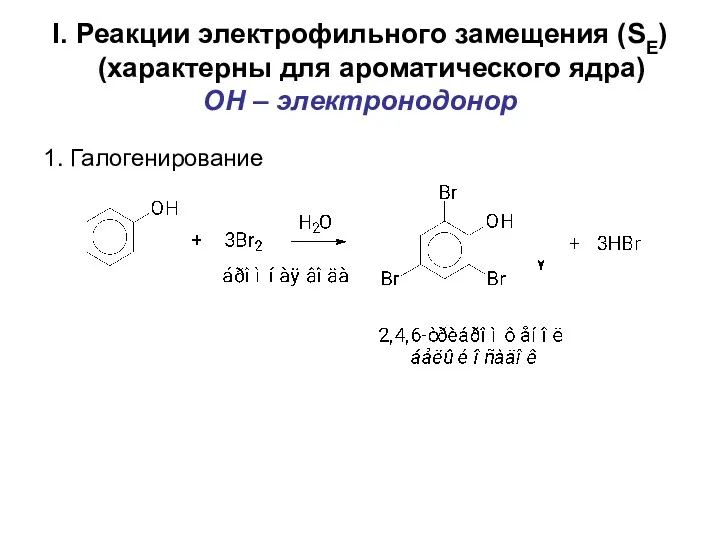
- 55. I. Реакции электрофильного замещения (SE) (характерны для ароматического ядра) OH – электронодонор
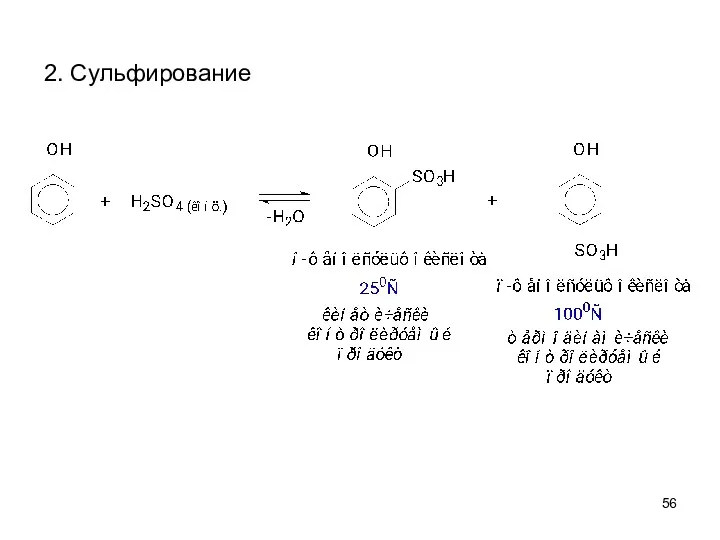
- 56. 2. Сульфирование
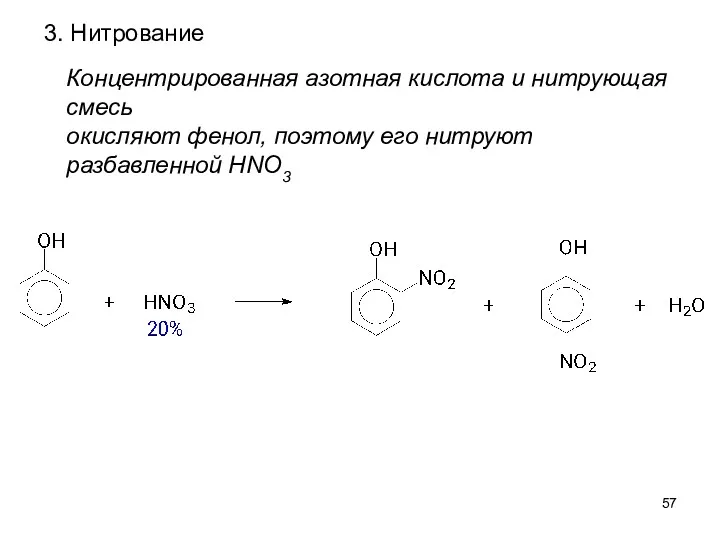
- 57. 3. Нитрование Концентрированная азотная кислота и нитрующая смесь окисляют фенол, поэтому его нитруют разбавленной HNO3
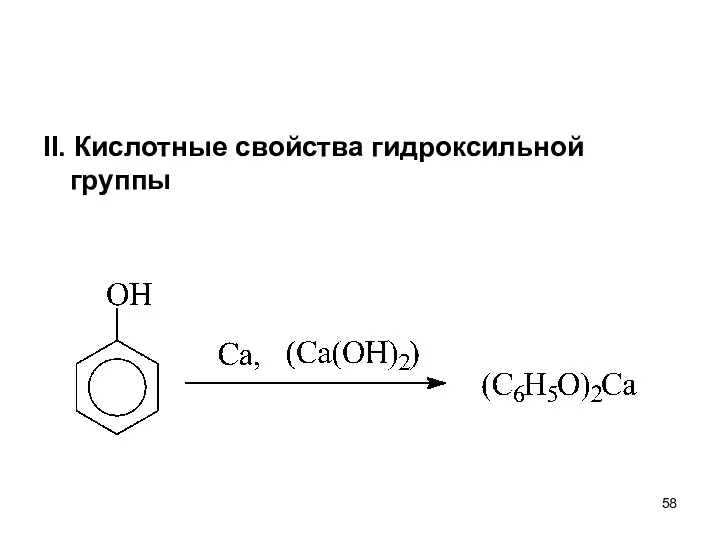
- 58. II. Кислотные свойства гидроксильной группы
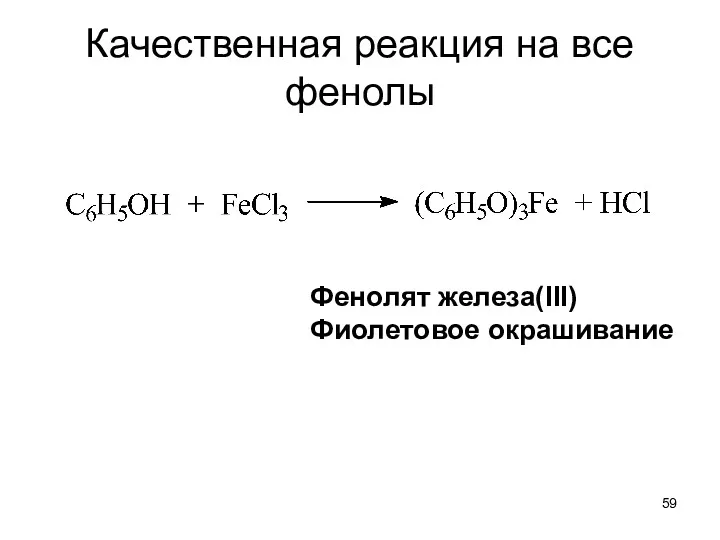
- 59. Качественная реакция на все фенолы Фенолят железа(III) Фиолетовое окрашивание
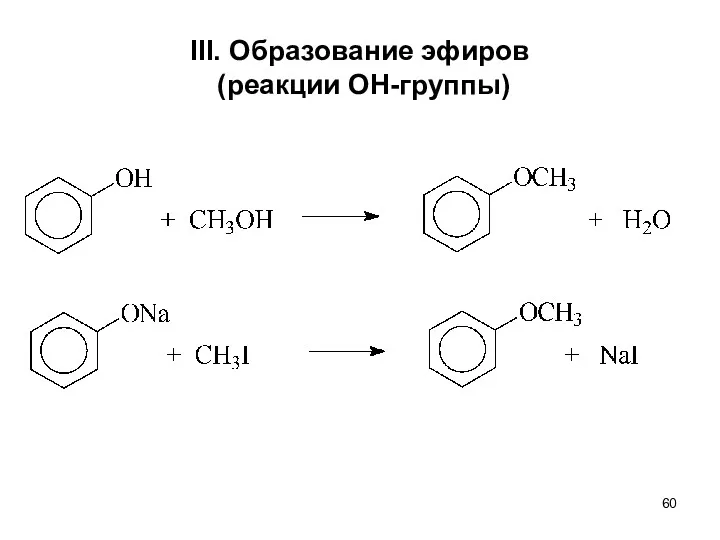
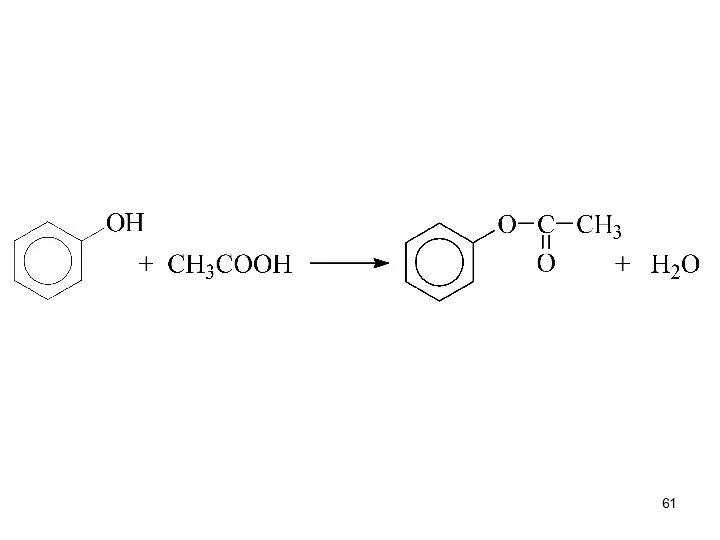
- 60. III. Образование эфиров (реакции ОН-группы)
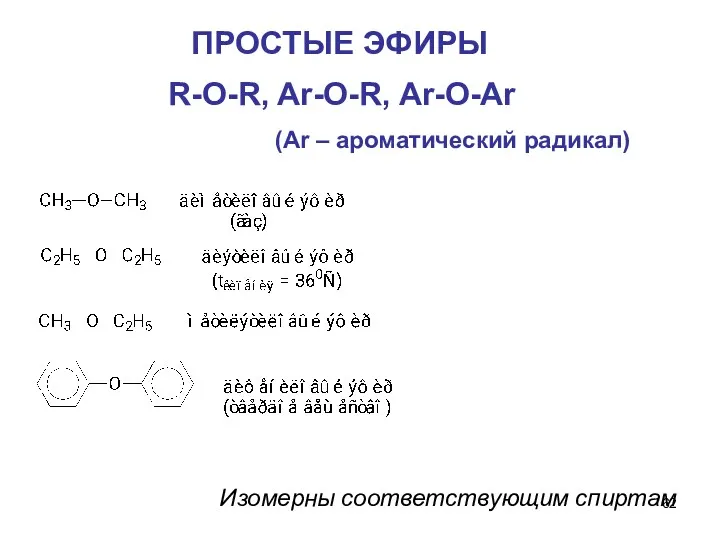
- 62. ПРОСТЫЕ ЭФИРЫ R-O-R, Ar-O-R, Ar-O-Ar (Ar – ароматический радикал) Изомерны соответствующим спиртам
- 63. Малореакционноспособные соединения. Устойчивы к гидролизу, действию разбавленных кислот, сильных оснований.
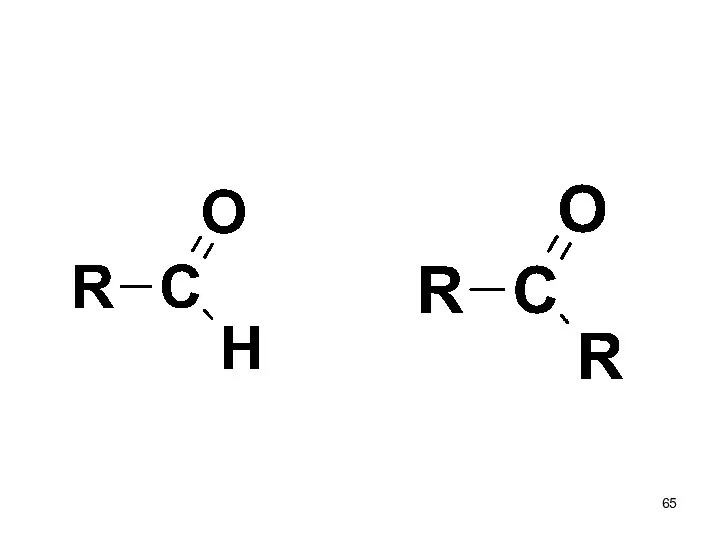
- 64. Карбонильные производные
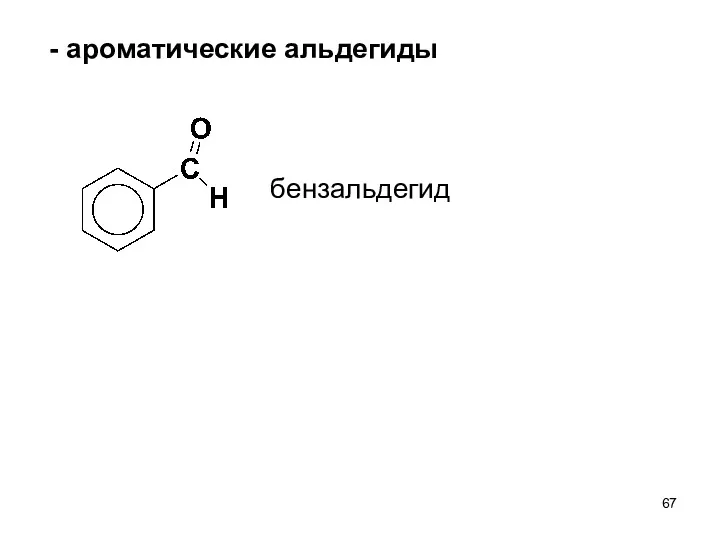
- 67. - ароматические альдегиды бензальдегид
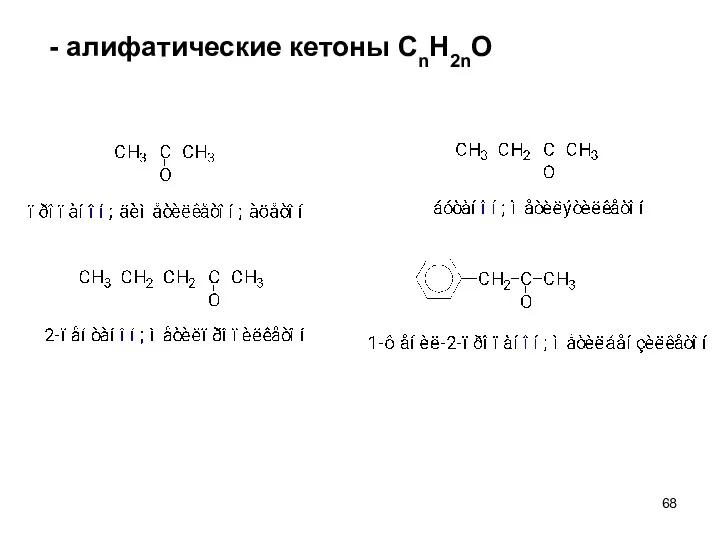
- 68. - алифатические кетоны СnH2nO
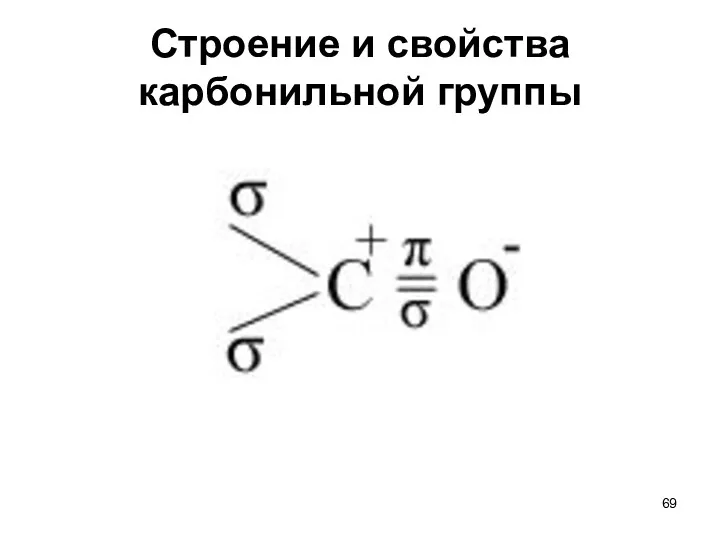
- 69. Строение и свойства карбонильной группы
- 70. Химические свойства альдегидов и кетонов
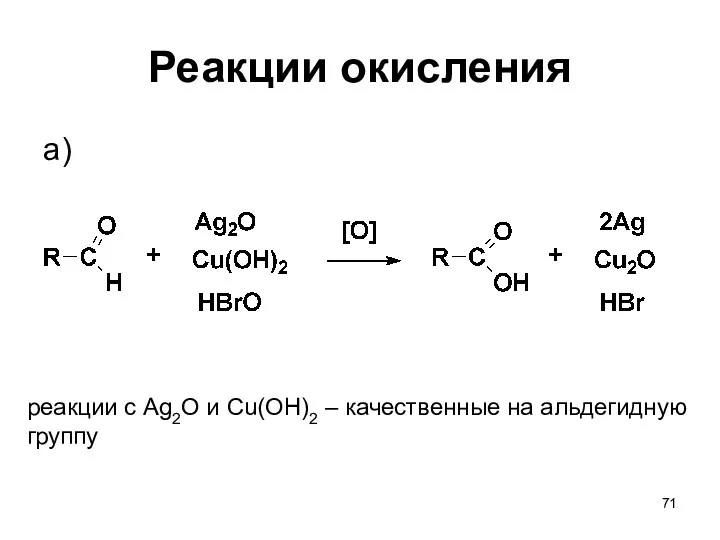
- 71. Реакции окисления a) реакции с Ag2O и Cu(OH)2 – качественные на альдегидную группу
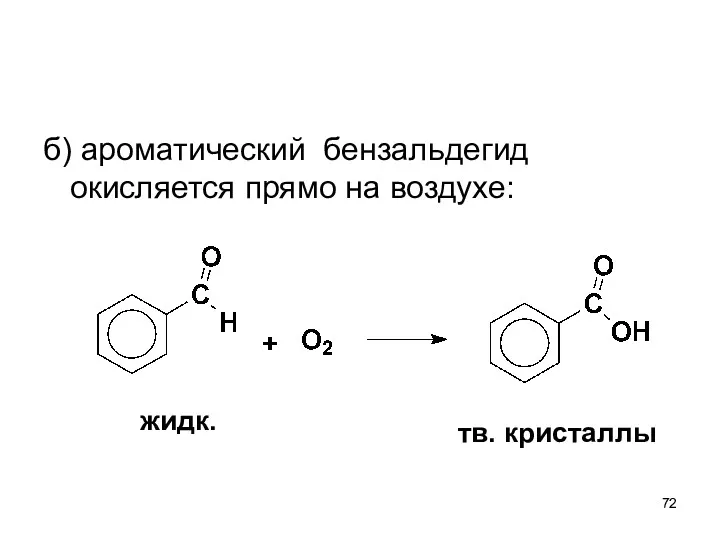
- 72. б) ароматический бензальдегид окисляется прямо на воздухе: жидк. тв. кристаллы
- 73. в) кетоны не окисляются, а в жестких условиях разрушаются.
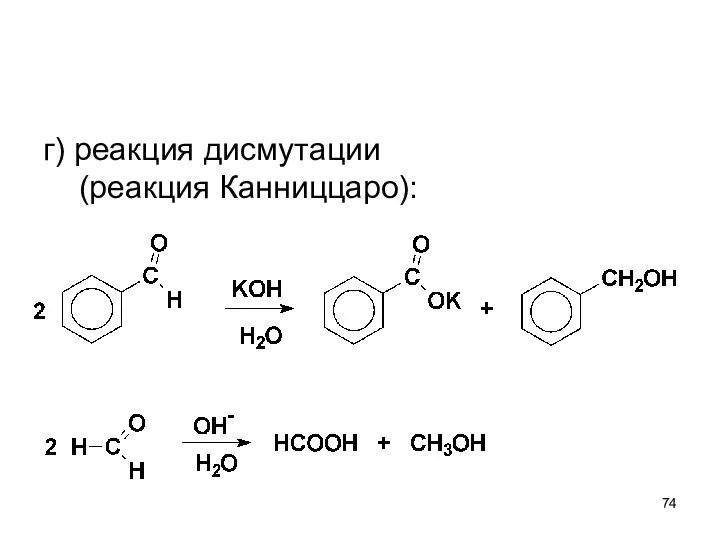
- 74. г) реакция дисмутации (реакция Канниццаро):
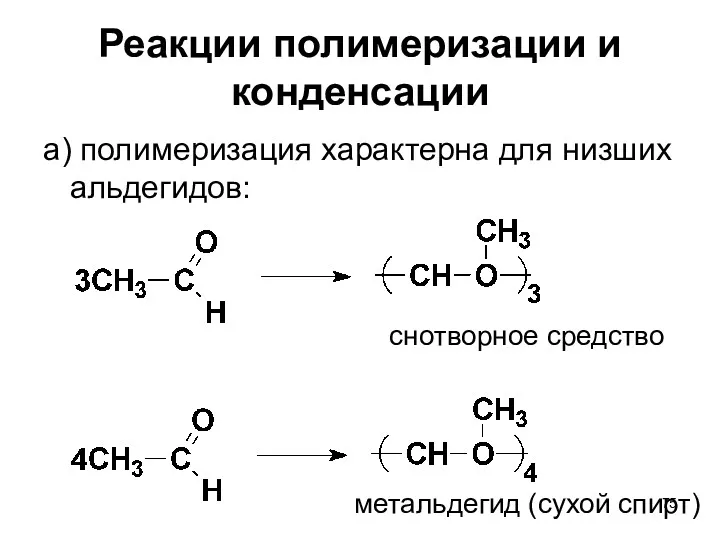
- 75. Реакции полимеризации и конденсации а) полимеризация характерна для низших альдегидов: снотворное средство метальдегид (сухой спирт)
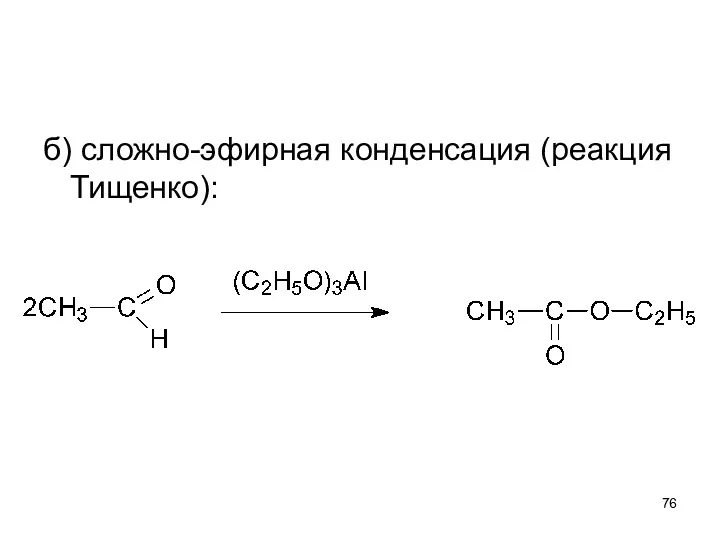
- 76. б) сложно-эфирная конденсация (реакция Тищенко):
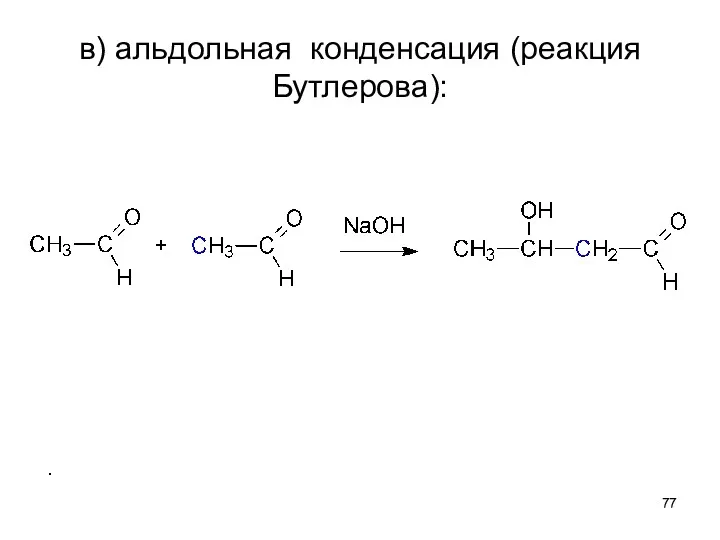
- 77. в) альдольная конденсация (реакция Бутлерова):
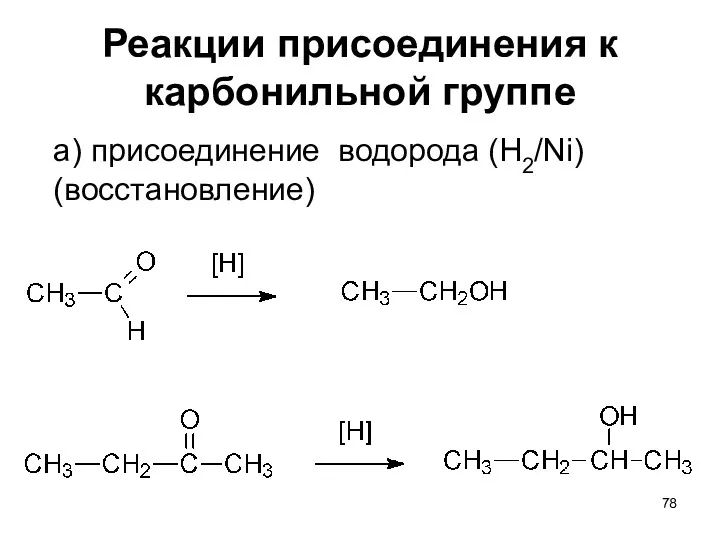
- 78. Реакции присоединения к карбонильной группе а) присоединение водорода (H2/Ni) (восстановление)
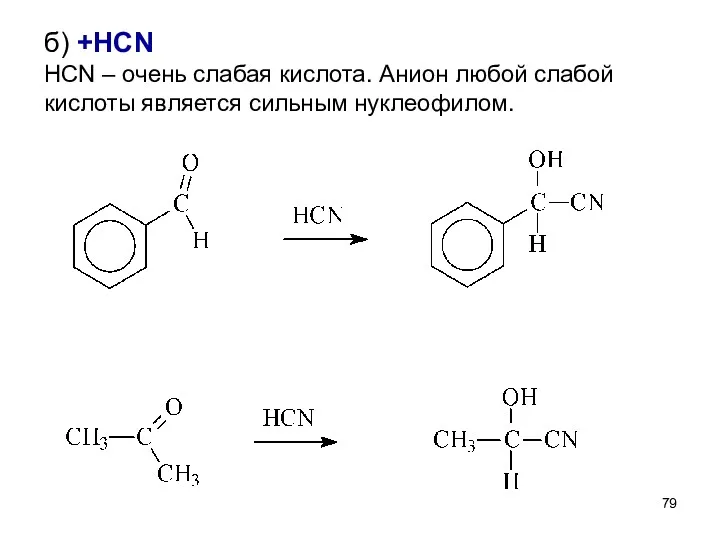
- 79. б) +HCN HCN – очень слабая кислота. Анион любой слабой кислоты является сильным нуклеофилом.
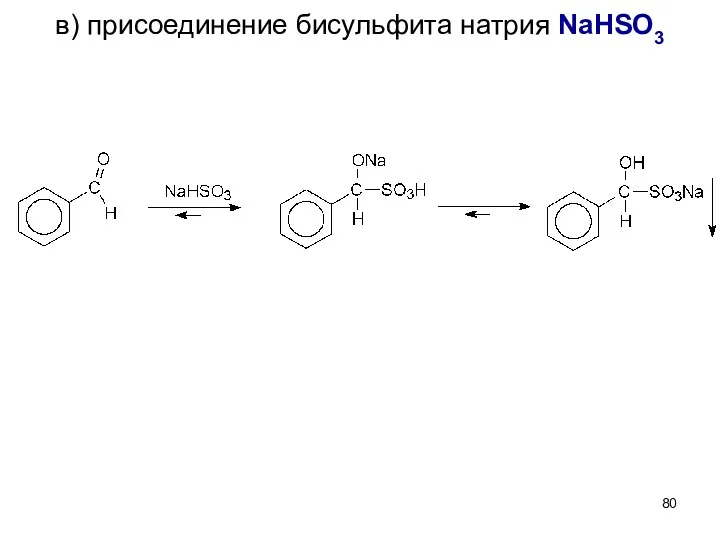
- 80. в) присоединение бисульфита натрия NaHSO3
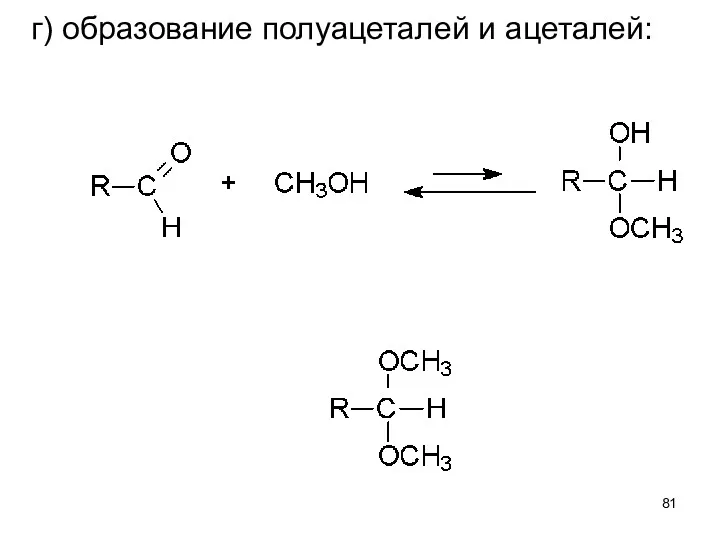
- 81. г) образование полуацеталей и ацеталей:
- 82. д) аналогично для кетонов идет образование полукеталей и кеталей
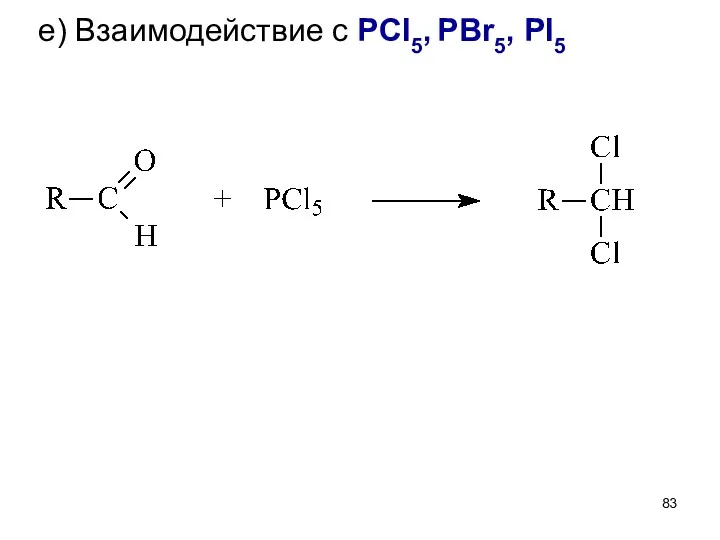
- 83. е) Взаимодействие с PCl5, PBr5, PI5
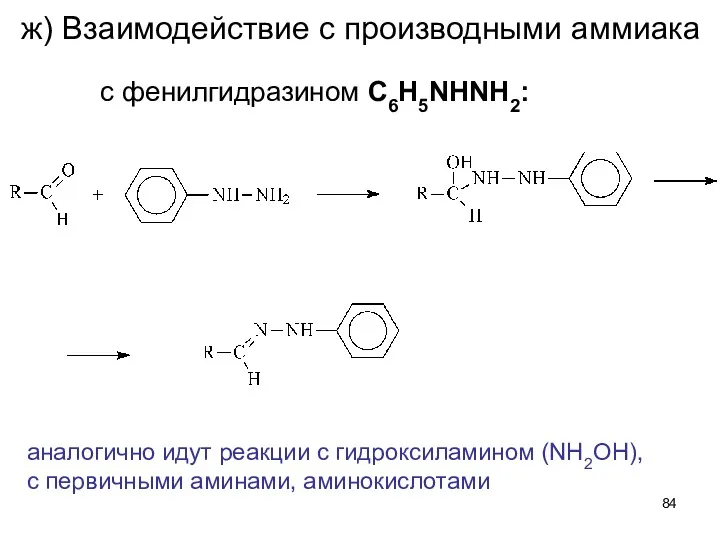
- 84. ж) Взаимодействие с производными аммиака с фенилгидразином C6H5NHNH2: аналогично идут реакции с гидроксиламином (NH2OH), с первичными
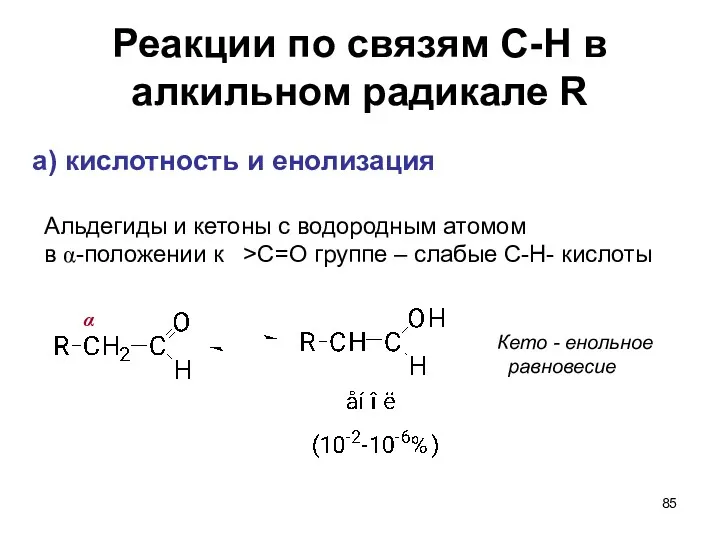
- 85. Реакции по связям С-Н в алкильном радикале R а) кислотность и енолизация Альдегиды и кетоны с
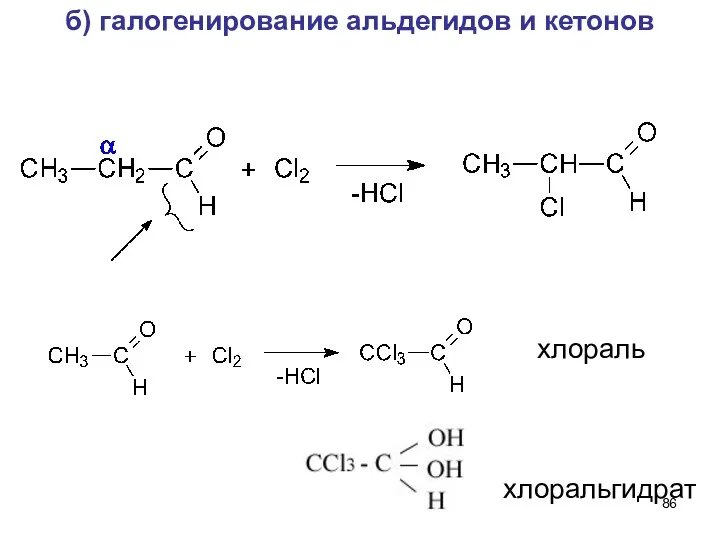
- 86. б) галогенирование альдегидов и кетонов хлораль хлоральгидрат
- 87. Получение альдегидов и кетонов Окислением первичных спиртов (CuO) получают альдегиды, а при окислении вторичных спиртов –
- 88. КАРБОНОВЫЕ КИСЛОТЫ (карбоксильные производные)
- 89. Классификация: алифатические КК (предельные и непредельные) ароматические КК гетероциклические КК Содержат карбоксильную группу, связанную с алкильной
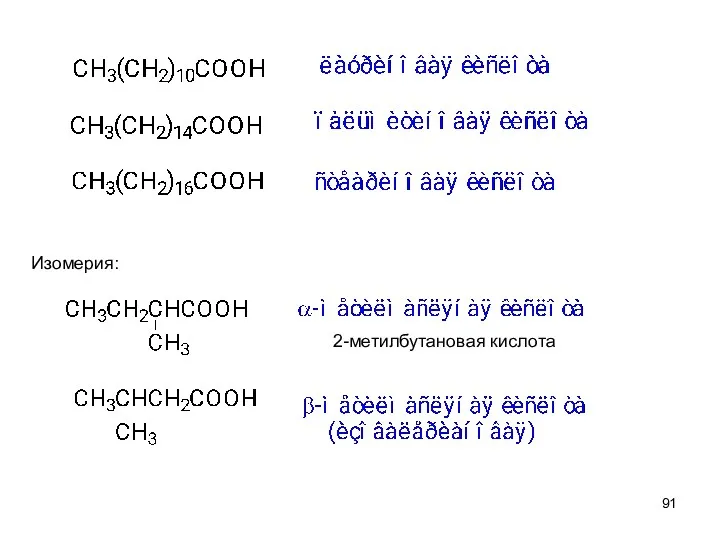
- 90. Предельные монокарбоновые кислоты CnH2n+1COOH Номенклатура
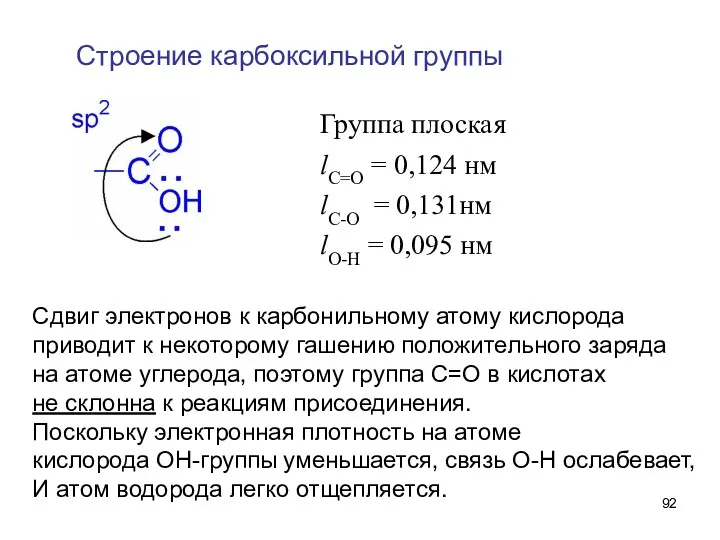
- 92. Строение карбоксильной группы Группа плоская lC=O = 0,124 нм lC-O = 0,131нм lO-H = 0,095 нм
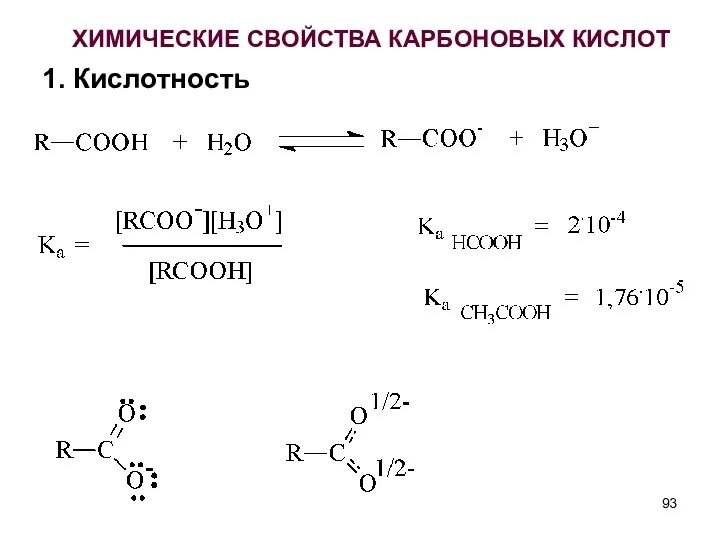
- 93. ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ 1. Кислотность
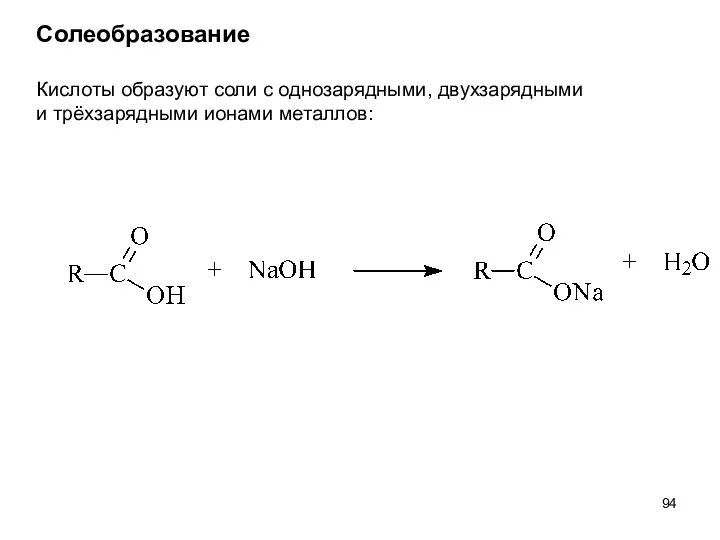
- 94. Солеобразование Кислоты образуют соли с однозарядными, двухзарядными и трёхзарядными ионами металлов:
- 95. 2. Реакции нуклеофильного замещения в карбоксильной группе - получение функциональных производных карбоновых кислот (OH-группа замещена на
- 96. ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ (ФПКК)
- 97. I. Сложные эфиры
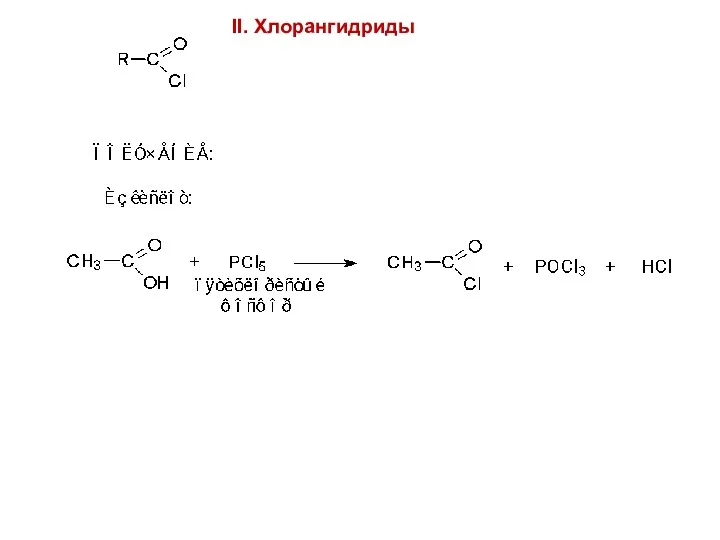
- 98. II. Хлорангидриды
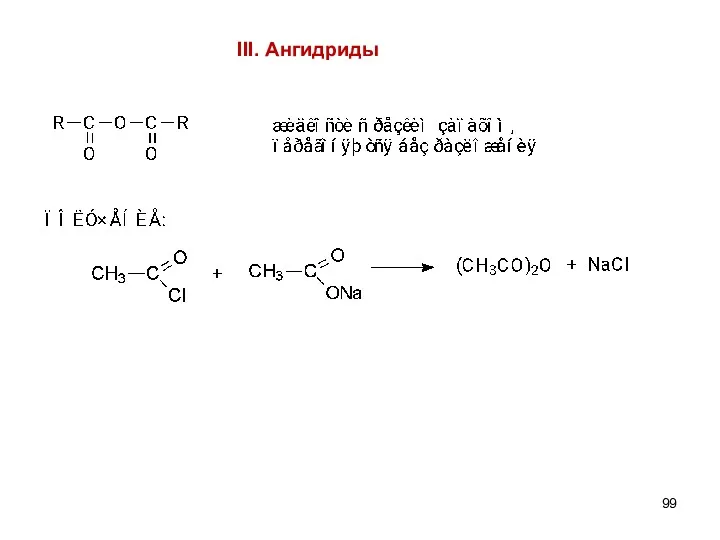
- 99. III. Ангидриды
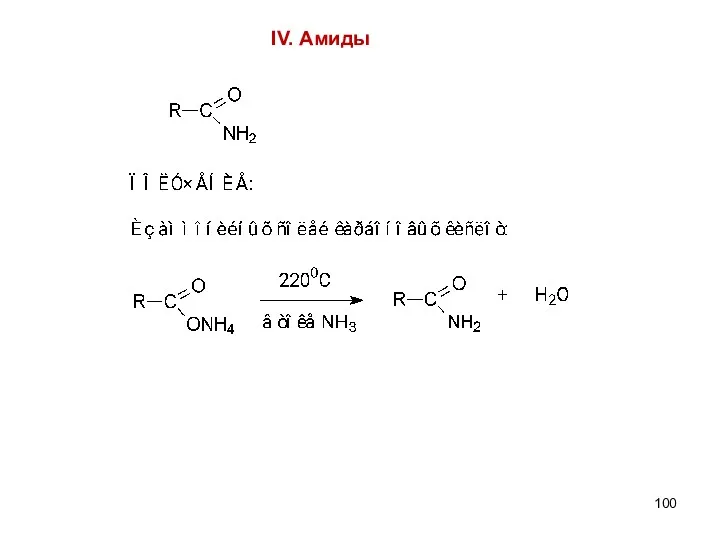
- 100. IV. Амиды
- 101. Липиды содержатся в животных и растительных тканях Большая группа соединений, содержащих в своем составе сложно-эфирную связь,
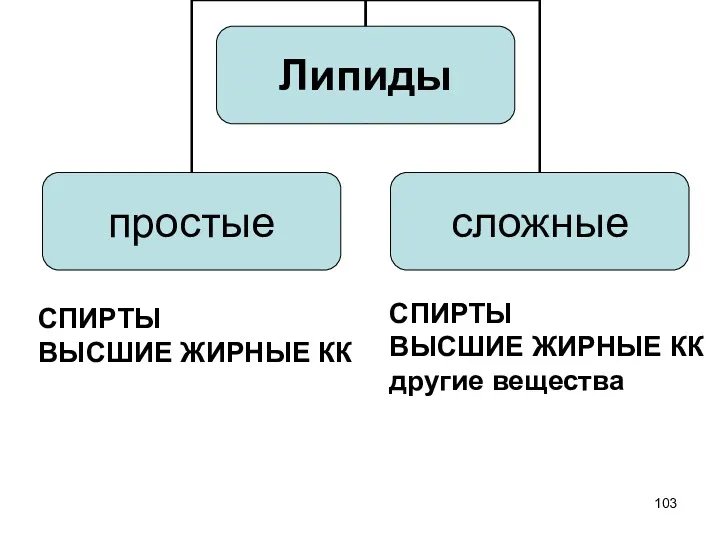
- 102. Структурные компоненты липидов СПИРТЫ ВЫСШИЕ ЖИРНЫЕ КАРБОНОВЫЕ КИСЛОТЫ другие вещества
- 103. СПИРТЫ ВЫСШИЕ ЖИРНЫЕ КК другие вещества СПИРТЫ ВЫСШИЕ ЖИРНЫЕ КК
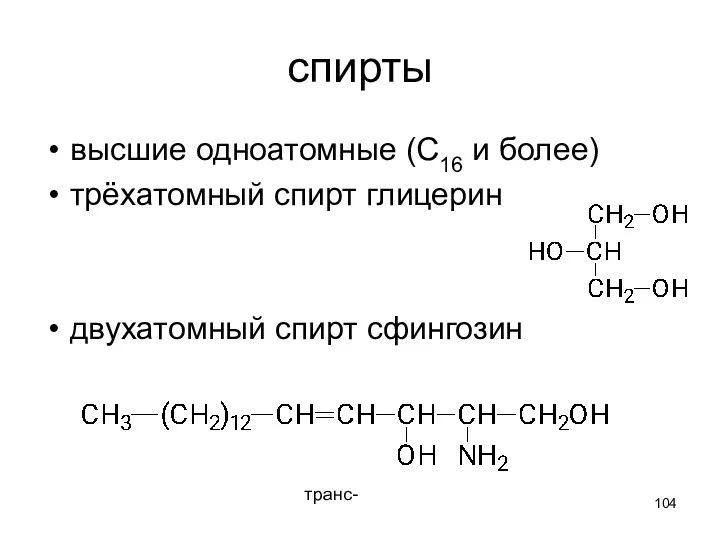
- 104. спирты высшие одноатомные (С16 и более) трёхатомный спирт глицерин двухатомный спирт сфингозин транс-
- 105. Простые липиды воски жиры и масла церамиды стериды
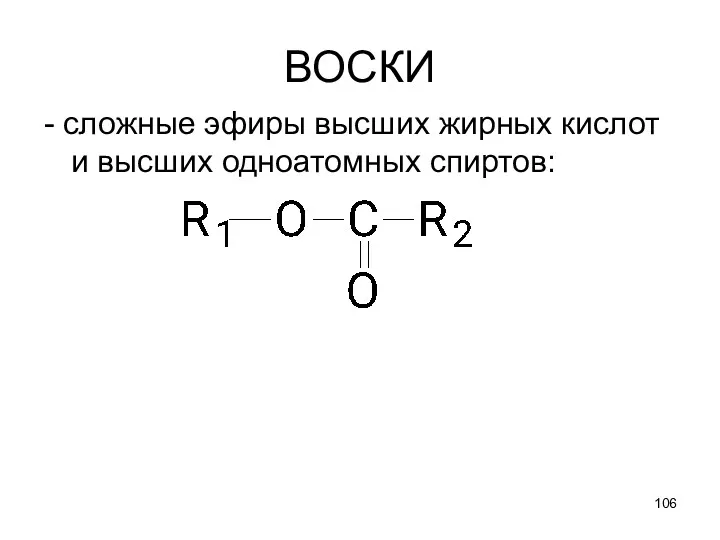
- 106. ВОСКИ - сложные эфиры высших жирных кислот и высших одноатомных спиртов:
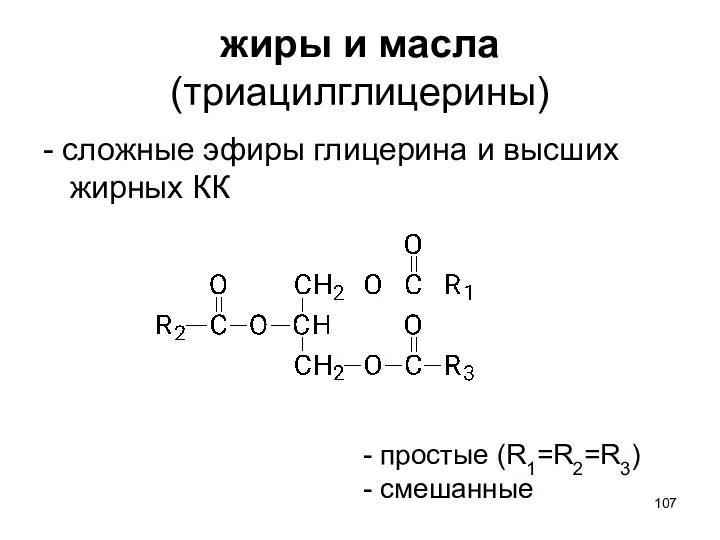
- 107. жиры и масла (триацилглицерины) - сложные эфиры глицерина и высших жирных КК простые (R1=R2=R3) смешанные
- 108. церамиды - N-ацилированные производные спирта сфингозина
- 109. стериды - сложные эфиры высокосмолекулярного циклического спирта стерола и высокомолекулярной КК
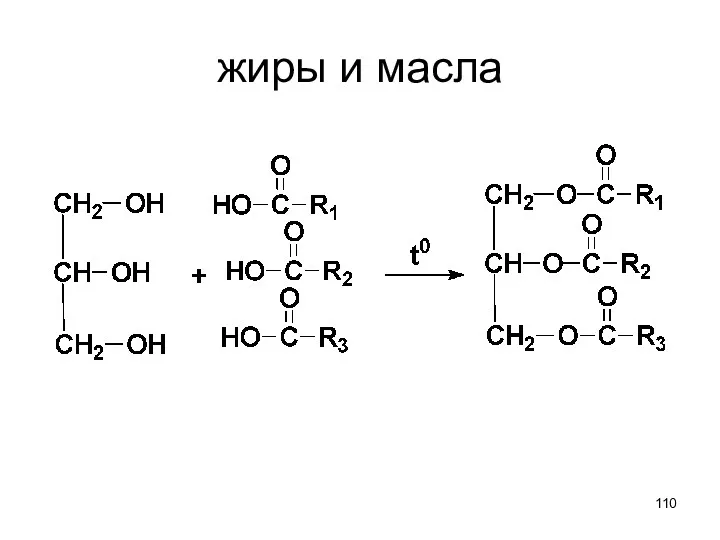
- 110. жиры и масла
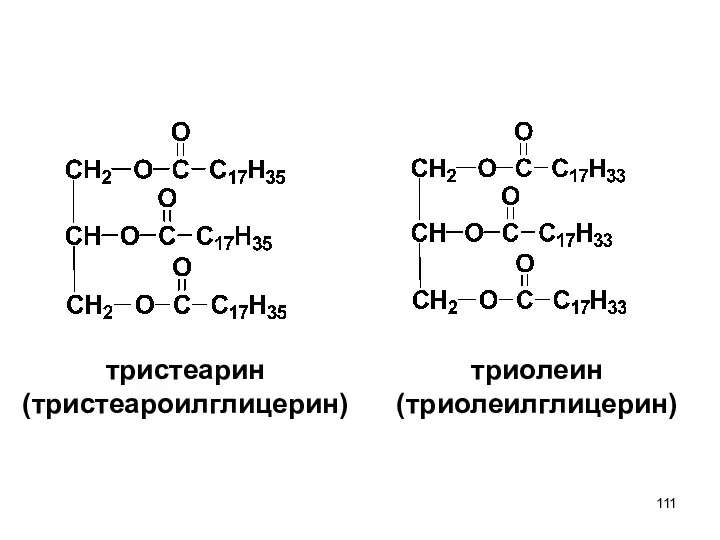
- 111. тристеарин (тристеароилглицерин) триолеин (триолеилглицерин)
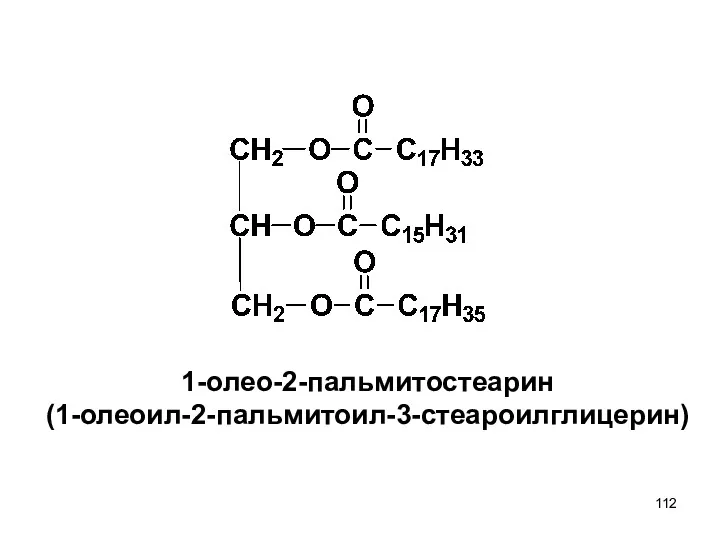
- 112. 1-олео-2-пальмитостеарин (1-олеоил-2-пальмитоил-3-стеароилглицерин)
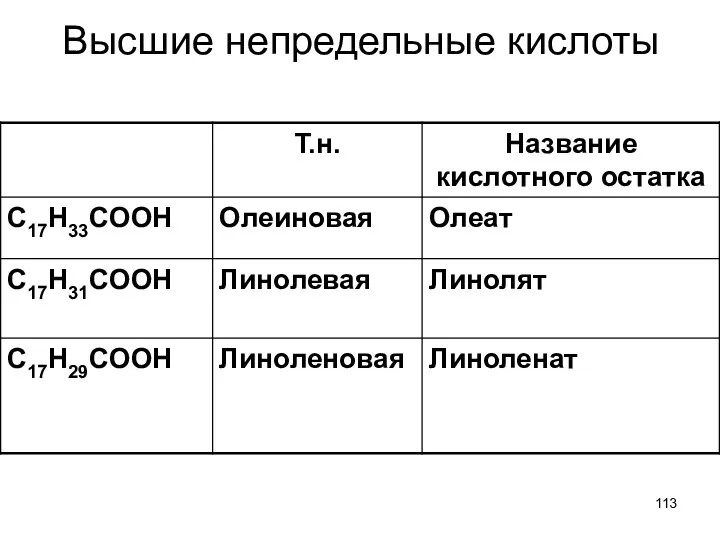
- 113. Высшие непредельные кислоты
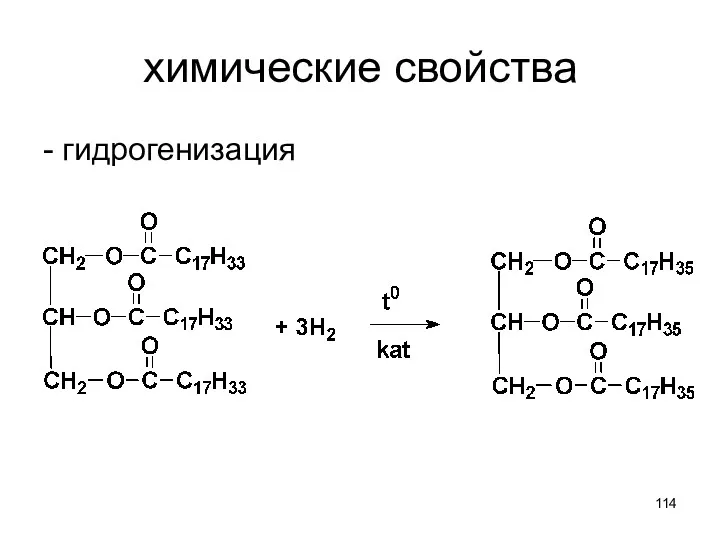
- 114. химические свойства - гидрогенизация
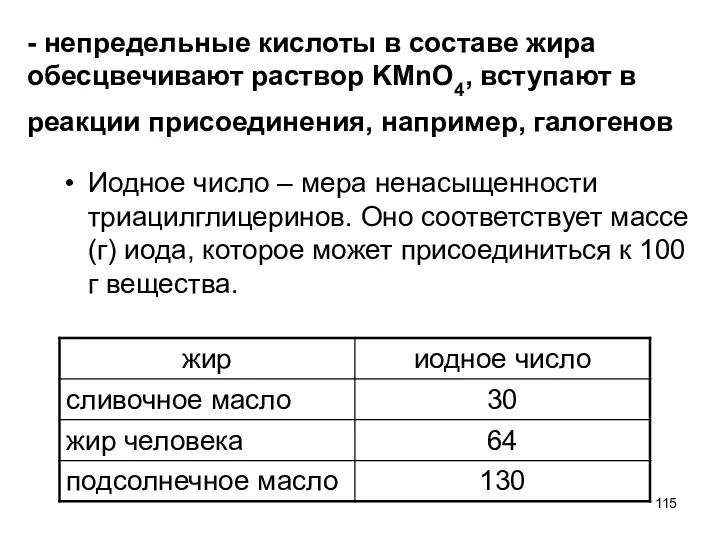
- 115. - непредельные кислоты в составе жира обесцвечивают раствор KMnO4, вступают в реакции присоединения, например, галогенов Иодное
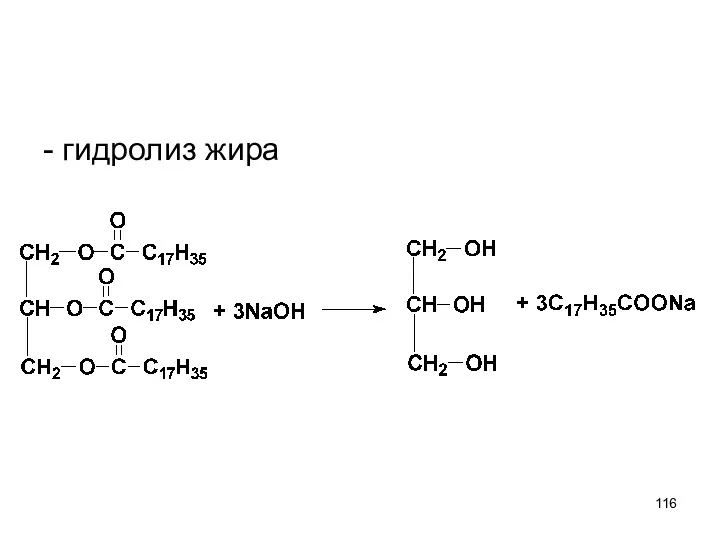
- 116. - гидролиз жира
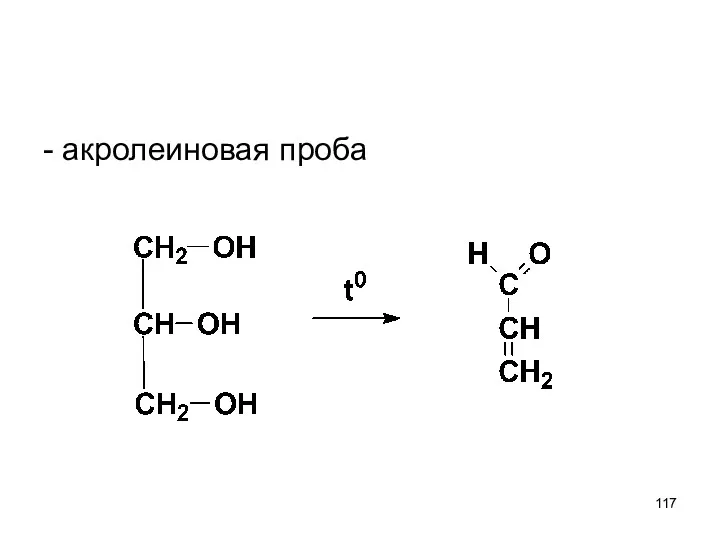
- 117. - акролеиновая проба
- 118. Биологическая роль жиров Энергетическая Структурная Резервная Механическая защита внутренних органов от повреждений Термоизоляционная Источник эндогенной воды
- 119. Сложные липиды Фосфолипиды Сфинголипиды Гликолипиды
- 120. Фосфолипиды - липиды, при гидролизе отщепляющие фосфорную кислоту Глицерофосфолипиды - сложные эфиры глицерина с высшими жирными
- 121. Глицерофосфолипиды – главные липидные компоненты клеточных мембран. Они сопутствуют жирам в пище и служат источником фосфорной
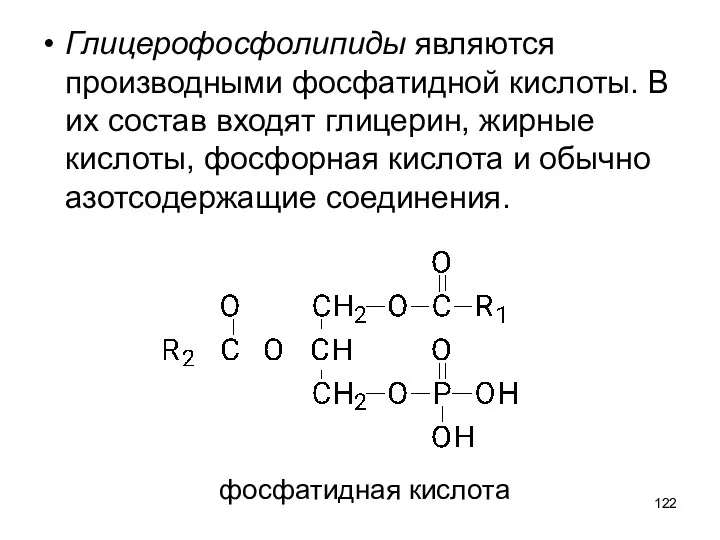
- 122. Глицерофосфолипиды являются производными фосфатидной кислоты. В их состав входят глицерин, жирные кислоты, фосфорная кислота и обычно
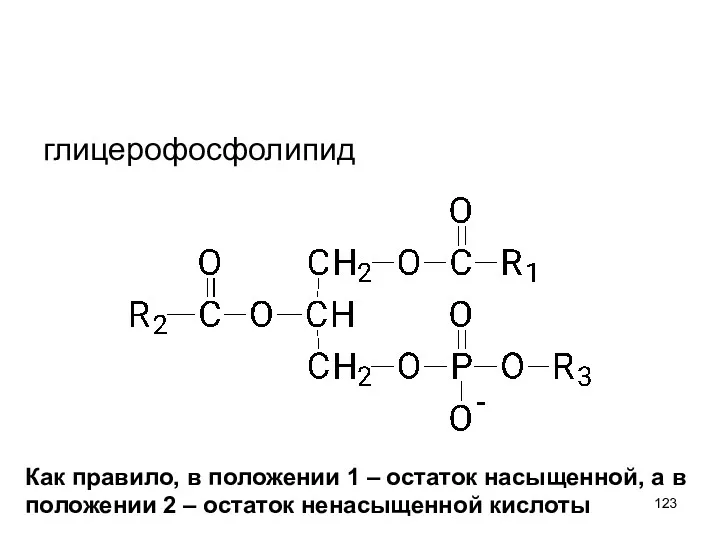
- 123. глицерофосфолипид Как правило, в положении 1 – остаток насыщенной, а в положении 2 – остаток ненасыщенной
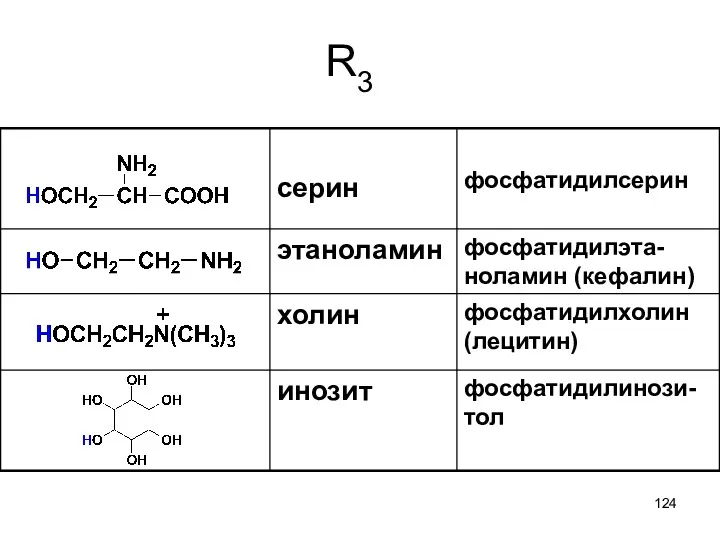
- 124. R3
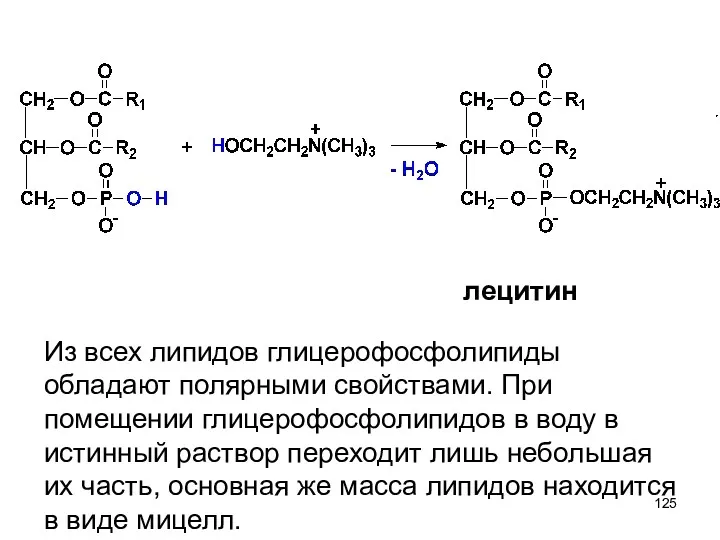
- 125. лецитин Из всех липидов глицерофосфолипиды обладают полярными свойствами. При помещении глицерофосфолипидов в воду в истинный раствор
- 127. Скачать презентацию





































 Агрегатное состояние веществ и типы химических связей
Агрегатное состояние веществ и типы химических связей Вода - вещество обычное или необычное
Вода - вещество обычное или необычное Химические реакции
Химические реакции Основания
Основания Галогены. Строение атомов и молекул галогенов
Галогены. Строение атомов и молекул галогенов Химический элемент алюминий
Химический элемент алюминий Ионные уравнения реакций
Ионные уравнения реакций Термический анализ
Термический анализ Формирование ключевых компетенций на уроках химии
Формирование ключевых компетенций на уроках химии Приготовление растворов солей с определенной массовой долей растворенного вещества
Приготовление растворов солей с определенной массовой долей растворенного вещества Растворы. Термодинамическая теория растворов
Растворы. Термодинамическая теория растворов Типы химических реакций
Типы химических реакций Химические формулы
Химические формулы Галогены
Галогены проект по биологииНаучно-исследовательская работа
проект по биологииНаучно-исследовательская работа Химия в косметологии
Химия в косметологии Беломорская соль, проектная работа
Беломорская соль, проектная работа Циклоалканы
Циклоалканы Щелочноземельные металлы
Щелочноземельные металлы Распространение водорода в природе. Получение в лаболатории
Распространение водорода в природе. Получение в лаболатории Элементы теории горения
Элементы теории горения Кислоты, содержащие серу (S)
Кислоты, содержащие серу (S) Гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Гетерофункциональные соединения, участвующие в процессах жизнедеятельности Композиционные материалы – материалы будущего
Композиционные материалы – материалы будущего Неорганические полимеры
Неорганические полимеры Первичная структура, идентификация белка. Масс-спектрометрия
Первичная структура, идентификация белка. Масс-спектрометрия Кристаллические решетки
Кристаллические решетки Циклические углеводороды. Циклоалканы
Циклические углеводороды. Циклоалканы