Содержание
- 2. Галогены
- 3. План урока: 1.Определить положение галогенов в ПСХЭ. 2.Рассмотреть строение атомов и молекул галогенов. 3.Физические свойства простых
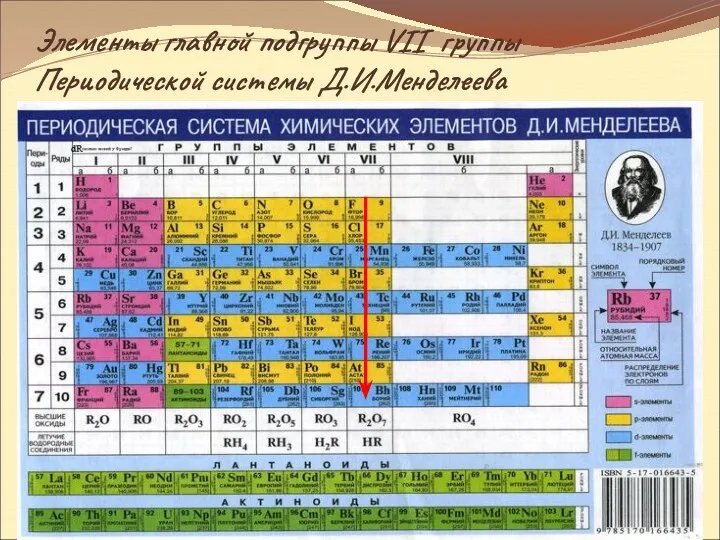
- 4. Элементы главной подгруппы VII группы Периодической системы Д.И.Менделеева
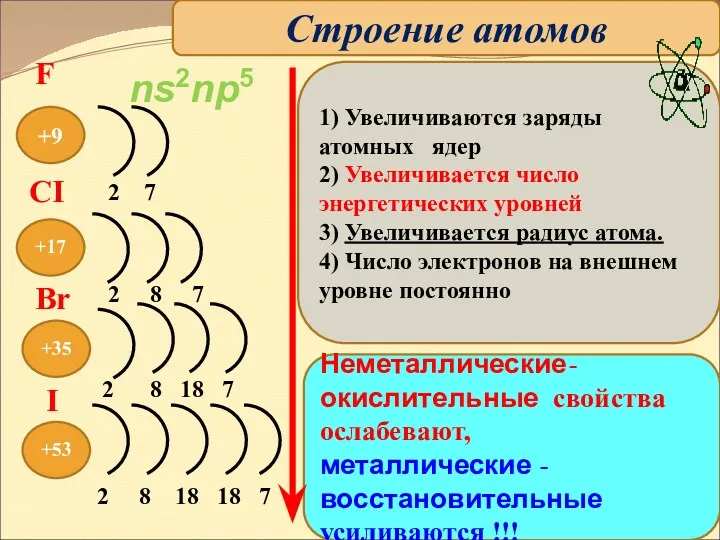
- 5. +9 +53 +35 +17 Неметаллические-окислительные свойства ослабевают, металлические -восстановительные усиливаются !!! 2 7 2 8 7
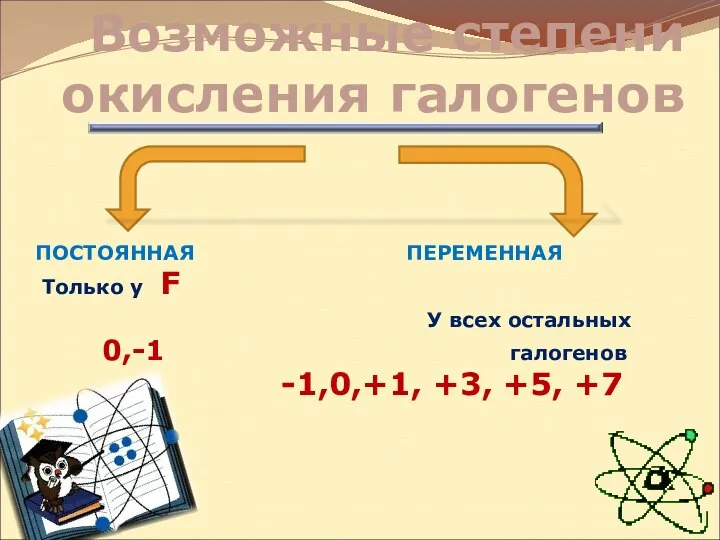
- 6. Возможные степени окисления галогенов ПОСТОЯННАЯ ПЕРЕМЕННАЯ Только у F У всех остальных 0,-1 галогенов -1,0,+1, +3,
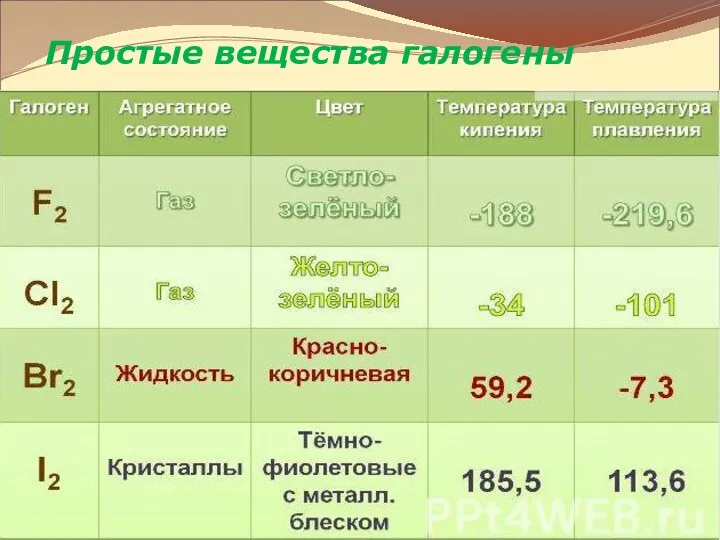
- 7. Простые вещества галогены Молекулы галогенов состоят из двух атомов F2 Cl2 Br2 I2 Тип химической связи
- 8. Простые вещества галогены
- 9. История открытия «Фторос» - разрушающий Открыт в 1866г. Анри Муассан Самый активный, самый электроотрицательный, самый реакционноспособный,
- 10. История открытия Карл Вильгельм Шееле Английский поэт Уилфред Оуэн, погибший в сражениях Первой мировой войны, оставил
- 11. История открытия Антуан Жером Балар (1802 – 1876) "Бром" по-гречески "зловонный" (Очень "миленькое" имя!), Да ещё
- 12. История открытия Открыт в 1811г Йод красой своей гордился, Твердым был, но испарился. Фиолетовый, как ночь,
- 13. История открытия Второй после технеция элемент. Получен в 1940 г. американскими учеными Т. (Д.) Корсоном, У.
- 14. Галогены в природе Флюорит – CaF2
- 15. «Все есть яд и все есть лекарство. Только доза делает лекарство ядом, яд лекарством». Парацельс. Биологическое
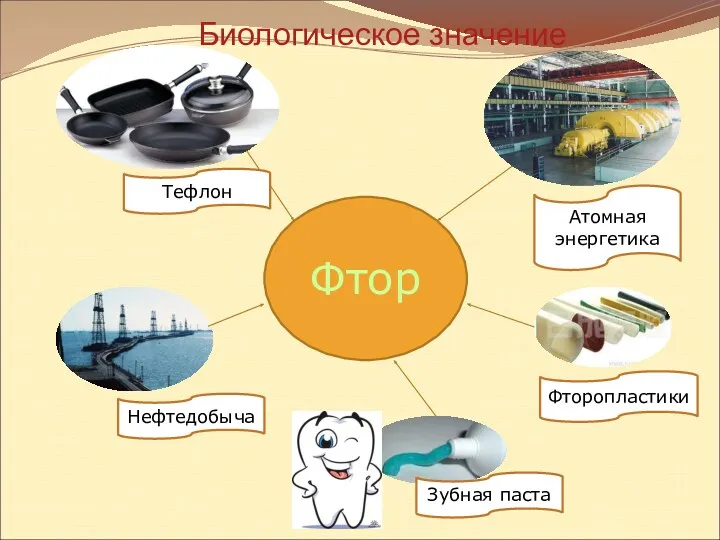
- 16. Фтор Тефлон Нефтедобыча Зубная паста Фторопластики Атомная энергетика Биологическое значение
- 17. Хлор Отбеливатели Пестициды Хлорирование воды Синтетический каучук Растворители Пластмассы Лекарства
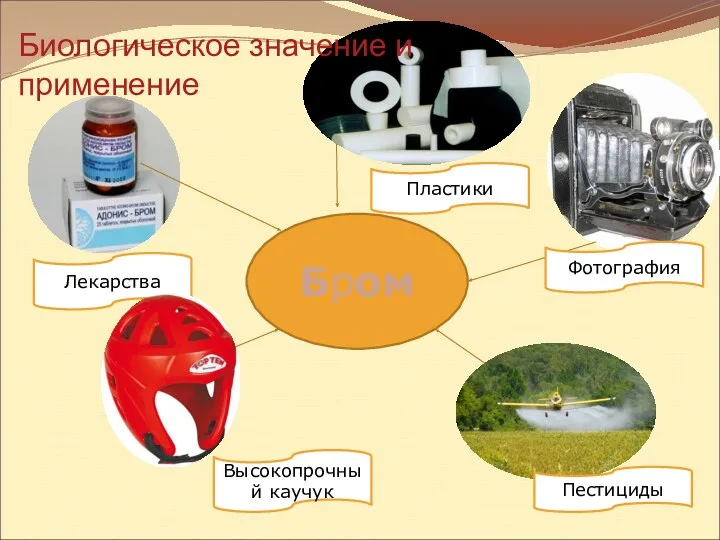
- 18. Бром Лекарства Высокопрочный каучук Фотография Пластики Пестициды Биологическое значение и применение
- 19. №1 Из перечисленных химических элементов наибольший радиус у атома: А) йода Б) брома В) фтора Г)
- 21. Скачать презентацию











 Чистые вещества и смеси
Чистые вещества и смеси Мыло и синтетические моющие средства
Мыло и синтетические моющие средства Материаловедение. Лекция 1
Материаловедение. Лекция 1 Залізо. Фізичні та хімічні властивості
Залізо. Фізичні та хімічні властивості Почему мыло пенится
Почему мыло пенится Алюминий
Алюминий Гидрогеохимия урана и тория
Гидрогеохимия урана и тория Природные источники углеводородов
Природные источники углеводородов Химические волокна (7 класс)
Химические волокна (7 класс) Аргентум, или серебро
Аргентум, или серебро Алкины. Физические и химические свойства
Алкины. Физические и химические свойства Спирты: общая характеристика
Спирты: общая характеристика Бескислородные керамические материалы
Бескислородные керамические материалы Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Процессы, проходящие в растворах (продолжение темы)
Процессы, проходящие в растворах (продолжение темы) The Molecules of Life
The Molecules of Life Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья
Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья Электродные процессы
Электродные процессы Физические и химические свойства алмаза. Алмазная промышленность в России
Физические и химические свойства алмаза. Алмазная промышленность в России Кислоты
Кислоты Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Основні класи неорганічних сполук
Основні класи неорганічних сполук Совершенствование урока химии в условиях ФГОС
Совершенствование урока химии в условиях ФГОС Игра Химические элементы (формулы и названия)
Игра Химические элементы (формулы и названия) Химическая кинетика и катализ
Химическая кинетика и катализ Органічні сполуки. 3D моделі органічних сполук
Органічні сполуки. 3D моделі органічних сполук