Содержание
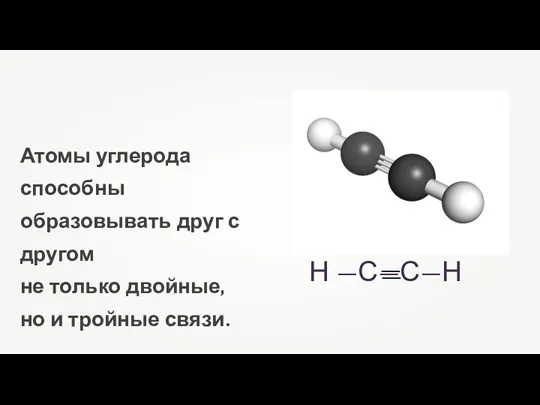
- 2. Атомы углерода способны образовывать друг с другом не только двойные, но и тройные связи.
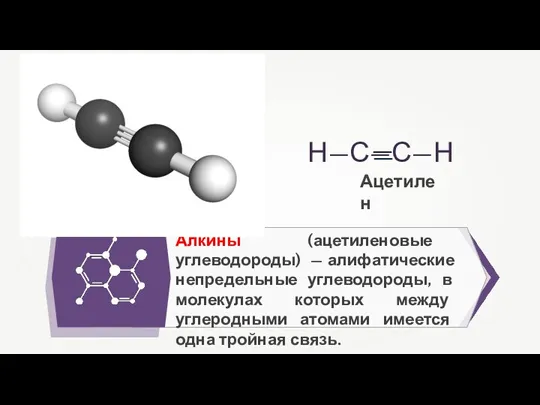
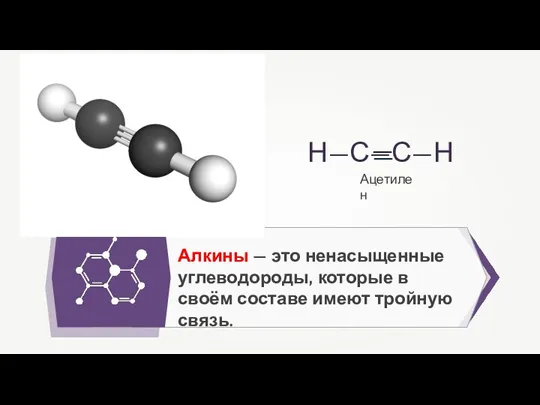
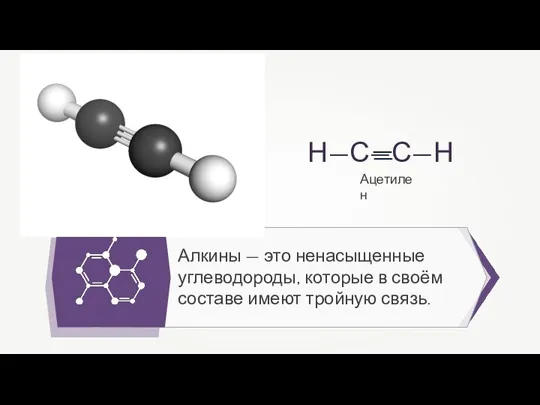
- 3. Алкины (ацетиленовые углеводороды) — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна тройная
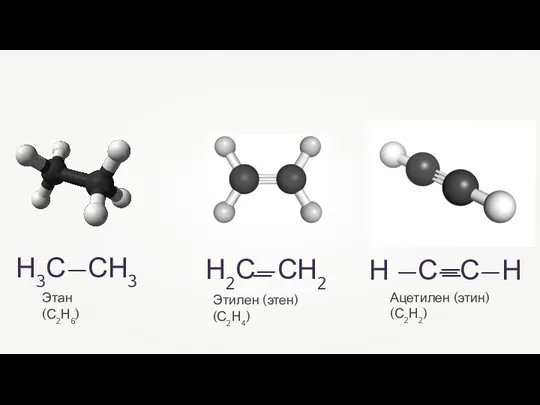
- 4. Ацетилен (этин) (С2Н2) Н3С—СН3 Этилен (этен) (С2Н4) Этан (С2Н6)
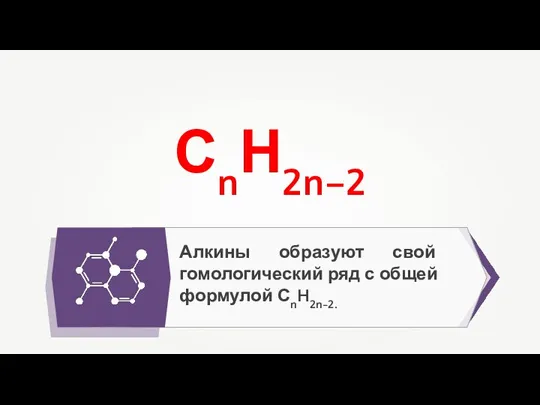
- 5. Алкины образуют свой гомологический ряд с общей формулой СnH2n-2. СnН2n–2
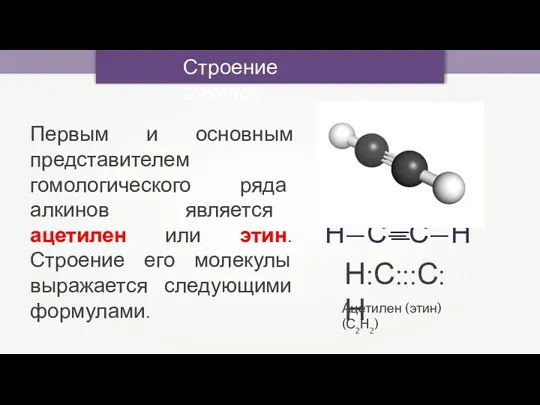
- 6. Строение алкинов Ацетилен (этин) (С2Н2) Н:С:::С:Н Первым и основным представителем гомологического ряда алкинов является ацетилен или
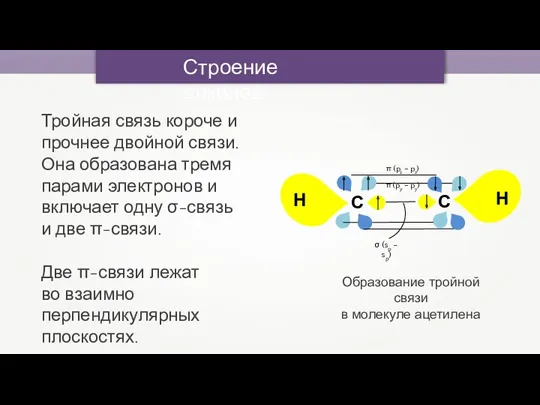
- 7. Строение алкинов Тройная связь короче и прочнее двойной связи. Она образована тремя парами электронов и включает
- 8. По названию первого представителя этого ряда — ацетилена — эти непредельные углеводороды называют ацетиленовыми. Строение алкинов
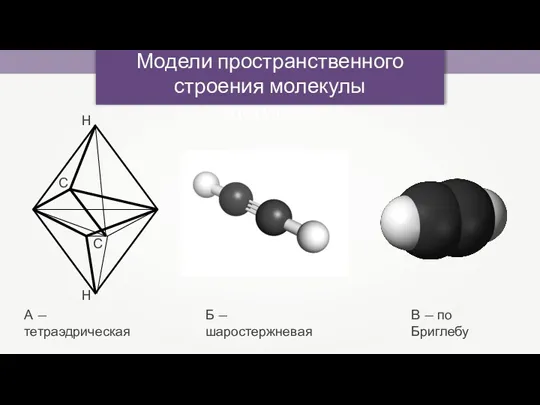
- 9. Модели пространственного строения молекулы ацетилена А — тетраэдрическая Б — шаростержневая В — по Бриглебу С
- 10. Строение алкинов В алкинах атомы углерода находятся в третьем валентном состоянии sp-гибридизации. Между углеродными атомами возникает
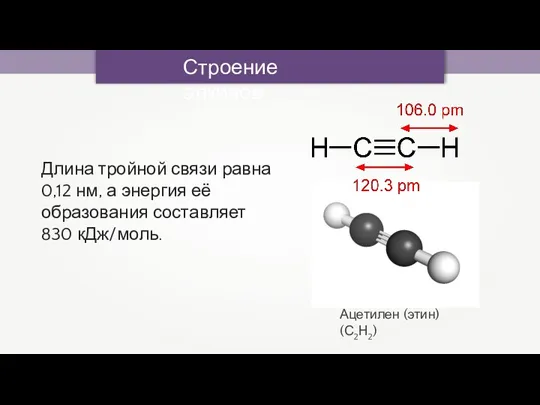
- 11. Строение алкинов Ацетилен (этин) (С2Н2) Длина тройной связи равна 0,12 нм, а энергия её образования составляет
- 12. Номенклатура алкинов Ацетилен (этин) (С2Н2) Ацетиленовые углеводороды называют, заменяя в алканах суффикс -ан на суффикс -ин.
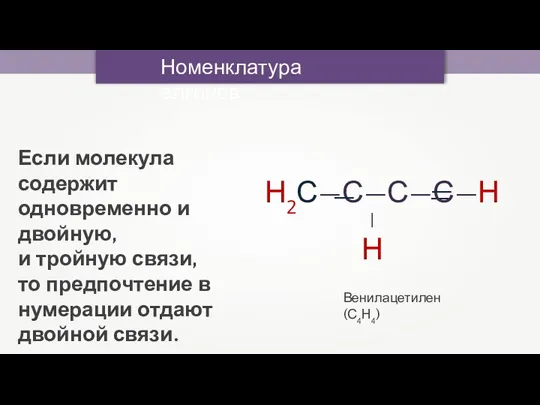
- 13. Номенклатура алкинов Венилацетилен (С4Н4) Если молекула содержит одновременно и двойную, и тройную связи, то предпочтение в
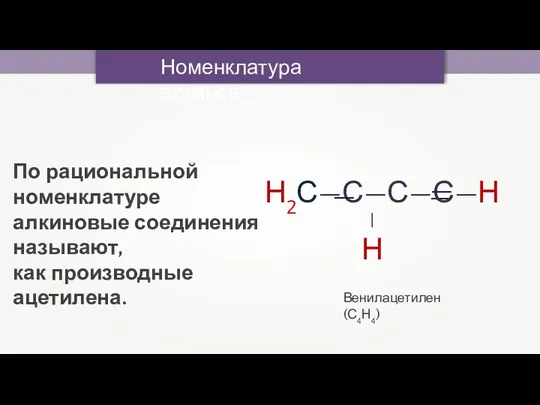
- 14. Номенклатура алкинов Венилацетилен (С4Н4) По рациональной номенклатуре алкиновые соединения называют, как производные ацетилена.
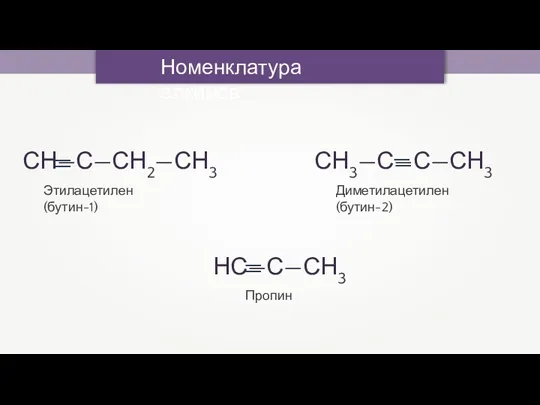
- 15. Номенклатура алкинов Этилацетилен (бутин-1) Диметилацетилен (бутин-2) Пропин
- 16. Номенклатура алкинов 3-метилбутин-1 (С5Н8)
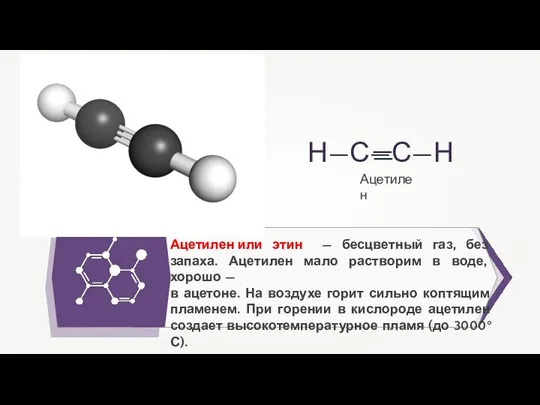
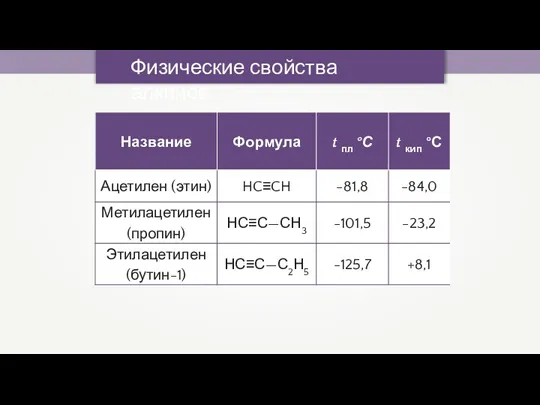
- 17. Ацетилен или этин — бесцветный газ, без запаха. Ацетилен мало растворим в воде, хорошо — в
- 18. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
- 19. Ацетилен (этин) (С2Н2) Н:С:::С:Н Простейшим представителем углеводородов с тройной связью является ацетилен — родоначальник гомологического ряда
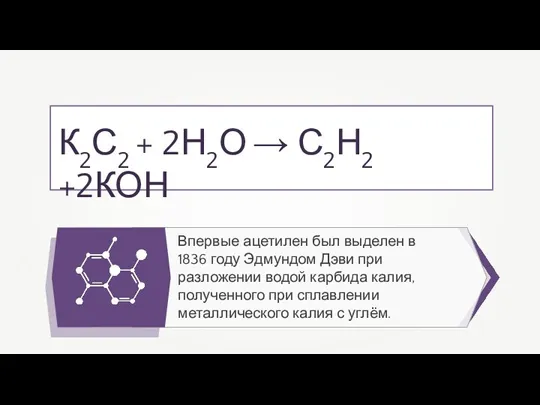
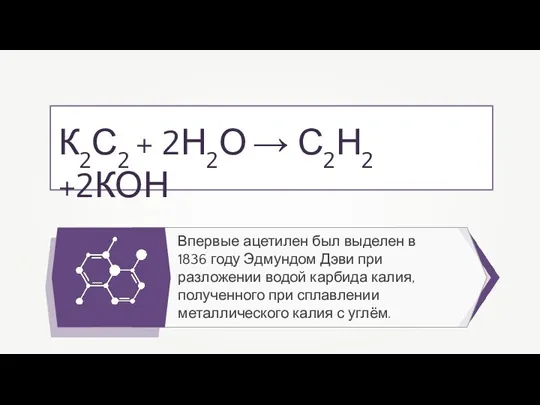
- 20. Впервые ацетилен был выделен в 1836 году Эдмундом Дэви при разложении водой карбида калия, полученного при
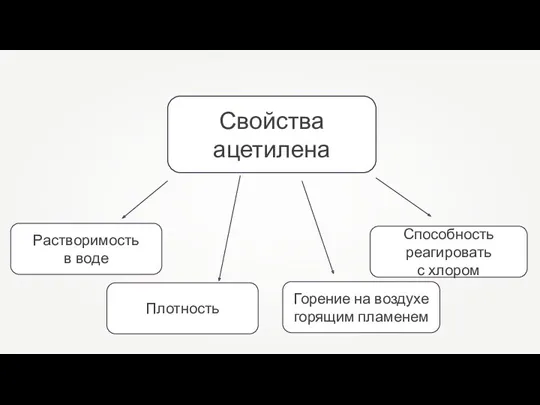
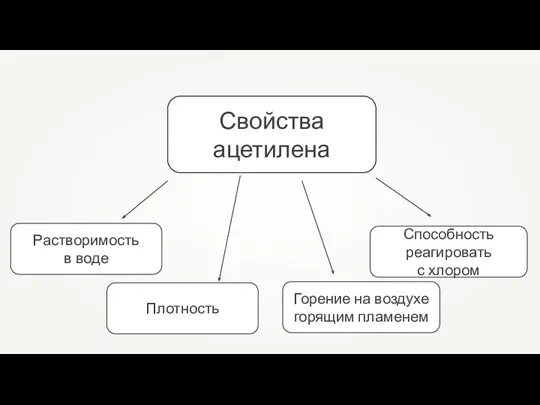
- 21. Свойства ацетилена
- 22. М. Бертло 1827–1907 гг. В 1860 г. Марселен Бертло впервые получил ацетилен в разряде дуги между
- 23. Алкины — это ненасыщенные углеводороды, которые в своём составе имеют тройную связь. Ацетилен
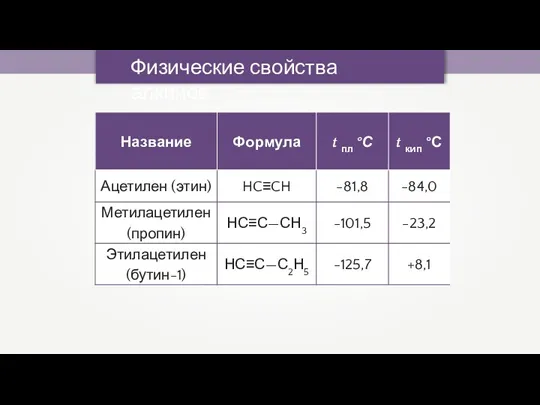
- 24. Физические свойства алкинов При обычных условиях: 1. С2–С4 — газы; 2. C5–C16 — жидкости; 3. начиная
- 25. Физические свойства алкинов
- 26. Физические свойства алкинов Растворимость низших алкинов в воде несколько выше, чем алкенов и алканов, однако она
- 27. Химические свойства алкинов Алкины способны вступать в реакции присоединения, замещения, полимеризации и окисления. Этилацетилен (бутин-1) Пропин
- 28. Ацетилен (этин) (С2Н2) Н:С:::С:Н Простейшим представителем углеводородов с тройной связью является ацетилен — родоначальник гомологического ряда
- 29. Впервые ацетилен был выделен в 1836 году Эдмундом Дэви при разложении водой карбида калия, полученного при
- 30. Свойства ацетилена
- 31. М. Бертло 1827–1907 гг. В 1860 г. Марселен Бертло впервые получил ацетилен в разряде дуги между
- 32. Алкины — это ненасыщенные углеводороды, которые в своём составе имеют тройную связь. Ацетилен
- 33. Физические свойства алкинов При обычных условиях: 1. С2–С4 — газы; 2. C5–C16 — жидкости; 3. начиная
- 34. Физические свойства алкинов
- 35. Физические свойства алкинов Растворимость низших алкинов в воде несколько выше, чем алкенов и алканов, однако она
- 36. Химические свойства алкинов Алкины способны вступать в реакции присоединения, замещения, полимеризации и окисления. Этилацетилен (бутин-1) Пропин
- 37. Реакция присоединения CH3—C—СН → CH3—CСl—СН2 → CH3—CСl2—СН3 — — — HCl HCl
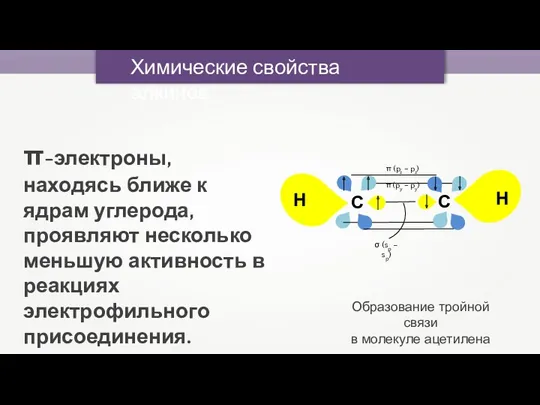
- 38. Химические свойства алкинов Углеродные атомы в молекулах алкинов расположены ближе друг к другу, чем в алкенах,
- 39. π-электроны, находясь ближе к ядрам углерода, проявляют несколько меньшую активность в реакциях электрофильного присоединения. Образование тройной
- 40. Реакция присоединения спиртов к алкинам НC—СН + С2H5ОН → C2H5—О—СН—СН2 — — —
- 41. НC—С—СН3 → CH2—CH—СН3 → CH3—CH2—СН3 — +Н2 t, Ni +Н2 t, Ni — — Реакция гидрирования
- 42. НC—СН → BrHC—СНBr → Br2HC—CHBr2 +Br2 — Реакция галогенирования +Br2 — — 1,2-дибромэтен 1,1,2,2-тетрабромэтан
- 43. Реакция присоединения галогеноводородов 2-бромпропен 2,2-дибромпропан
- 44. Замещение водородных атомов ацетилена на металлы, называется реакцией металлирования. В результате образуются металлические производные ацетилена —ацетилениды.
- 45. Реакция металлирования — —
- 46. С ацетиленидами в сухом виде следует обращаться очень осторожно: они крайне взрывоопасны.
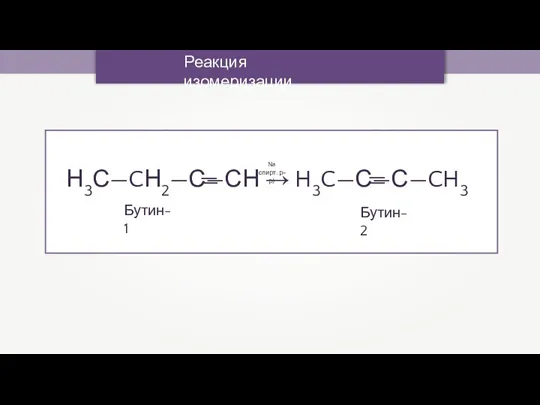
- 47. Реакция изомеризации Бутин-1 — — — Бутин-2 Na (спирт. р-р)
- 48. Ацетилен в зависимости от условий реакции способен образовывать различные продукты полимеризации — линейные или циклические.
- 49. Реакция полимеризации НС—CН + НС—СН → HC—СН—СН—CH2 Винилацетилен Cu2Cl2 — — —
- 50. Реакция полимеризации 3НС—CН → CН2—СН—С—CH—3С2Н 2 →С6Н6 Бензол — t °С
- 51. М. Бертло 1827–1907 гг. Реакцию полимеризации открыл французский учёный Марселен Бертло.
- 52. Уксусная кислота Синтетический каучук Перчатки из поливинилхлорида Растворитель Doudnick_Val
- 53. Кислородно-ацетиленовое соединение используют для сварки металлов.
- 55. Скачать презентацию




























 Относительная атомная масса. Знаки химических элементов
Относительная атомная масса. Знаки химических элементов Новые интеллектуальные материалы на основе полимеров
Новые интеллектуальные материалы на основе полимеров Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи
Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів c0198e3edf1db804a5527004a7864ed1
c0198e3edf1db804a5527004a7864ed1 5.Алкины
5.Алкины Классификация и свойства оксидов
Классификация и свойства оксидов Моделирование структуры биомакромолекул
Моделирование структуры биомакромолекул Химия. ЕГЭ. Задание № 32
Химия. ЕГЭ. Задание № 32 Получение водорода
Получение водорода Алкадиены. Циклоалканы. Лекция № 5
Алкадиены. Циклоалканы. Лекция № 5 Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага
Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага Алюминий и его соединения
Алюминий и его соединения Свойства кислот
Свойства кислот Алгоритм определения вида связи по формуле вещества
Алгоритм определения вида связи по формуле вещества Щелочноземельные металлы
Щелочноземельные металлы Сағыз пайдалы ма, әлде зиян ба?
Сағыз пайдалы ма, әлде зиян ба? Пищевые добавки
Пищевые добавки Свойства минералов Лекция 3
Свойства минералов Лекция 3 Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ
Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ Галогены. Строение атомов фтора и хлора
Галогены. Строение атомов фтора и хлора Органическая химия
Органическая химия Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1 Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию Единый государственный экзамен Химия 2021. Задание 3
Единый государственный экзамен Химия 2021. Задание 3 Водородная связь
Водородная связь Металлы подгруппы железа Fe, Co, Ni
Металлы подгруппы железа Fe, Co, Ni Бензин: догадкии реальность
Бензин: догадкии реальность