Содержание
- 2. 1.Общая характеристика алкадиенов. Алкадиены, как следует из их названия, представляют собой ненасыщенные углеводороды, содержащие в своем
- 3. Возможны три разных способа взаиморасположения двойных связей в диеновом углеводороде относительно друг друга: 1). Двойные связи
- 4. 2). Двойные связи разделены более чем одной одинарной связью (σ –связями): СН2=СН-СН2-СН=СН2 Такие алкадиены носят название
- 5. 3). Если двойные связи разделены в цепи только одной σ-связью, то их называют сопряженными. В этом
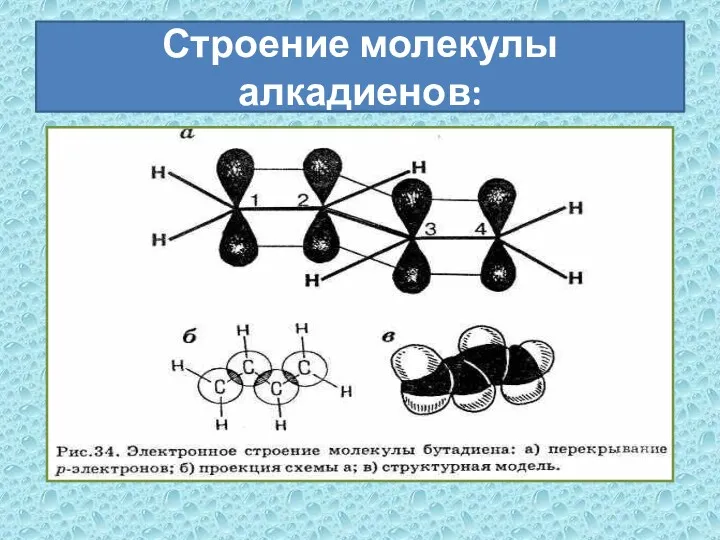
- 6. Строение молекулы алкадиенов:
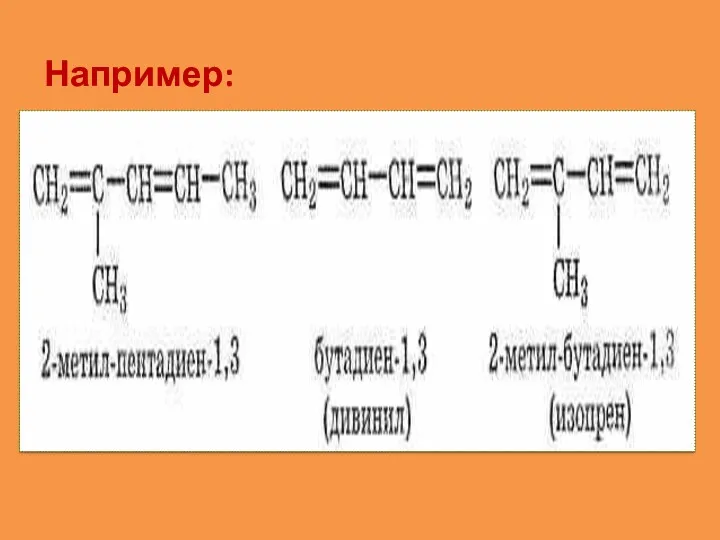
- 7. Номенклатура О наличии двойных связей в молекуле алкадиена говорит суффикс – диен. Для указания положения двойной
- 8. Например:
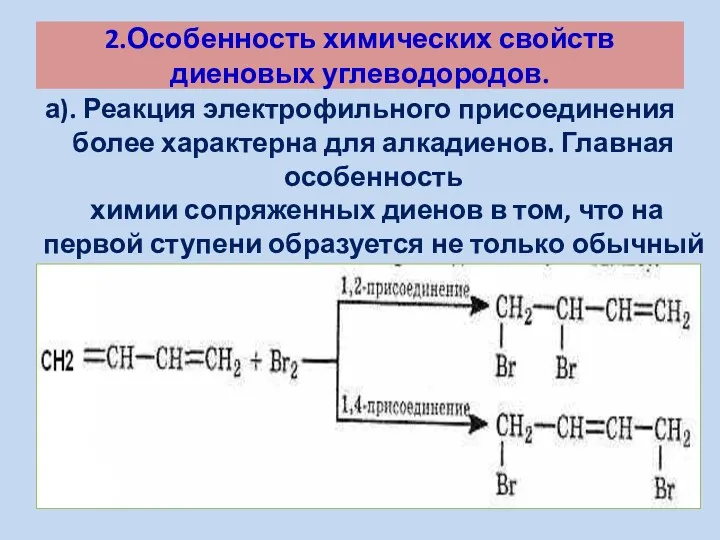
- 9. 2.Особенность химических свойств диеновых углеводородов. а). Реакция электрофильного присоединения более характерна для алкадиенов. Главная особенность химии
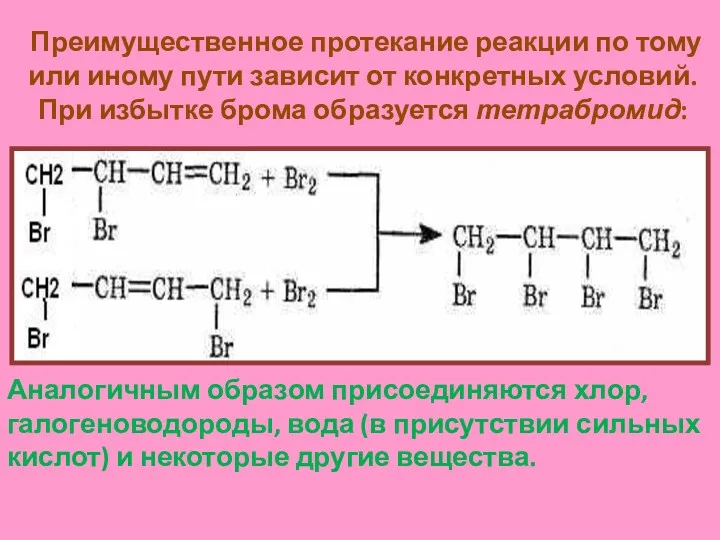
- 10. Преимущественное протекание реакции по тому или иному пути зависит от конкретных условий. При избытке брома образуется
- 11. б). Реакция полимеризация диеновых углеводородов Реакция полимеризации лежит в основе синтеза каучуков: nСН2 = СН –
- 12. 3.Синтетический и натуральный каучуки. Синтез каучука по методу С.В.Лебедева Получение синтетического каучука — основная область применения
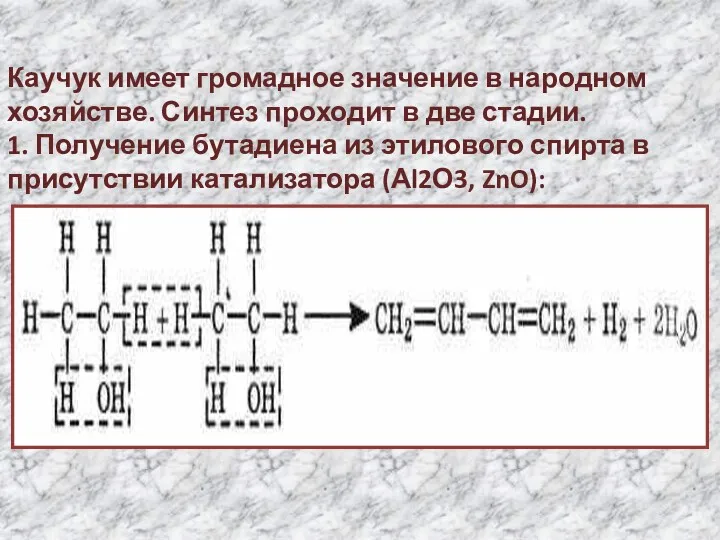
- 13. Каучук имеет громадное значение в народном хозяйстве. Синтез проходит в две стадии. 1. Получение бутадиена из
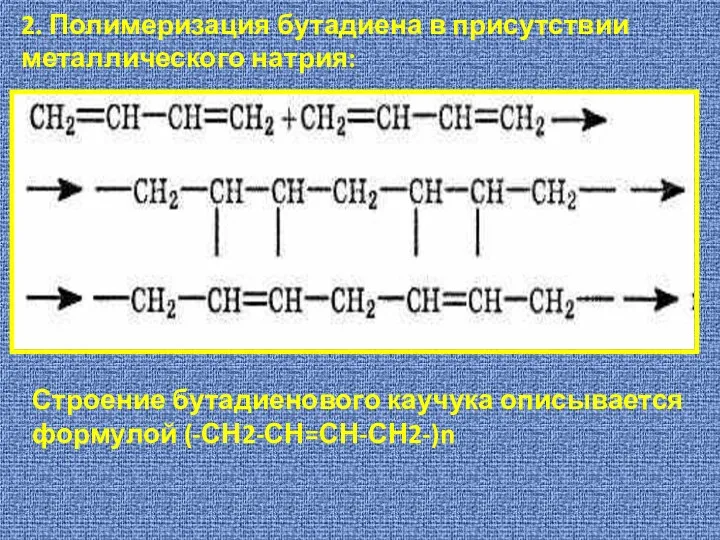
- 14. 2. Полимеризация бутадиена в присутствии металлического натрия: Строение бутадиенового каучука описывается формулой (-СН2-СН=СН-СН2-)n
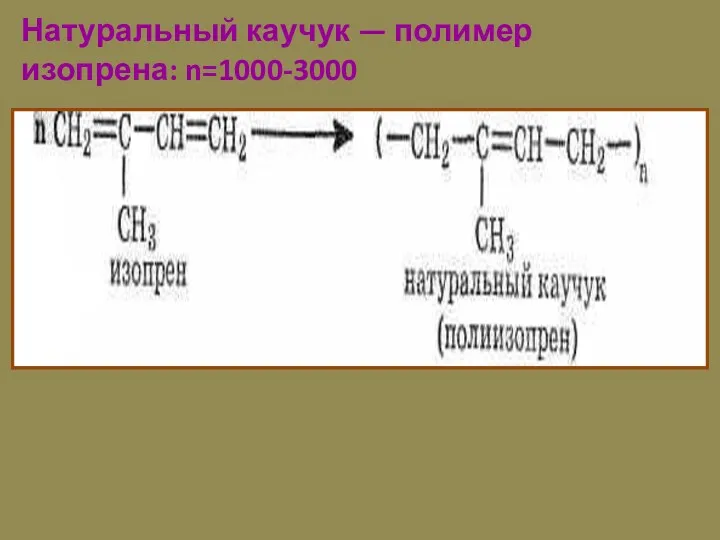
- 15. Натуральный каучук — полимер изопрена: n=1000-3000
- 16. Современные методы синтеза каучука. Сырьём для синтетического каучука чаще всего служат предельные углеводороды, которые содер- жатся
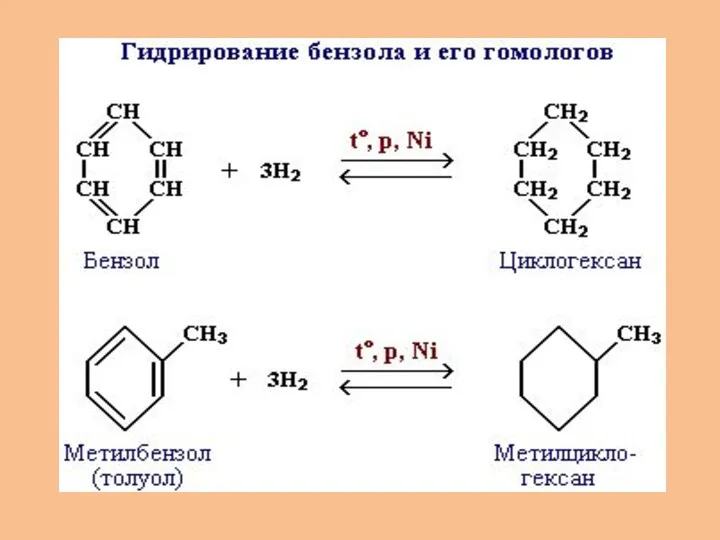
- 17. 4.Циклоалканы. Циклоалканы (циклопарафины, полиметилены, цикланы), насыщенные (предельные) моноциклические углеводороды, состоящие из метиле- нывых групп (-СН2-), соединённых
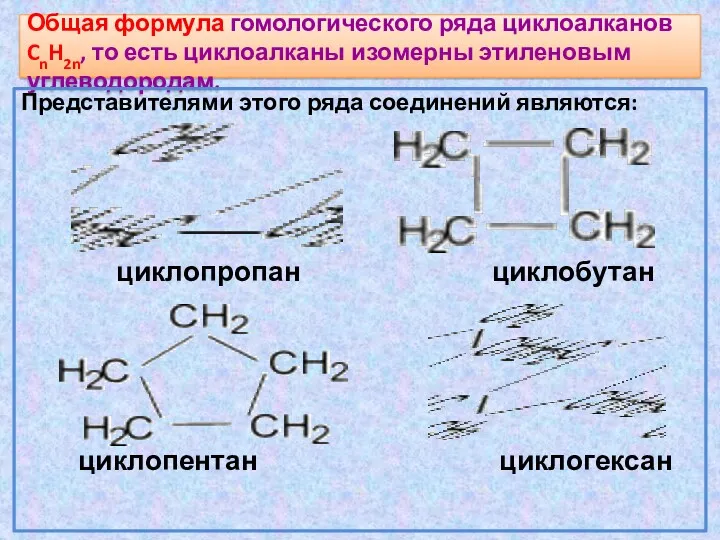
- 18. Общая формула гомологического ряда циклоалканов CnH2n, то есть циклоалканы изомерны этиленовым углеводородам. Представителями этого ряда соединений
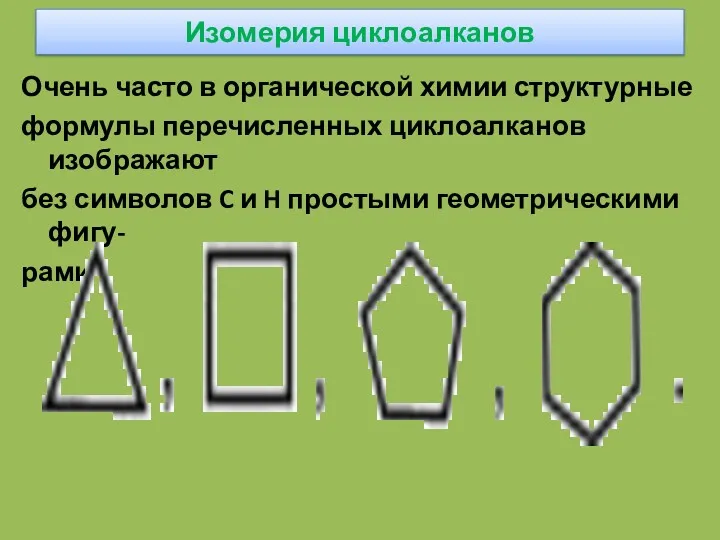
- 19. Изомерия циклоалканов Очень часто в органической химии структурные формулы перечисленных циклоалканов изображают без символов C и
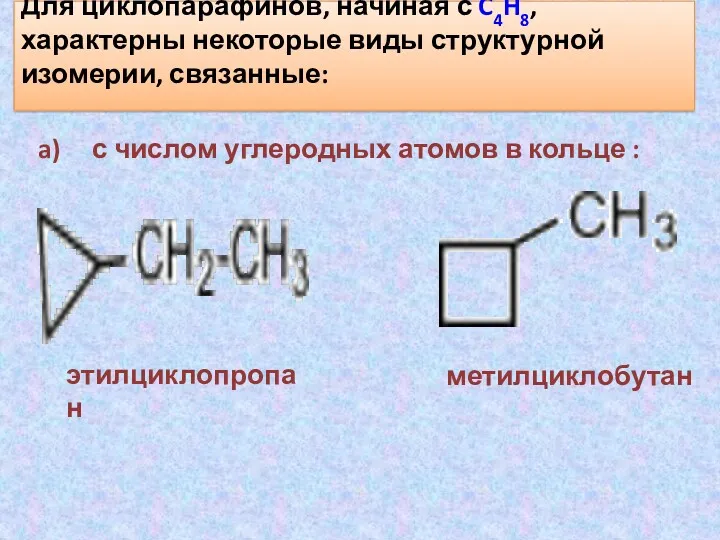
- 20. Для циклопарафинов, начиная с C4H8, характерны некоторые виды структурной изомерии, связанные: a) с числом углеродных атомов
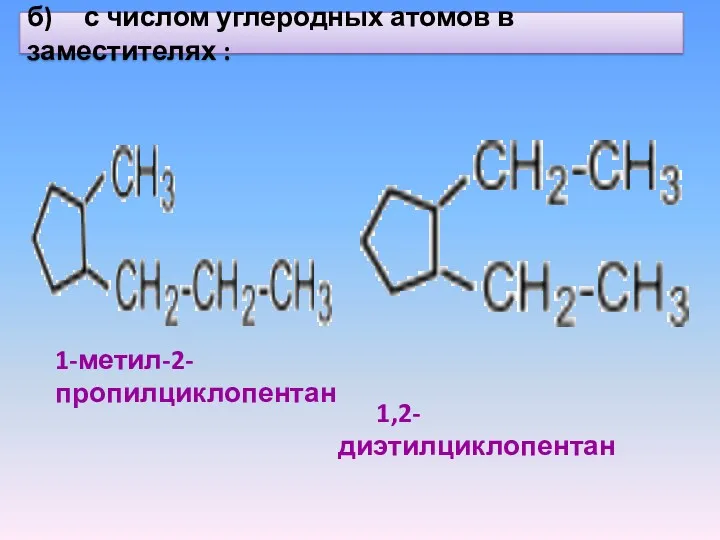
- 21. б) с числом углеродных атомов в заместителях : 1-метил-2-пропилциклопентан 1,2-диэтилциклопентан
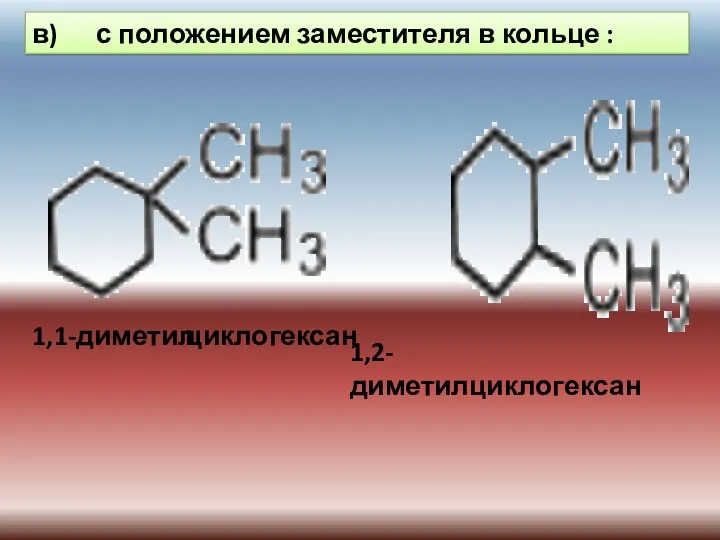
- 22. в) с положением заместителя в кольце : 1,1-диметил 1,2-диметилциклогексан циклогексан
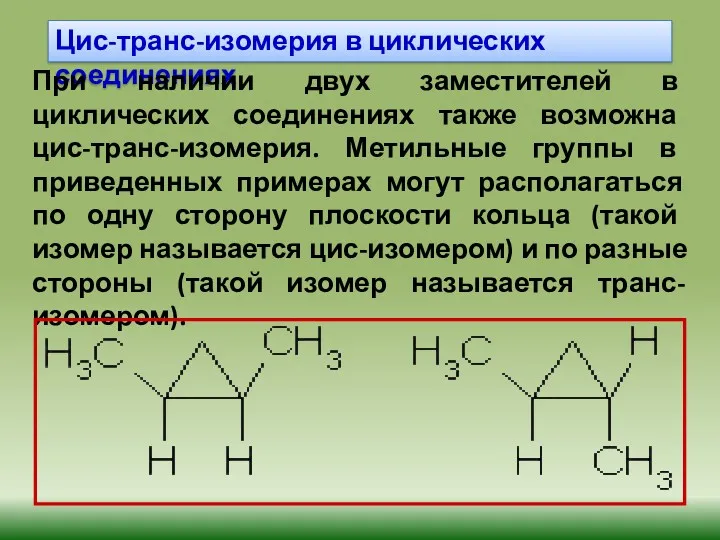
- 23. Цис-транс-изомерия в циклических соединениях При наличии двух заместителей в циклических соединениях также возможна цис-транс-изомерия. Метильные группы
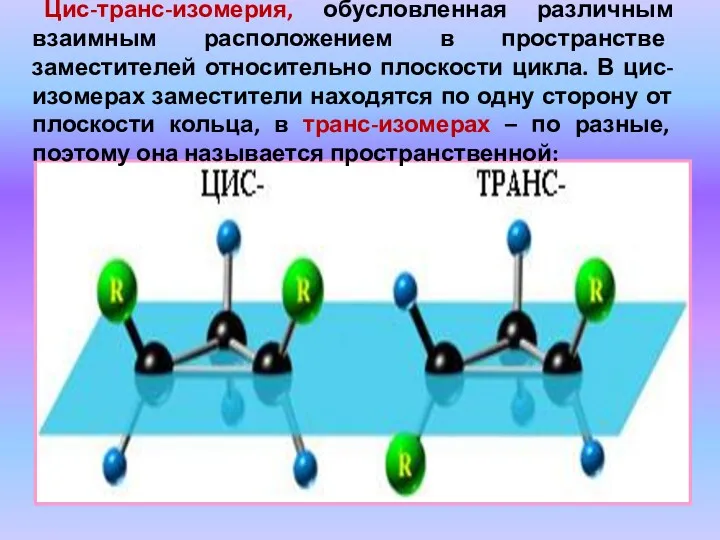
- 24. Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости цикла. В цис-изомерах заместители находятся по
- 25. Синтез циклоалканов 1. При переработке нефти выделяют главным образом циклоалканы С5 - С7. 2. Действие активных
- 27. Физические свойства циклоалканов закономерно изменяются с ростом их молекулярной массы. Пpи ноpмальных условиях циклопpопан и циклобутан
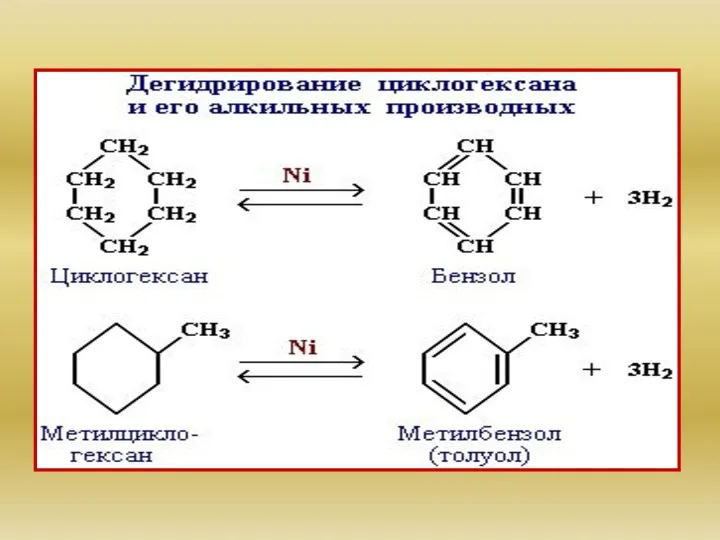
- 28. Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость. Трех- и четырехчленные циклы (малые
- 29. Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому
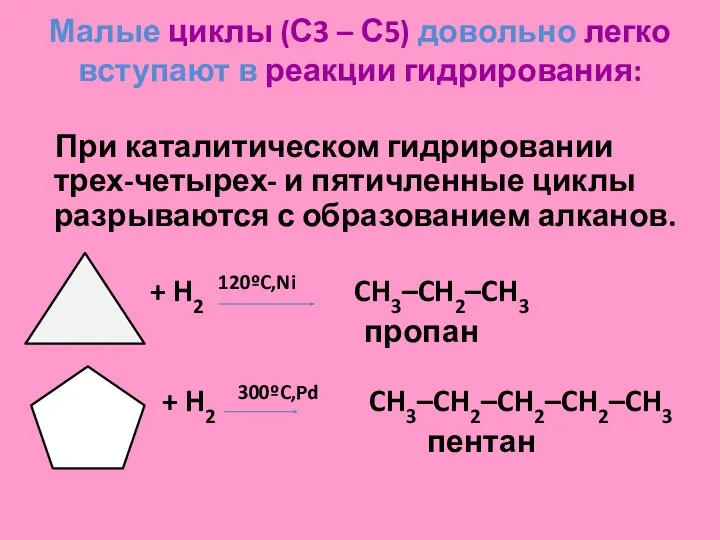
- 30. Малые циклы (С3 – С5) довольно легко вступают в реакции гидрирования: При каталитическом гидрировании трех-четырех- и
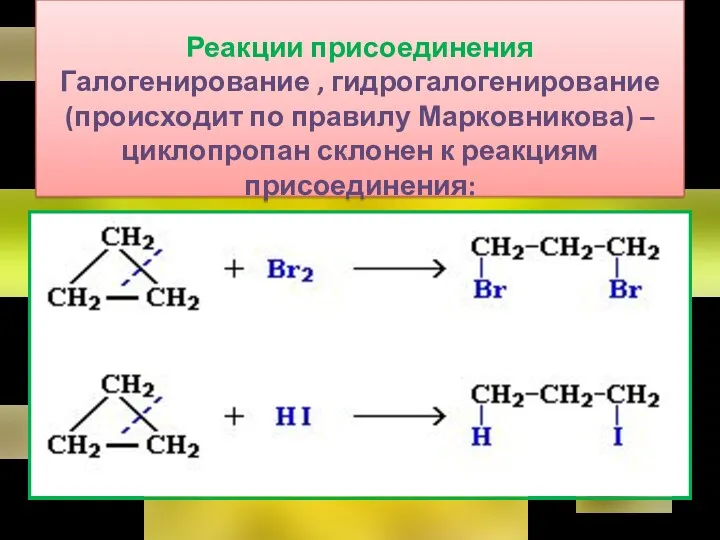
- 31. Реакции присоединения Галогенирование , гидрогалогенирование (происходит по правилу Марковникова) – циклопропан склонен к реакциям присоединения:
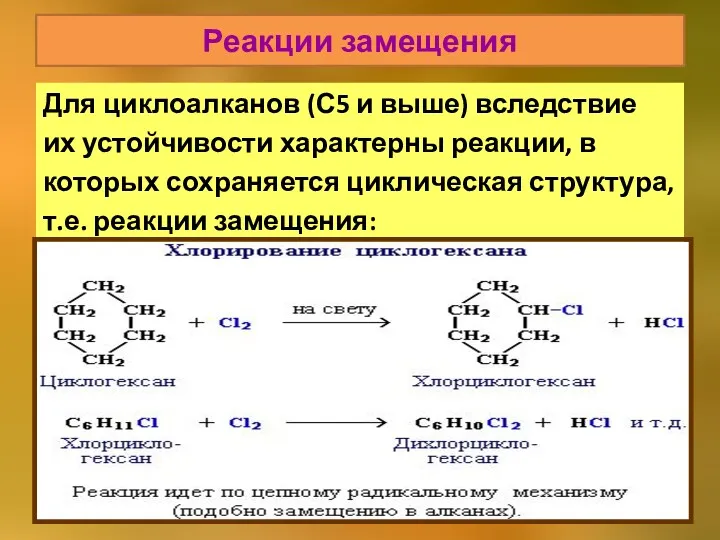
- 32. Реакции замещения Для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая
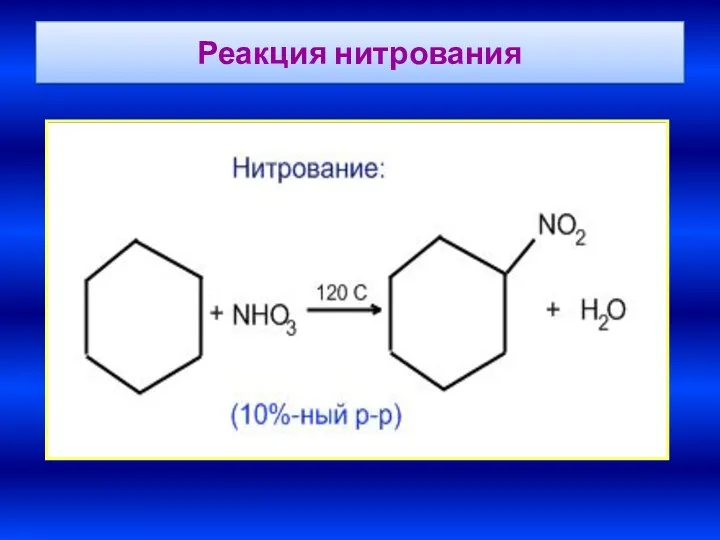
- 33. Реакция нитрования
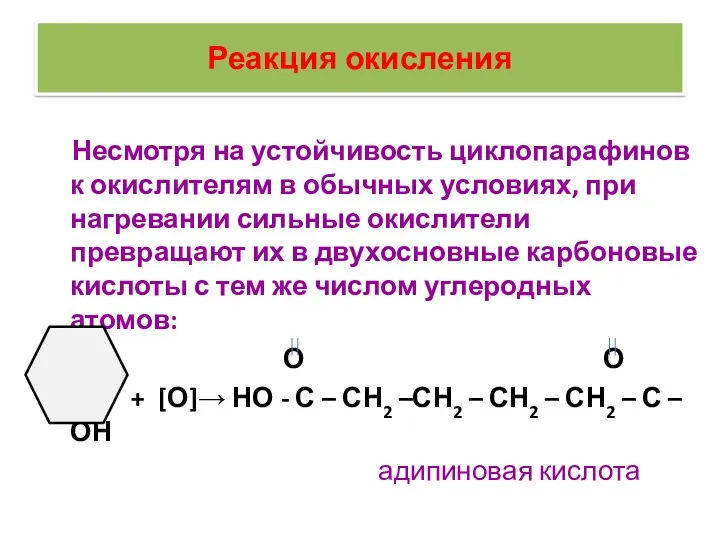
- 35. Реакция окисления Несмотря на устойчивость циклопарафинов к окислителям в обычных условиях, при нагревании сильные окислители превращают
- 36. Применение, значение для человека Циклоалканы широко распространены в природе, они входят в состав нефти. В нефтехимической
- 38. Скачать презентацию














 Удивительные свойства воды
Удивительные свойства воды Electronică aplicată. (Curs 2)
Electronică aplicată. (Curs 2) Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2) 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Железо и его соединения
Железо и его соединения Химические превращения веществ
Химические превращения веществ Белки. Функции белков
Белки. Функции белков Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Значення хімічних процесів у природі
Значення хімічних процесів у природі Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Реакции ионного обмена
Реакции ионного обмена Жиры. Мыла. 10 класс
Жиры. Мыла. 10 класс Группа редкоземельных элементов
Группа редкоземельных элементов Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Железо
Железо Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)