Слайд 2

Задание 3. Электроотрицательность. Степень окисления и валентность химических элементов.
Примерное время выполнения
задания – 2 - 3 минуты
Уровень сложности задания – базовый
Максимальный балл за выполнение задания - 1
Задание № 3 рассчитано на проверку знаний по теме «Электроотрицательность. Степень окисления и валентность химических элементов».
Задание содержит пять химических элементов, из которых необходимо выбрать два согласно формулировке задания. В ответе надо записать цифры, под которыми указаны выбранные элементы.
Слайд 3

Перед выполнением предложенных заданий повторите:
Степень окисления – это условная величина, численно
равная количеству электронов, которое отдает атом, приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Степень окисления обозначается арабскими цифрами, может быть отрицательной или положительной.
Слайд 4

Правила расчета степени окисления
Степень окисления элементов в простых веществах всегда равна
0.
Сумма всех степеней окисления в молекуле равна 0, а в ионе – заряду иона.
Фтор (как самый электроотрицательный элемент) всегда проявляет степень окисления -1.
Кислород почти всегда проявляет степень окисления -2, кроме соединений с фтором, например O2+1F2, O+2F2, а также пероксидов Н2О2-1 и супероксидов КО2-1/2.
Металлы проявляют положительные степени окисления. Металлы IА группы имеют постоянную степень окисления +1, металлы IIА группы - +2, металлы IIIА группы - +3. У металлов побочных подгрупп нет постоянной степени окисления.
Слайд 5

Правила расчета степени окисления
Степени окисления неметаллов зависят от того, с какими
атомами они соединены:
если только с атомом металла, то степень окисления неметалла отрицательная (например, сульфиды металлов: Na2+1S-2);
если с атомом неметалла, то степень окисления может быть и положительная, и отрицательная – это зависит от электроотрицательности атомов элементов, входящих в соединение. Например, в сероводороде H2+1S-2 сера более электроотрицательна по сравнению с водородом, а в соединении с кислородом S+2O3-2 менее электроотрицательна.
Водород чаще всего проявляет степень окисления +1, кроме гидридов металлов, где степень окисления равна -1, например, Na+1H-1.
Максимальна степень окисления для неметаллов IА – VIIIА подгрупп (кроме кислорода и фтора) равна номеру группы, минимальная степень окисления для этих элементов рассчитывается по формуле: номер группы минус 8.
Для металлов минимальная степень окисления – 0.
Слайд 6
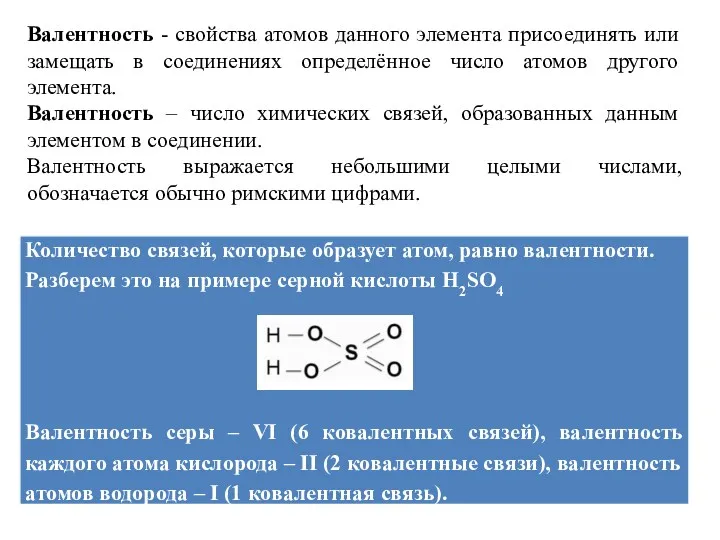
Валентность - свойства атомов данного элемента присоединять или замещать в соединениях
определённое число атомов другого элемента.
Валентность – число химических связей, образованных данным элементом в соединении.
Валентность выражается небольшими целыми числами, обозначается обычно римскими цифрами.
Слайд 7
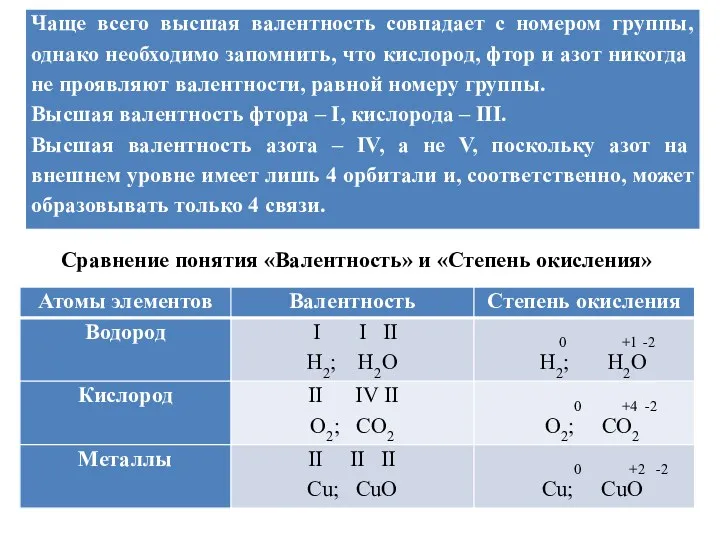
Сравнение понятия «Валентность» и «Степень окисления»
Слайд 8

Элементы с неизменными (постоянными) степенями окисления
Слайд 9

Химические элементы, номер группы которых не совпадает с их высшей степенью
окисления
Слайд 10
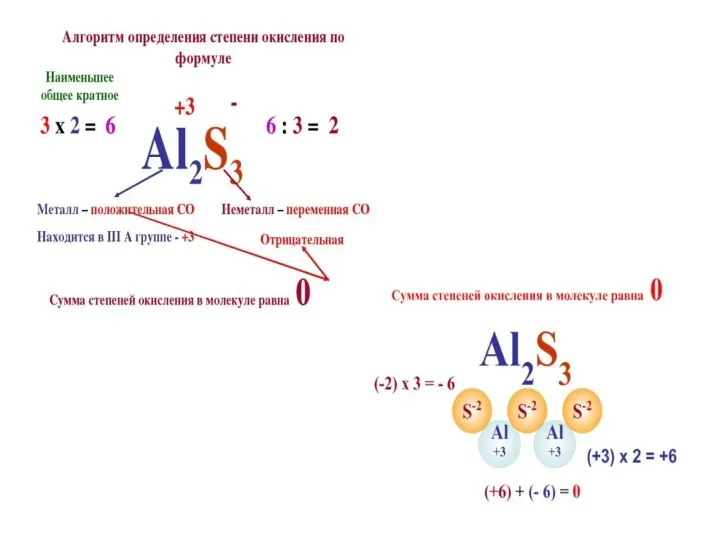
Слайд 11

Слайд 12












 Хімічні формули речовин
Хімічні формули речовин Водород
Водород Химиялық қауіптілер. Нитраттар
Химиялық қауіптілер. Нитраттар Кислоты в свете теории электролитической диссоциации (ТЭД)
Кислоты в свете теории электролитической диссоциации (ТЭД) Кристаллическое строение и свойства металлов
Кристаллическое строение и свойства металлов Материаловедение промышленного производства. Особенности строения твердых тел
Материаловедение промышленного производства. Особенности строения твердых тел Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника
Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника Химия в Великую Отечественную войну
Химия в Великую Отечественную войну Массовая доля вещества в растворе
Массовая доля вещества в растворе Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Современные химические технологии
Современные химические технологии Каталитический риформинг
Каталитический риформинг Получение, собирание, распознавание газов. (Практическая работа 2)
Получение, собирание, распознавание газов. (Практическая работа 2) Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Простые вещества
Простые вещества Незвичайна вода
Незвичайна вода Фазовое равновесие
Фазовое равновесие Химия в повседневной жизни человека
Химия в повседневной жизни человека Химическая очистка сточных вод. Окисление и восстановление
Химическая очистка сточных вод. Окисление и восстановление Растворы: состав и их коллигативные свойства
Растворы: состав и их коллигативные свойства Щелочные и щелочноземельные металлы
Щелочные и щелочноземельные металлы Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Химические свойства карбокатионов
Химические свойства карбокатионов Тіршілік процесіне қатысатын гетерофункционалды қосылыстар
Тіршілік процесіне қатысатын гетерофункционалды қосылыстар Скорость химических реакций
Скорость химических реакций