Содержание
- 3. Материаловедением называют науку, изучающую взаимосвязь между составом, строением и свойствами материалов. Современную промышленность характеризуют непрерывно растущая
- 4. История науки Впервые существование связи между строением стали, и ее свойствами было установлено П.П.Аносовым (1799—1851 гг.).
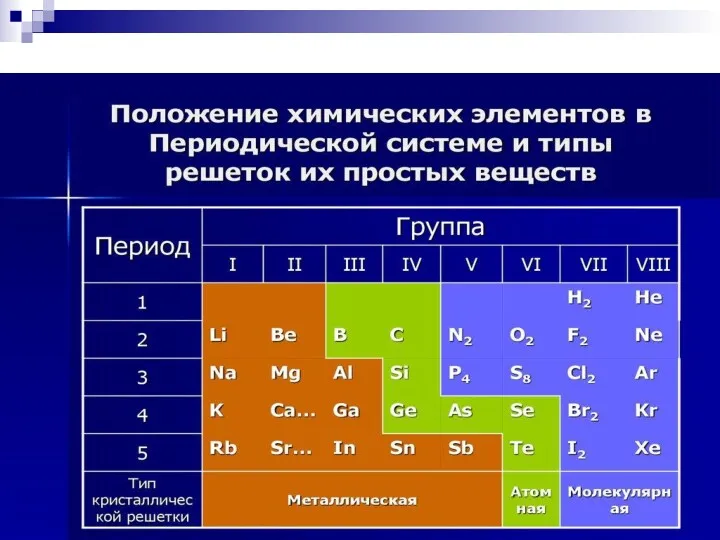
- 5. Все металлы и сплавы принято делить на две группы: Железо и сплавы на его основе (сталь,
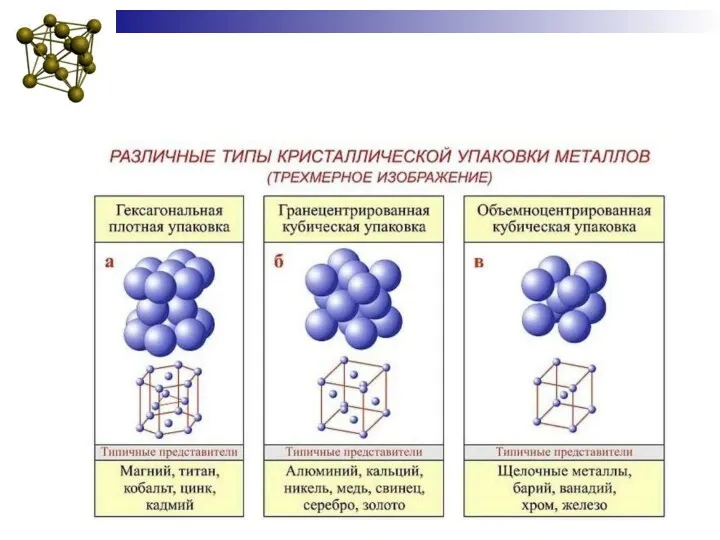
- 6. Строение металлических материалов Атомы в металле в определенном порядке и располагаются на расстояниях друг от друга,
- 7. Жирными линиями выделен наименьший параллелепипед (кристалл), последовательным перемещением которого в пространстве вдоль трех осей может быть
- 8. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Кристаллы Анизотропия и симметрия физических свойств являются наиболее характерными особенностями кристаллов, обусловленными
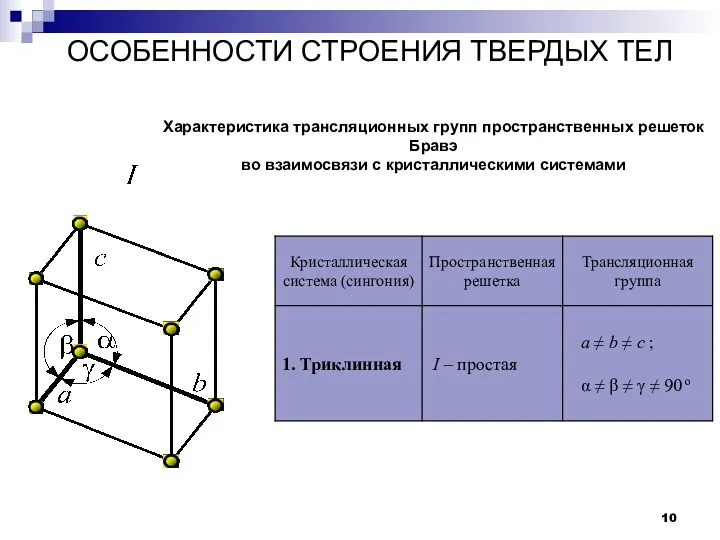
- 10. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Кристаллы Характеристика трансляционных групп пространственных решеток Бравэ во взаимосвязи с кристаллическими системами
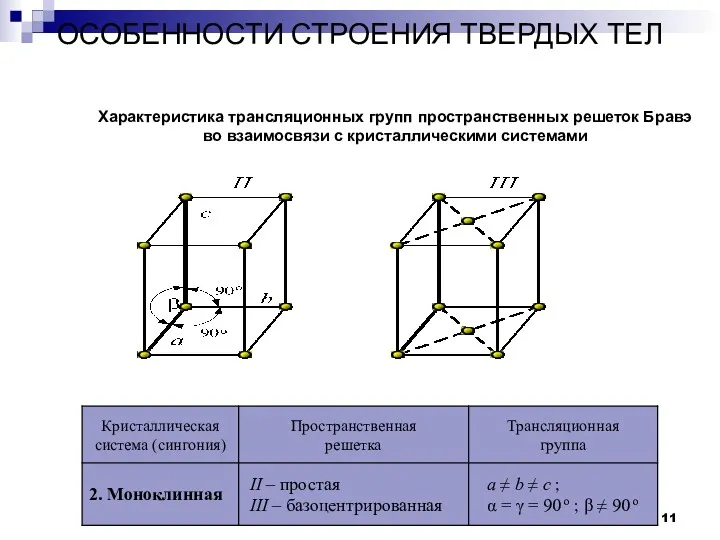
- 11. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Кристаллы Характеристика трансляционных групп пространственных решеток Бравэ во взаимосвязи с кристаллическими системами
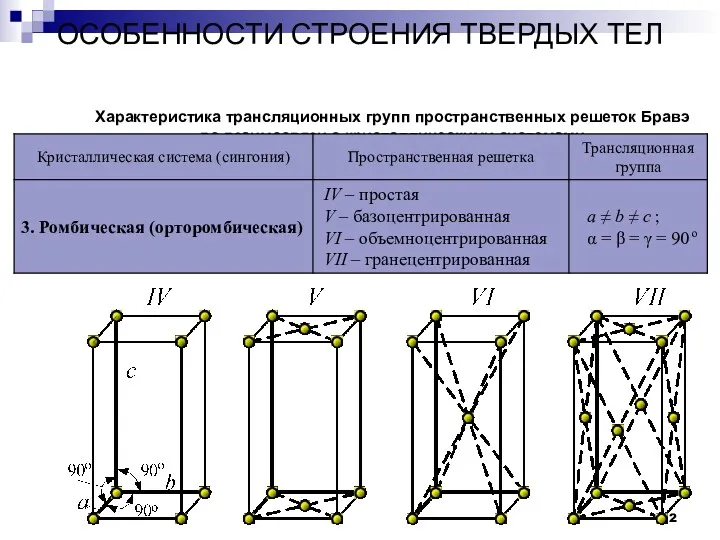
- 12. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Кристаллы Характеристика трансляционных групп пространственных решеток Бравэ во взаимосвязи с кристаллическими системами
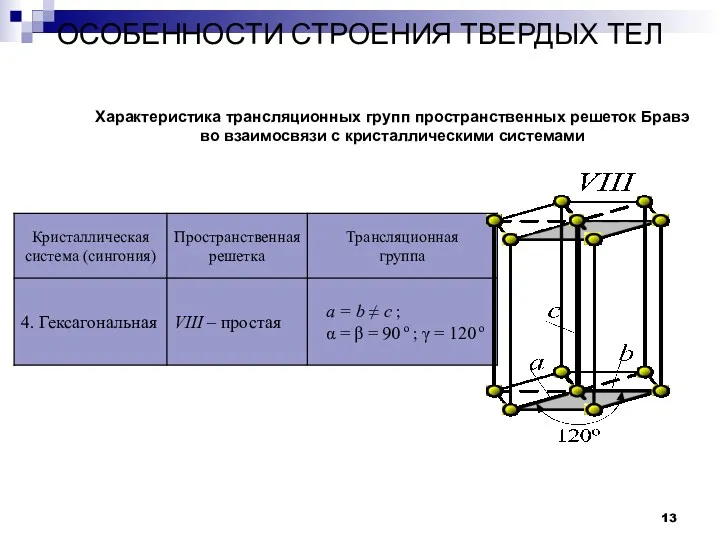
- 13. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Кристаллы Характеристика трансляционных групп пространственных решеток Бравэ во взаимосвязи с кристаллическими системами
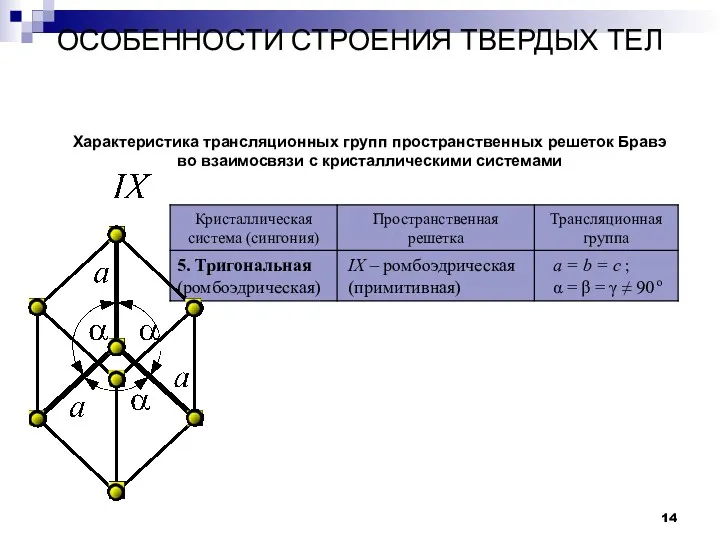
- 14. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Кристаллы Характеристика трансляционных групп пространственных решеток Бравэ во взаимосвязи с кристаллическими системами
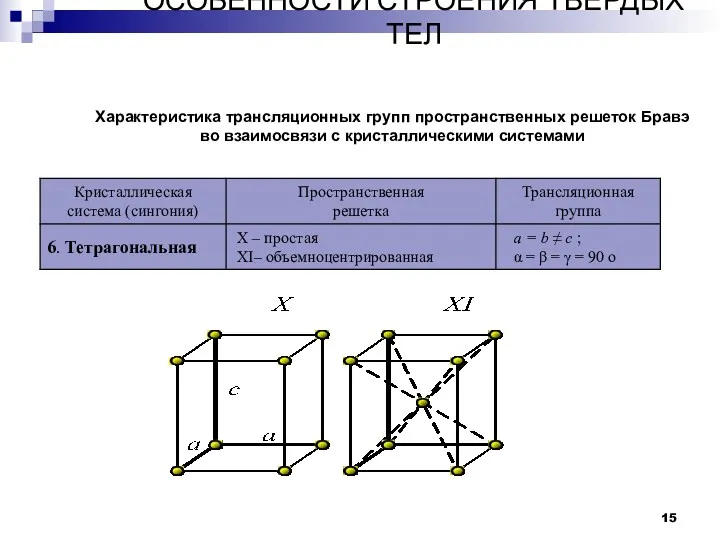
- 15. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Кристаллы Характеристика трансляционных групп пространственных решеток Бравэ во взаимосвязи с кристаллическими системами
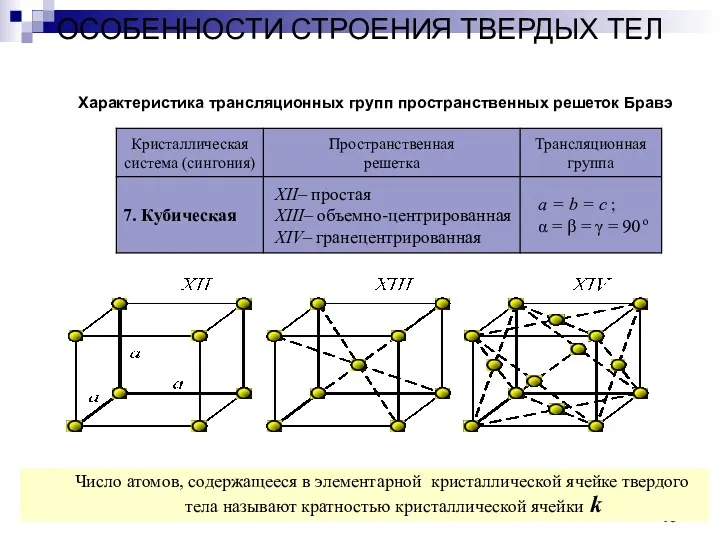
- 16. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Кристаллы Характеристика трансляционных групп пространственных решеток Бравэ Число атомов, содержащееся в элементарной
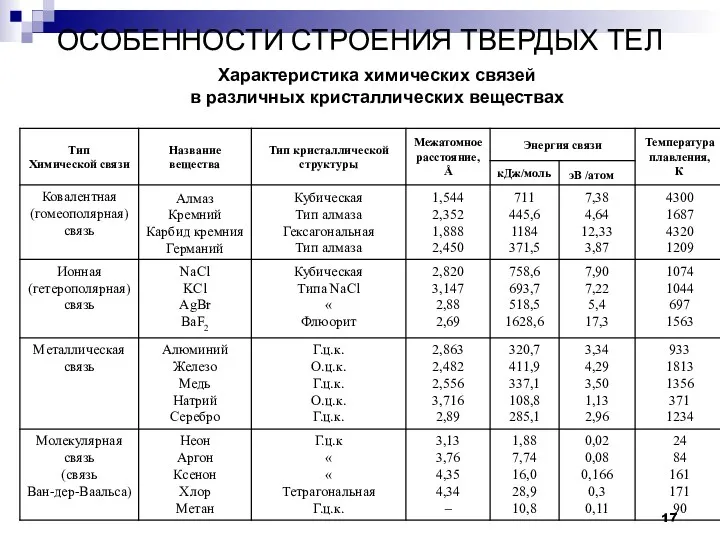
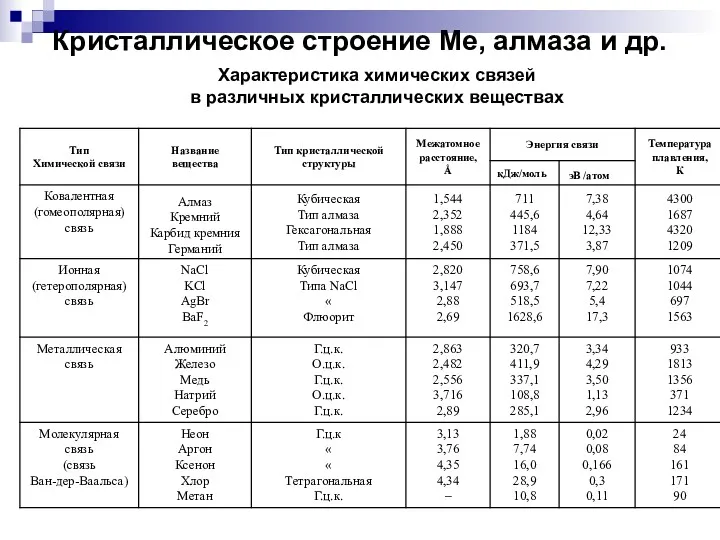
- 17. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Характеристика химических связей в различных кристаллических веществах
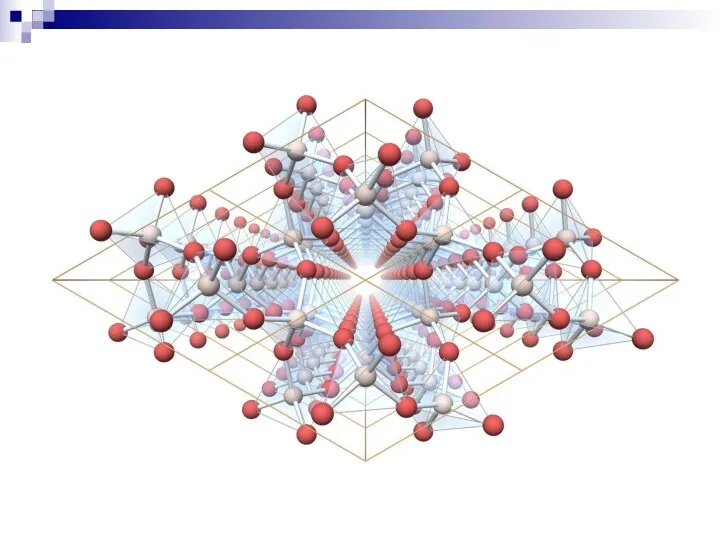
- 18. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Кристаллы Кристаллические материалы могут существовать как в форме крупных монокристаллов или достаточно
- 19. Реальный кристалл отличается от идеального наличием различных структурных несовершенств - дефектов, которые могут быть точечными, линейными,
- 20. Реальное твердое тело имеет поликристаллическое строение, т.е. состоит из множества кристаллов, соприкасающихся между собой. Отдельные кристаллы,
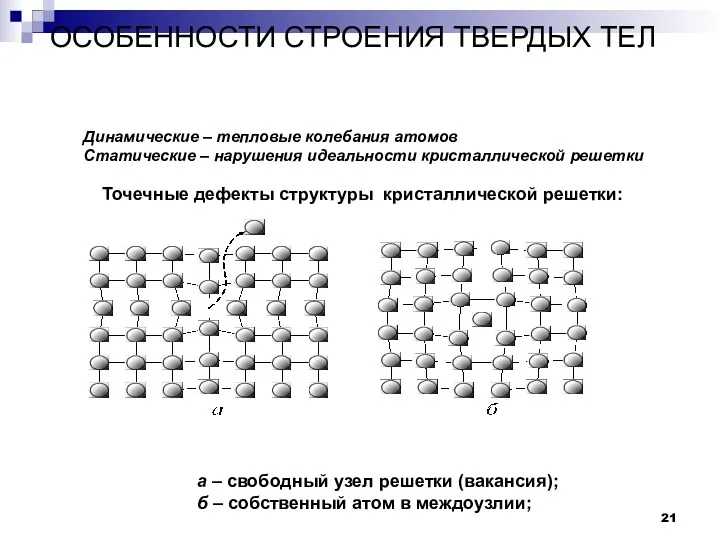
- 21. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Дефекты в строении твердых тел. а – свободный узел решетки (вакансия); б
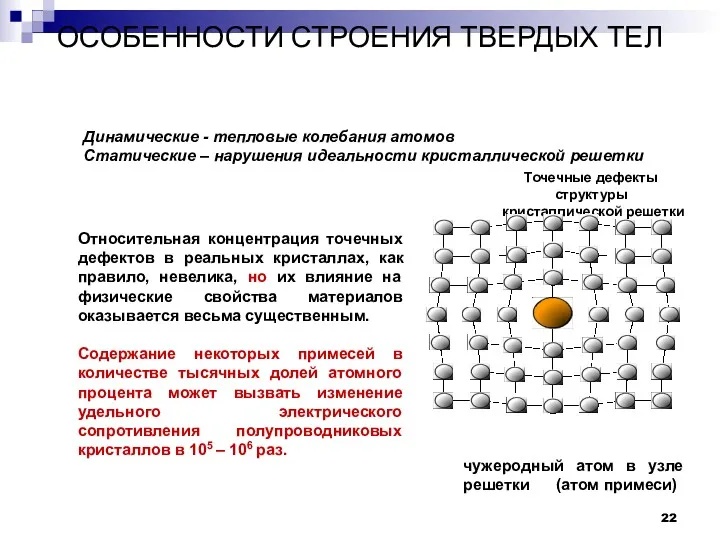
- 22. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Дефекты в строении твердых тел. чужеродный атом в узле решетки (атом примеси)
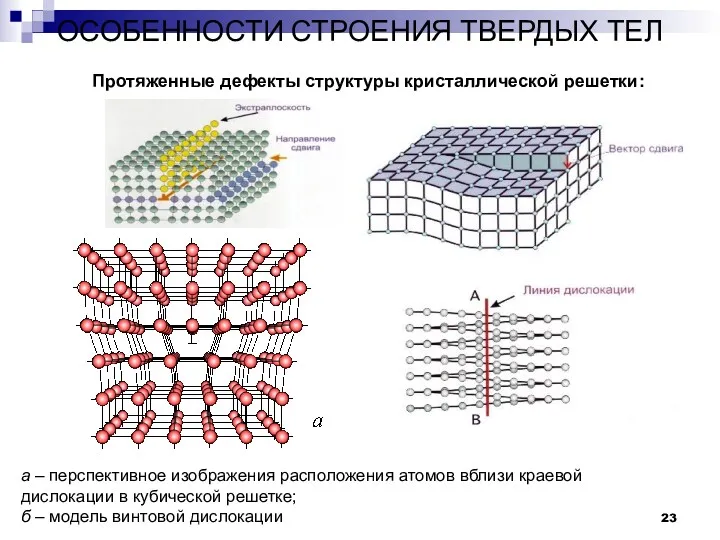
- 23. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Дефекты в строении твердых тел. Протяженные дефекты структуры кристаллической решетки: а –
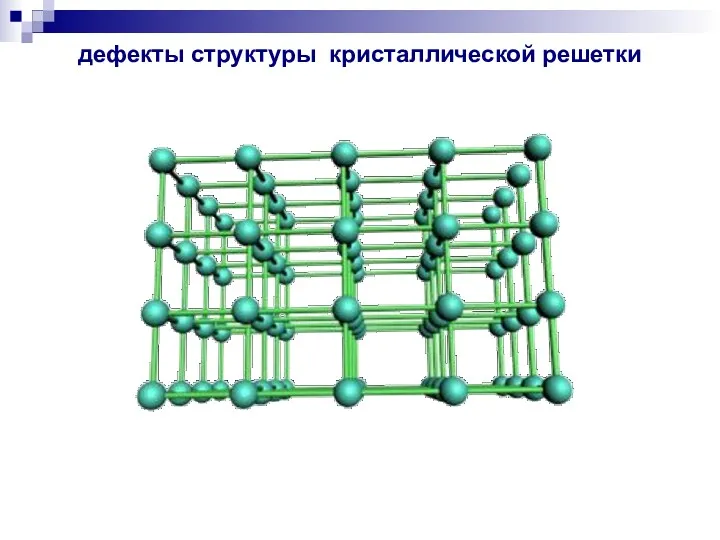
- 24. дефекты структуры кристаллической решетки
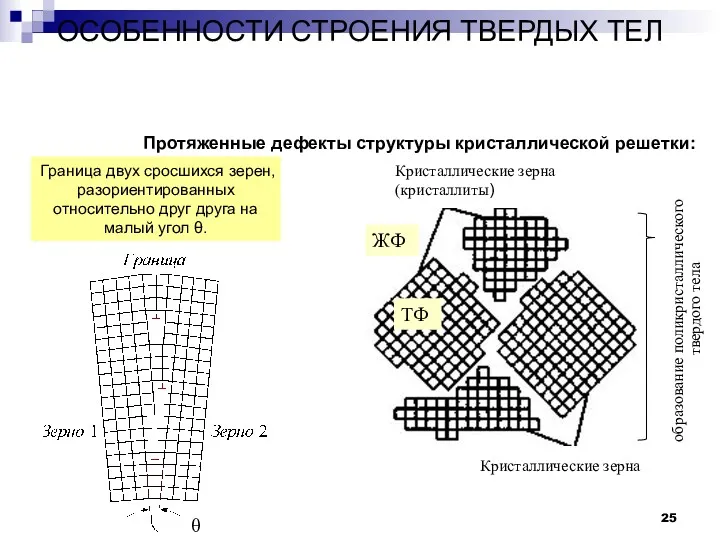
- 25. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Дефекты в строении твердых тел. Протяженные дефекты структуры кристаллической решетки: Кристаллические зерна
- 26. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Полиморфизм (аллотропия) Полиморфизм – способность твердых веществ образовывать две и более кристаллические
- 27. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Полиморфизм Примером полиморфизма является низкотемпературное превращение белого олова (β-Sn) в серое (α-Sn),
- 28. ОСОБЕННОСТИ СТРОЕНИЯ ТВЕРДЫХ ТЕЛ Стекла и аморфные тела Твердые тела, которые характеризуются случайным хаотичным расположением частиц,
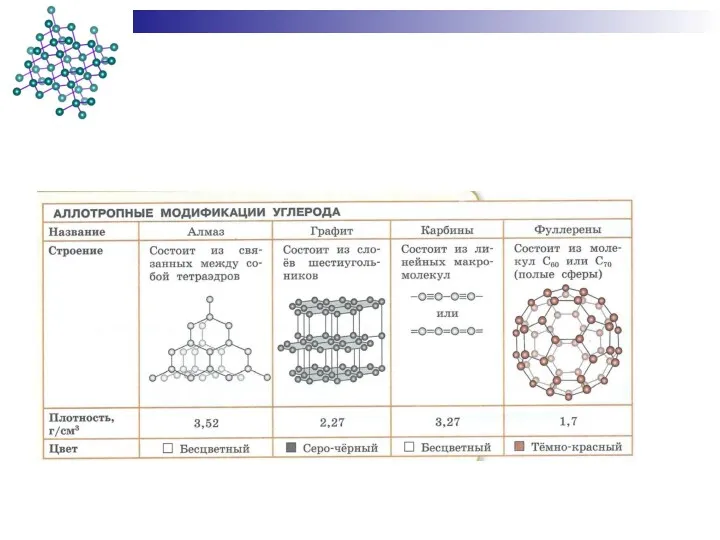
- 29. Полиморфизм (аллотропия) Аллотро́пия (от др.-греч. ἄλλος — «другой», τρόπος — «поворот, свойство») — существование двух и
- 30. Примеры аллотропии В настоящее время известно более 400 разновидностей простых веществ. Способность элемента к образованию аллотропных
- 31. Аллотропия металлов Существуют среди металлов, которые встречаются в природе в больших количествах (до U, без Tc
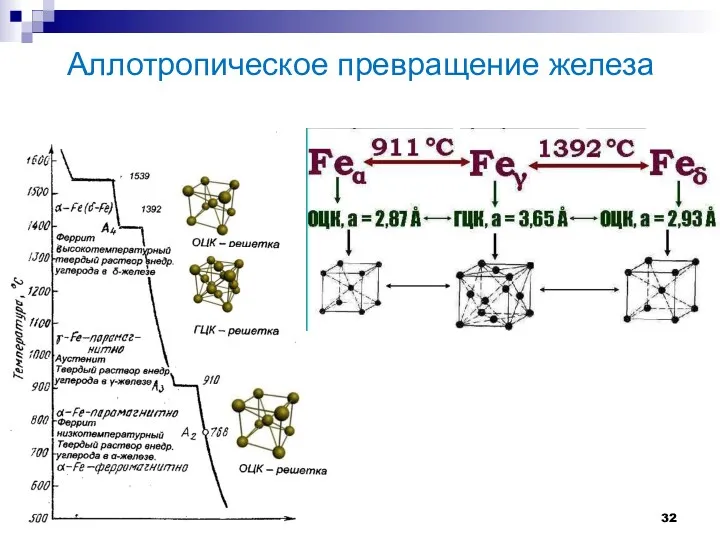
- 32. Аллотропическое превращение железа
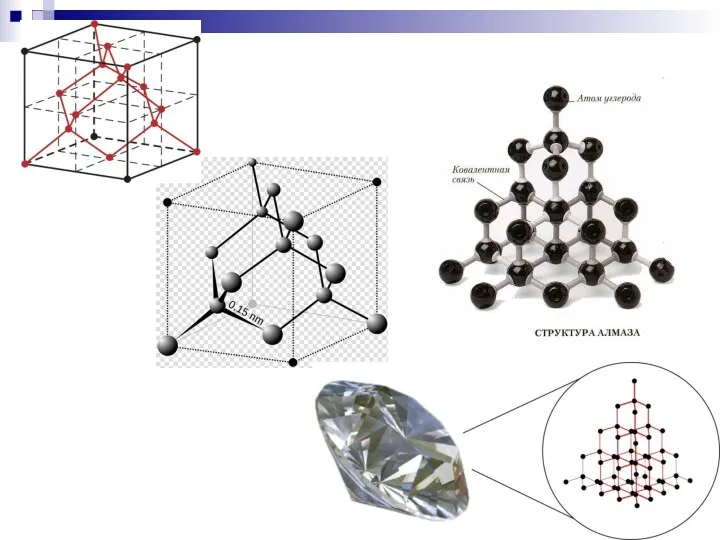
- 33. Кристаллическое строение Ме, алмаза и др. Характеристика химических связей в различных кристаллических веществах
- 38. Переходы аллотропии Энантиотропный переход - переход одной аллотропной модификации в другую происходит при изменении температуры или
- 40. Скачать презентацию

















 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей