Содержание
- 2. Скорость химической реакции – изменение концентрации вещества в единицу времени υ - СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ ∆С
- 3. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ ЗАВИСИТ: а) от концентрации исходных веществ (закон действующих масс) скорость химической реакции прямо
- 4. FeCl2 (р-р)+2NaOH(р-р) →Fe(OH)2↓+2NaCl υ=k ∙C1(FeCl2)∙C2(NaOH)
- 5. КАК ИЗМЕНИТСЯ СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ ПРИ ИЗМЕНЕНИИ ВСЕХ КОНЦЕНТРАЦИЙ В 2 РАЗА υ=k ∙2C1(FeCl2)∙(2C(NaOH))2= 8 k
- 6. Пример 2 Fe(т) +2HCl(р-р) →H2+FeCl2 υ=k ∙C2(HCl) Пример 3 2H2(г) + O2(г) → 2H2O υ=k ∙P2(H2)∙C(O2)
- 7. Б) ОТ ТЕМПЕРАТУРЫ ( T) Правило Вант-Гоффа: При повышении температуры на каждые 10°, скорость химической реакции
- 8. УРАВНЕНИЕ ВАНТ ГОФФА СКОРОСТЬ РЕАКЦИИ ОБРАТНО ПРОПОРЦИОНАЛЬНА ВРЕМЕНИ ПРОТЕКАНИЯ РЕАКЦИИ.
- 11. В) ОТ КАТАЛИЗАТОРА
- 12. Г) ОТ ПЛОЩАДИ СОПРИКОСНОВЕНИЯ ВЕЩЕСТВ (ОТ СТЕПЕНИ ДИСПЕРСНОСТИ (ИЗМЕЛЬЧЕННОСТИ) РЕАГИРУЮЩИХ ВЕЩЕСТВ). Реакции в газах и растворах
- 14. Скачать презентацию


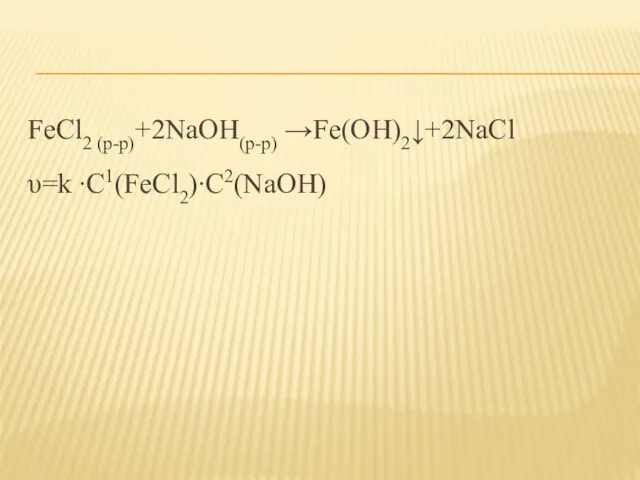








 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Соединения щелочных металлов
Соединения щелочных металлов Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою Алканы
Алканы Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Предельные углеводороды
Предельные углеводороды Комплесные соединения
Комплесные соединения Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты
Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Алюминий и его соединения
Алюминий и его соединения Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Азотистые гетероциклические соединения
Азотистые гетероциклические соединения Формы минералов и их агрегатов
Формы минералов и их агрегатов Химические свойства металлов
Химические свойства металлов Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Угарный газ
Угарный газ Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Ферум та його сполуки
Ферум та його сполуки Аминокислоты. Белки
Аминокислоты. Белки