Содержание
- 2. Свободные радикалы в тропосфере Гидроксидный радикал (OH): - при химических превращениях с участием синглетно возбужденного атома
- 3. - при протекании других реакций: HNO2 → NO + OH, λ H2O2 → 2OH, λ Свободные
- 4. Свободные радикалы в тропосфере ОН-радикал взаимодействует с оксидом углерода, метаном и оксидом азота: CO + OH
- 5. Свободные радикалы в тропосфере Образующийся водород может реагировать с кислородом с образованием гидропероксидного радикала (HO2) :
- 6. Свободные радикалы в тропосфере В результате реакции HO2 - радикала с оксидом азота или озоном получаем
- 7. Парниковый эффект Парниковые газы: водяной пар; углекислый газ; метан; фтор- и хлорсодержащие углеводороды; монооксид азота
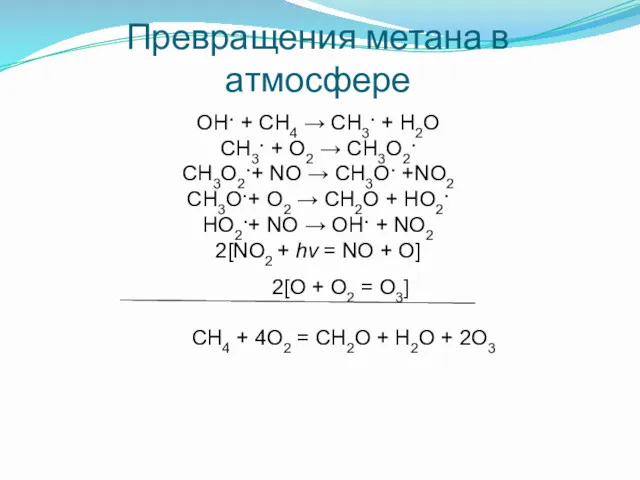
- 8. Превращения метана в атмосфере OH· + CH4 → CH3· + H2O CH3· + O2 → CH3O2·
- 9. Превращения метана в атмосфере CH2O + hν → H2 + CO· (1) CH2O + hν →
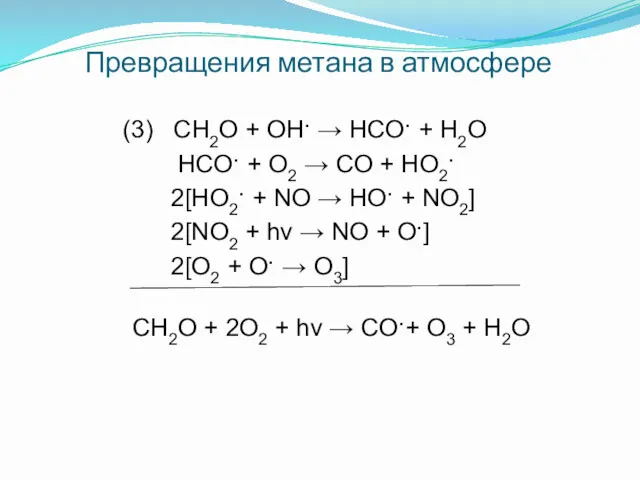
- 10. Превращения метана в атмосфере (3) CH2O + OH· → HCO· + H2O HCO· + O2 →
- 11. Превращения метана в атмосфере CO + HO· → CO2 + H· H·+ O2 → HO2· 2[HO2·+
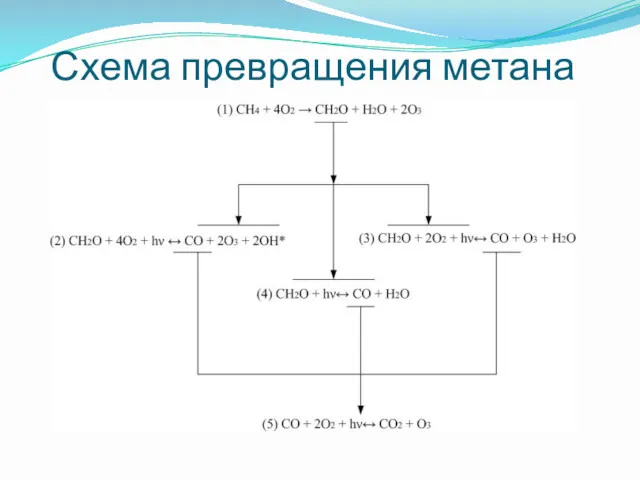
- 12. Схема превращения метана
- 13. Соединения серы в тропосфере Трансформация соединений серы Сероводород H2S H2S + OH → H2O + HS
- 14. Окисление диоксида серы в твердой фазе – на поверхности твердых частиц SO2 + CaO → CaSO3
- 15. Механизм образования кислотных дождей Механизм I: HO· + SO2 → HSO3 HSO3· + O2 → SO3
- 16. Механизм образования кислотных дождей Механизм III («дневной» механизм): OH+ + NO2 → HNO3 Механизм IV («ночной»
- 17. Соединения азота в тропосфере Общая формула – NOx NO, NO2, N2O, N2O, N2O3. N2O5 N2O +
- 18. Фотохимический смог Смог – это совокупность газообразных и твердых примесей в сочетании с туманом или аэрозольной
- 19. Химизм образования фотохимического смога оксиды азота + углеводороды → пероксиацетилнитрат (ПАН) + озон (O3) ультрафиолетовая радиация
- 20. С присутствием органических соединений в воздухе городов связаны и процессы образования высокотоксичных пероксидных соединений: R–C(O)–O–O–NO2 Пероксиацетилнитрат
- 21. Схема вероятного механизма образования фотохимического смога 1. Поглощение света: NO2 + hν → NO + O
- 22. Лондонский смог Смог лондонского типа — сочетание газообразных загрязнителей (в основном сернистого газа SO2), пылевых частиц
- 24. Скачать презентацию


















 Удивительные свойства воды
Удивительные свойства воды Electronică aplicată. (Curs 2)
Electronică aplicată. (Curs 2) Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2) 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Железо и его соединения
Железо и его соединения Химические превращения веществ
Химические превращения веществ Белки. Функции белков
Белки. Функции белков Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Значення хімічних процесів у природі
Значення хімічних процесів у природі Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Реакции ионного обмена
Реакции ионного обмена Жиры. Мыла. 10 класс
Жиры. Мыла. 10 класс Группа редкоземельных элементов
Группа редкоземельных элементов Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Железо
Железо Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)