Содержание
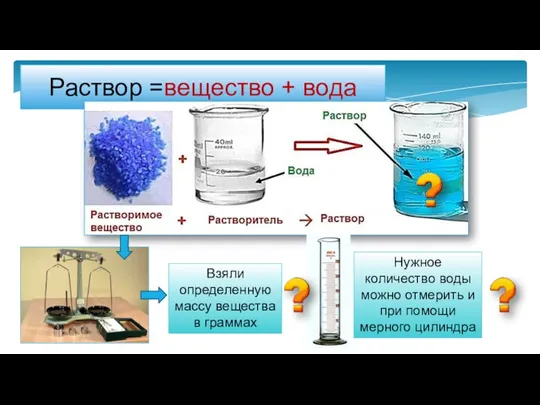
- 2. Раствор =вещество + вода Взяли определенную массу вещества в граммах Нужное количество воды можно отмерить и
- 3. Массовая доля растворенного вещества Существуют различные способы выражения концентрации растворённого вещества в растворе. Мы познакомимся с
- 4. Массовую долю растворённого вещества можно выражать в процентах. Тогда массовую долю растворенного вещества называют ПРОЦЕНТНОЙ КОНЦЕНТРАЦИЕЙ
- 5. Решение задачи Сколько грамм поваренной соли и воды нужно взять для приготовления 200 г 15% раствора?
- 6. Объемная доля газов в смеси Для того чтобы выразить состав смеси газов количественно, используют величину «объемная
- 7. Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ. Физический смысл величины «Объемная
- 8. Решение задач Пример 1. Анализ атмосферы Венеры показал, что в 50 мл венерианского «воздуха» содержится 48,5
- 9. Пример 2. Вычислите объем кислорода, содержащегося в 500 л воздуха, если доля кислорода 0,21? Решение: 1)
- 14. Скачать презентацию










 Щелочные металлы
Щелочные металлы Organic Compounds
Organic Compounds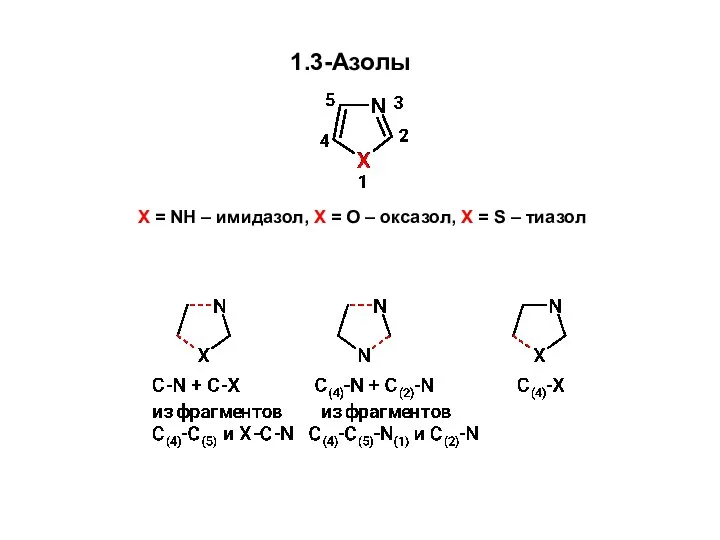 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Алкоголь
Алкоголь Алюминий и его свойства
Алюминий и его свойства Алюміній і сполуки алюмінію у побуті людини
Алюміній і сполуки алюмінію у побуті людини Молибден. Нахождение в природе
Молибден. Нахождение в природе Способы выражения состава растворов
Способы выражения состава растворов Вищі карбонові кислоти. Мило, його мийна дія. 9 клас
Вищі карбонові кислоти. Мило, його мийна дія. 9 клас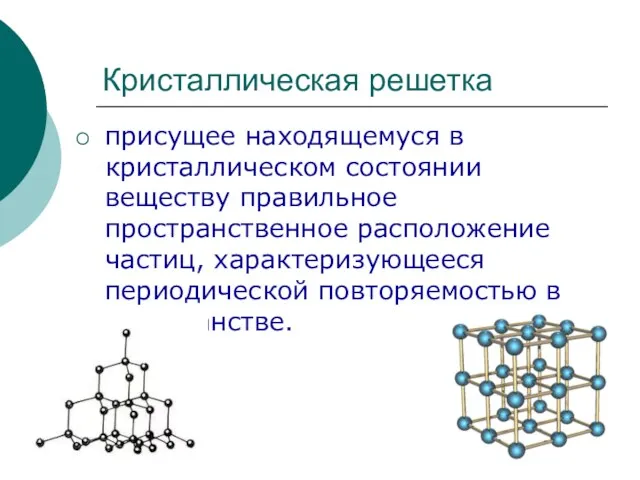 Кристаллическая решетка
Кристаллическая решетка Каменный уголь и методы его переработки
Каменный уголь и методы его переработки Геохимия. Проблемы геохимии. Геохимические методы
Геохимия. Проблемы геохимии. Геохимические методы Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Химические реакции. Классификация химических реакций
Химические реакции. Классификация химических реакций Калийные удобрения
Калийные удобрения Введение в органическую химию
Введение в органическую химию Сульфиды — природные сернистые соединения металлов и некоторых неметаллов
Сульфиды — природные сернистые соединения металлов и некоторых неметаллов Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Свойства минералов Лекция 3
Свойства минералов Лекция 3 Germaniy gruppachasining elementlarining olinishi va xossalari
Germaniy gruppachasining elementlarining olinishi va xossalari Материаловедение. Лекция 1
Материаловедение. Лекция 1 Кислотно-основные свойства органических соединений
Кислотно-основные свойства органических соединений Этилен. Углеводороды ряда этилена
Этилен. Углеводороды ряда этилена Енергетичний баланс процесу горіння
Енергетичний баланс процесу горіння Механическая смесь и растворы
Механическая смесь и растворы