Содержание
- 2. План лекції 1. Тепловий ефект хімічної реакції. 2. Теплота згоряння. Види теплоти згоряння 3. Розрахунок теплоти
- 3. 1. ТЕПЛОВИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ Тепловий ефект реакції – кількість теплоти, що виділяється чи поглинається системою
- 4. За І законом термодинаміки теплота хімічної реакції: - dQ = dU + PdV = dH –
- 5. Стандартна теплота реакції - різниця між стандартними теплотами утворення продуктів реакції і вихідних речовин. Q =
- 6. 2. ТЕПЛОТА ЗГОРЯННЯ. ВИДИ ТЕПЛОТИ ЗГОРЯННЯ Теплота згоряння – кількість тепла, що виділяється при повному згорянні
- 7. Розрізняють теплоти згоряння: молярну Q – розрахунок на 1 моль горючої речовини (кДж/моль) за законом Гесса:
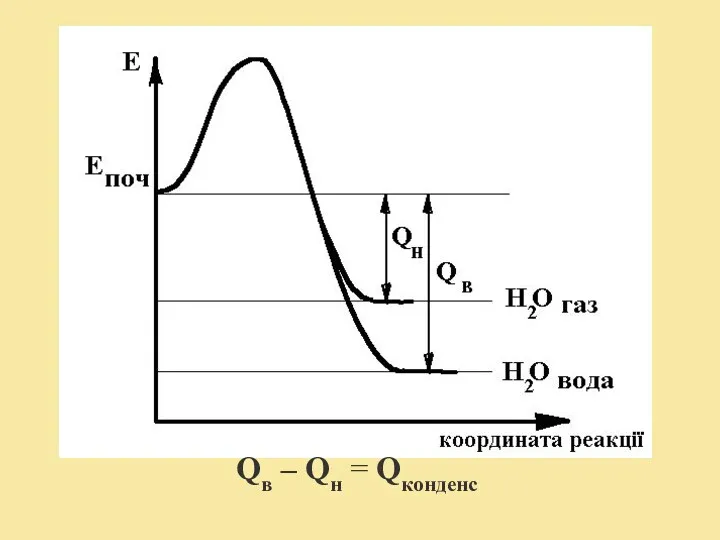
- 8. Залежно від агрегатного стану води, яка утворилася в процесі горіння і знаходиться в продуктах горіння, розрізняють
- 9. Qв – Qн = Qконденс
- 10. У разі урахуванні чинників, які впливають на теплоту згоряння речовини (повнота згорання, вологість матеріалу, втрати на
- 11. 3. РОЗРАХУНОК ТЕПЛОТИ ЗГОРЯННЯ Горюча речовина індивідуального хімічного складу – за законом Гесса Складні горючі матеріали:
- 12. Практичне значення теплоти згоряння 1). Розрахунок пожежної навантаги Рпож – це кількість тепла, що виділяється при
- 13. 4. ТЕМПЕРАТУРА ГОРІННЯ РЕЧОВИНИ ТА ЇЇ ВИДИ Температура горіння - температура, до якої нагріваються продукти горіння
- 14. Калориметрична - виконуються наступні умови: 1) стандартні умови; 2) повне згоряння (стехіометрична концентрація); 3) немає дисоціації
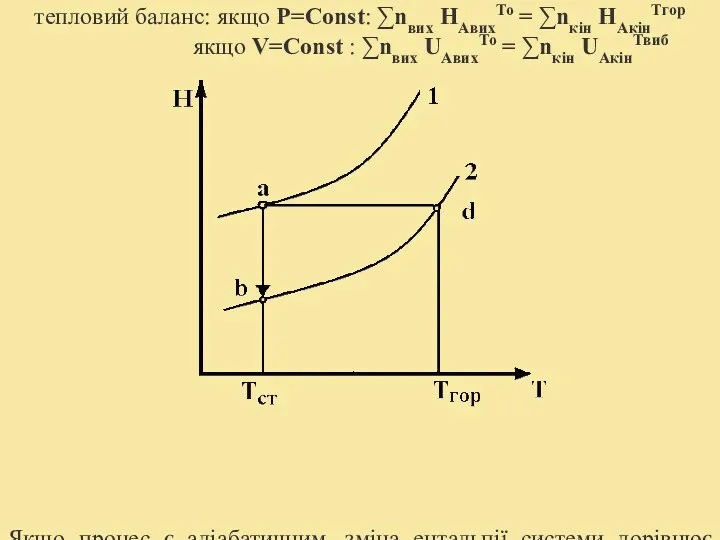
- 15. тепловий баланс: якщо P=Const: ∑nвих НАвихТо = ∑nкін НАкінТгор якщо V=Const : ∑nвих UАвихТо = ∑nкін
- 16. Залежність ентальпії від температури: де Нст – теплота реакції, за стандартних умов. Тепло на розігрів ПГ
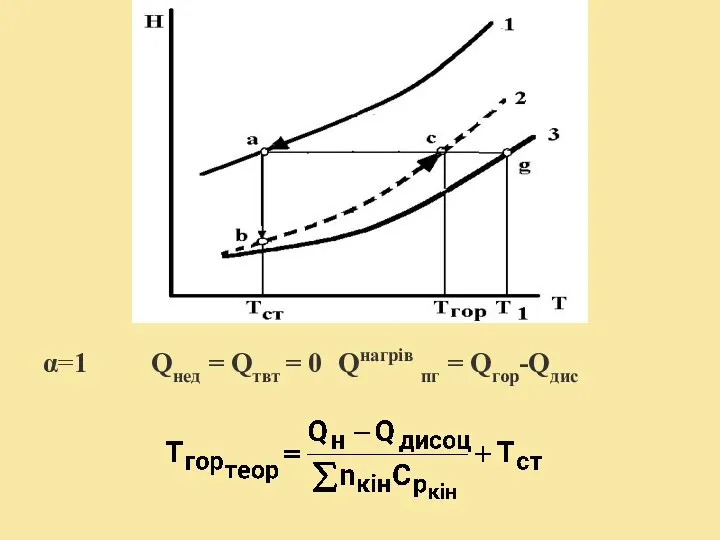
- 17. Якщо Тгор значна, то продукти горіння дисоціюють із витратою енергії на цей процес. 2СО2 = 2СО
- 18. α=1 Qнед = Qтвт = 0 Qнагрів пг = Qгор-Qдис
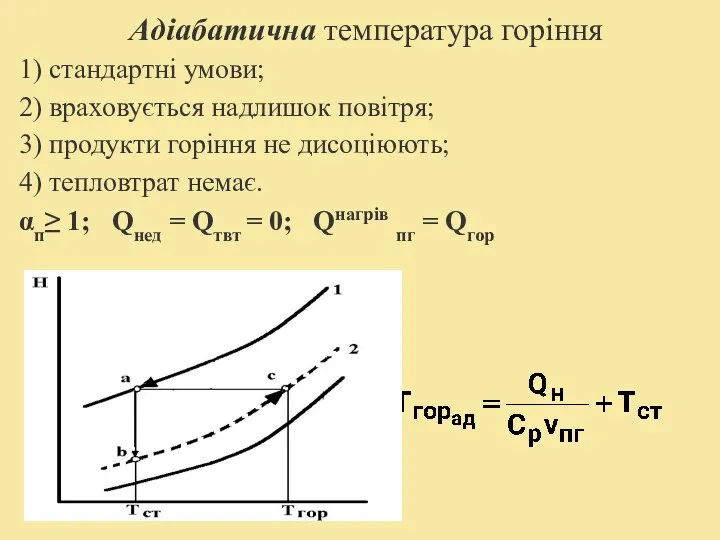
- 19. Адіабатична температура горіння 1) стандартні умови; 2) враховується надлишок повітря; 3) продукти горіння не дисоціюють; 4)
- 20. Дійсна температура горіння враховує нагрів продуктів горіння за реальних умов: 1) є надлишок повітря, 2) враховують
- 21. 5. РОЗРАХУНОК АДІАБАТИЧНОЇ ТЕМПЕРАТУРИ ГОРІННЯ 5.1. Визначення температури горіння із використанням ентальпії продуктів горіння
- 24. 5.2. Розрахунок температури горіння із використанням теплоємності продуктів горіння Середня теплоємність продуктів горіння залежить від їх
- 26. Скачать презентацию



















 Катенаны. Ротаксаны (лекция 6)
Катенаны. Ротаксаны (лекция 6) Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Классы неорганических веществ
Классы неорганических веществ Спроби класифікації хімічних елементів
Спроби класифікації хімічних елементів Строение и химические свойства кислот
Строение и химические свойства кислот Липиды растений и их обмен
Липиды растений и их обмен Теория строения органического вещества. 10 класс
Теория строения органического вещества. 10 класс Приложения II начала термодинамики
Приложения II начала термодинамики Строение, реакционные способности и методы синтеза алкадиенов
Строение, реакционные способности и методы синтеза алкадиенов Межмолекулярные силы (силы Ван дер Ваальса)
Межмолекулярные силы (силы Ван дер Ваальса) Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН План характеристики елемента за його положенням у періодичній системі та будовою атома
План характеристики елемента за його положенням у періодичній системі та будовою атома Измерение и оценка химического фактора. Лекция 9
Измерение и оценка химического фактора. Лекция 9 Фазовое равновесие
Фазовое равновесие Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів Полусинтетическое масло
Полусинтетическое масло Карбонові кислоти
Карбонові кислоти Хімічні властивості карбонових кислот
Хімічні властивості карбонових кислот Химическая связь и ее типы
Химическая связь и ее типы Азот. Соединения азота
Азот. Соединения азота Непредельные углеводороды
Непредельные углеводороды Генетическая связь между классами веществ
Генетическая связь между классами веществ Щелочи
Щелочи Химиялық реакциялар. Амфотерлі негіздер
Химиялық реакциялар. Амфотерлі негіздер Инертные газы
Инертные газы Разбор заданий
Разбор заданий Физические и химические явления. Признаки химических реакций
Физические и химические явления. Признаки химических реакций