Содержание
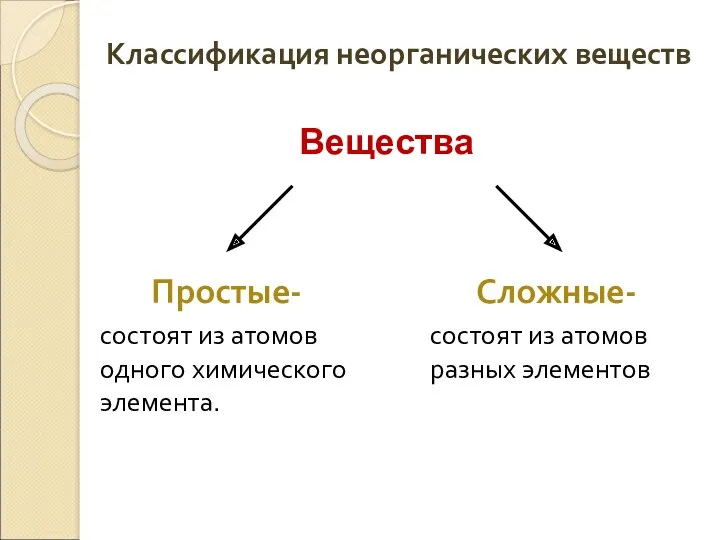
- 2. Классификация неорганических веществ Простые- состоят из атомов одного химического элемента. Сложные- состоят из атомов разных элементов
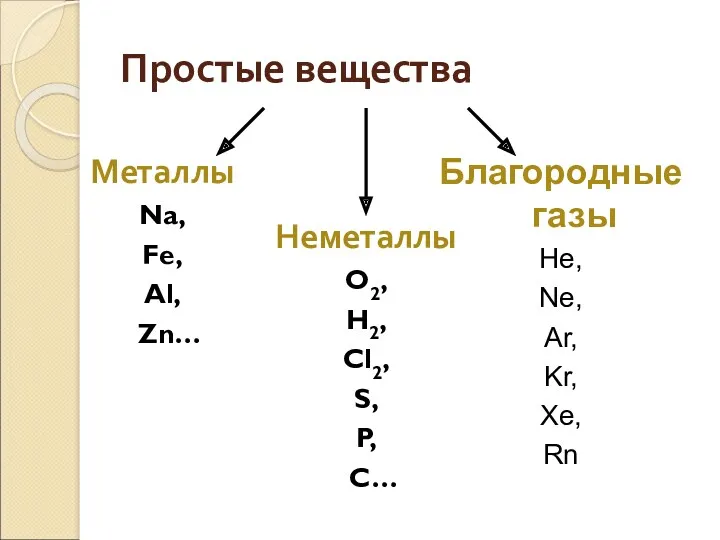
- 3. Благородные газы He, Ne, Ar, Kr, Xe, Rn Простые вещества Металлы Na, Fe, Al, Zn… Неметаллы
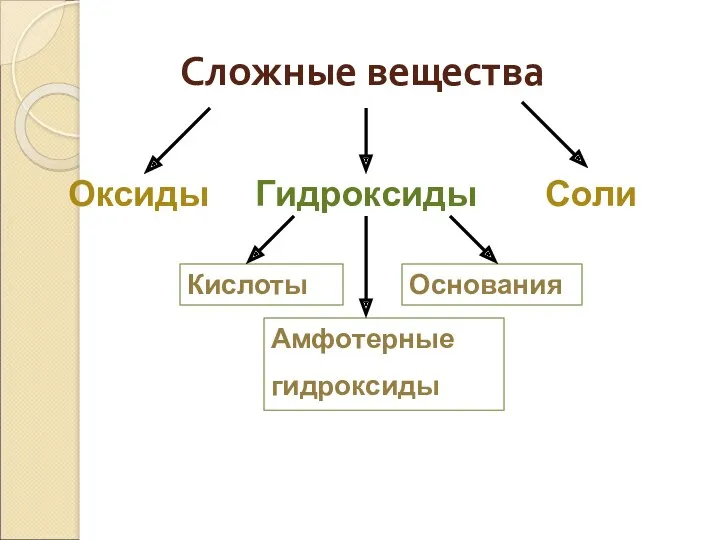
- 4. Сложные вещества Оксиды Гидроксиды Соли Кислоты Основания Амфотерные гидроксиды
- 5. Свойства оксидов и гидроксидов в периоде изменяются от основных через амфотерные к кислотным, т.к. увеличивается положительная
- 6. Оксиды Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород
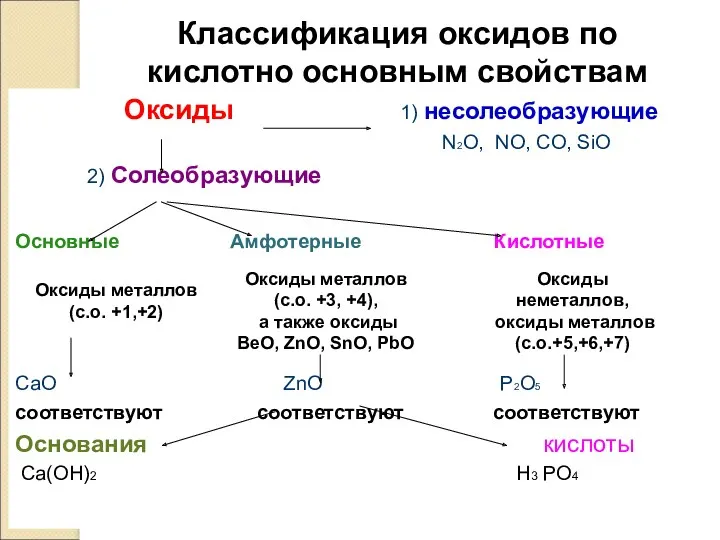
- 7. Классификация оксидов по кислотно основным свойствам Оксиды 1) несолеобразующие N2O, NO, CO, SiO 2) Солеобразующие Основные
- 8. Несолеобразующие оксиды — оксиды, не проявляющие ни кислотных, ни основных, ни амфотерных свойств и не образующие
- 9. Общая формула Ме2О, МеО Физические свойства При комнатной температуре основные оксиды твердые, кристаллические вещества чаще всего
- 10. Агрегатное состояние различное: Р2О5 – твердый, SiO2 – твердый, СО2 – газообразный, SO3 – жидкий при
- 11. Al2O3 (оксид алюминия) очень твердые прозрачные кристаллы. Температура плавления – 2053 °C, температура кипения – 3000
- 12. Какие элементы периодической системы образуют амфотерные соединения? Металлы Неметаллы, исключая элементы побочных подгрупп Элементы, образующие амфотерные
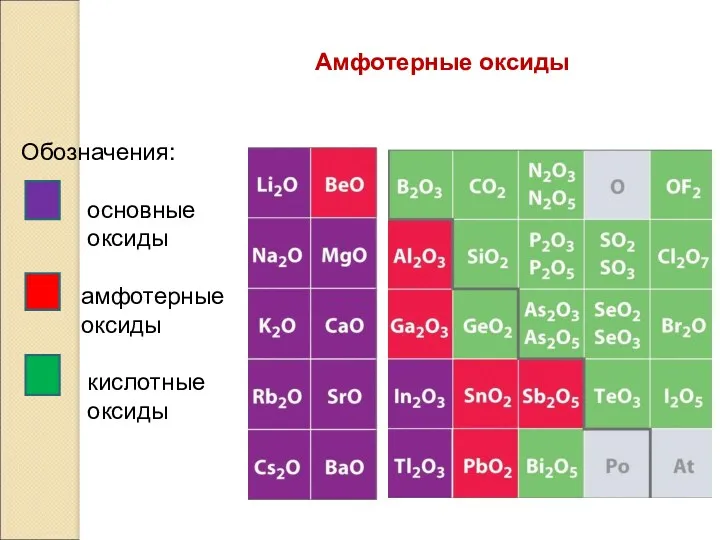
- 13. Амфотерные оксиды Обозначения: основные оксиды амфотерные оксиды кислотные оксиды
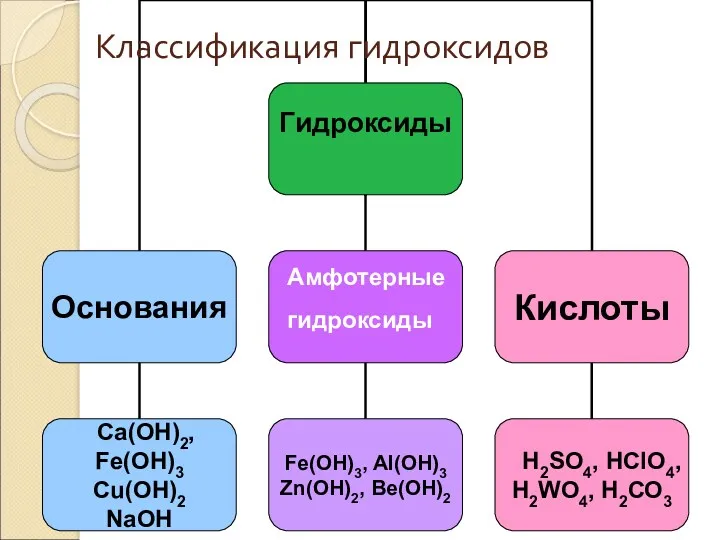
- 14. Гидроксиды Гидроксиды – это неорганические соединения, содержащие в составе гидроксильную группу (-ОН ) Общая формула: Э(ОН)n
- 15. Амфотерные гидроксиды Классификация гидроксидов
- 16. Основания Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или
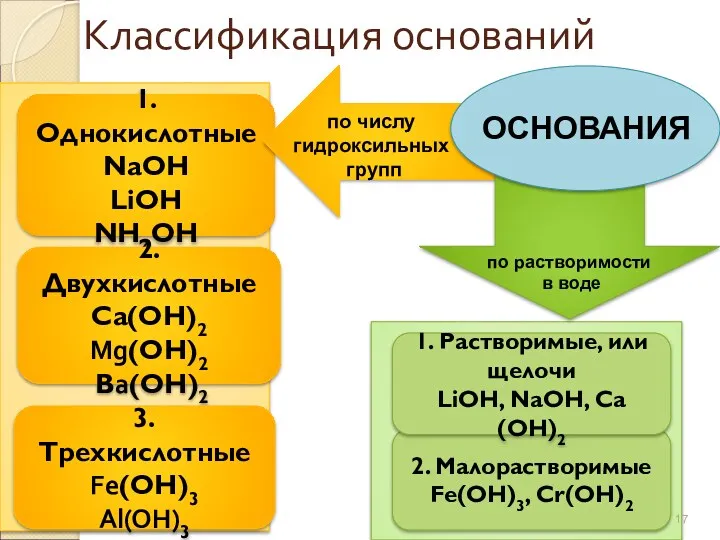
- 17. Классификация оснований 1. Однокислотные NaОН LiОН NН4ОН 2. Двухкислотные Са(ОН)2 Mg(ОН)2 Вa(ОН)2 3. Трехкислотные Fe(ОН)3 Al(OH)3
- 18. Основания. Гидроксиды щелочных металлов Общая формула – МеОН Щелочи. Белые кристаллические вещества, гигроскопичны, хорошо растворимы в
- 19. Гидроксиды металлов IIА группы Общая формула – Ме(ОН)2 Белые кристаллические вещества, в воде растворимы хуже, чем
- 20. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж – на желтый Химические
- 21. Кислоты Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. При
- 22. Физические свойства кислот При обычных условиях кислоты могут быть жидкими и твердыми (борная, ортофосфорная, вольфрамовая) Кислоты
- 23. Классификация кислот
- 24. Амфотерными называются гидроксиды , которые в зависимости от условий могут быть как донорами катионов водорода и
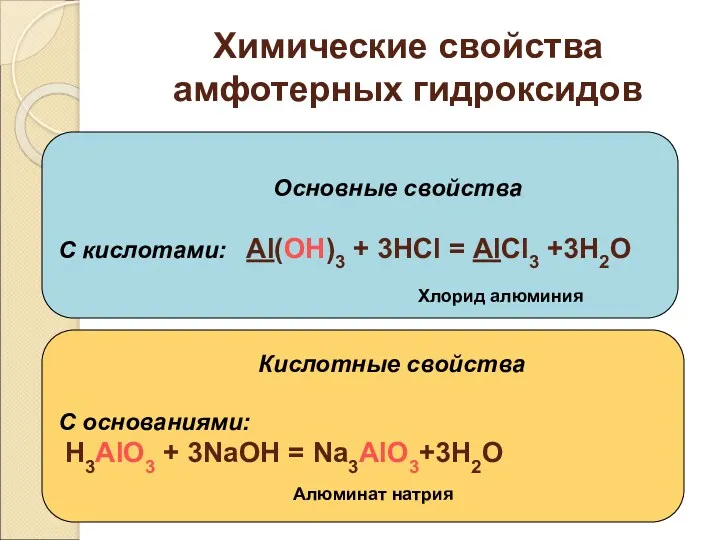
- 25. Химические свойства амфотерных гидроксидов Основные свойства С кислотами: Al(OH)3 + 3HCl = AlCl3 +3H2O Кислотные свойства
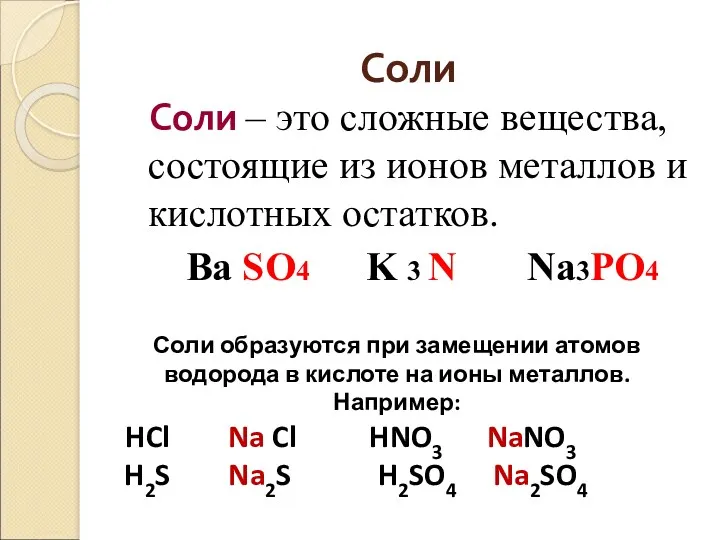
- 26. Соли Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков. Ba SO4 K
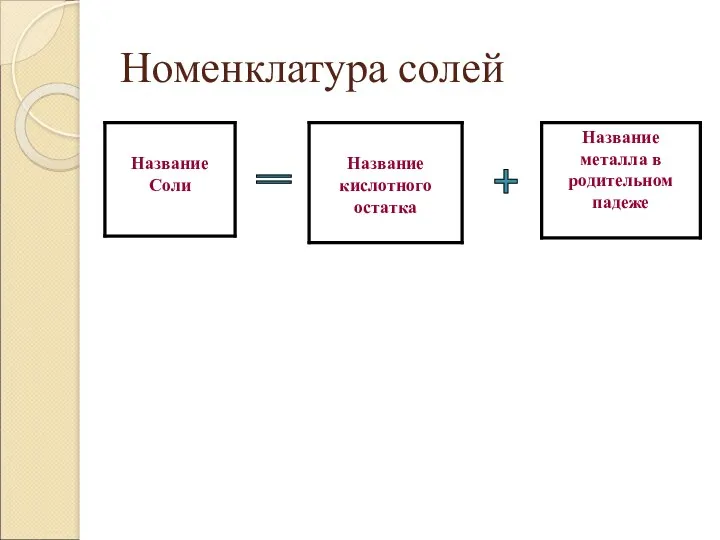
- 27. Номенклатура солей + =
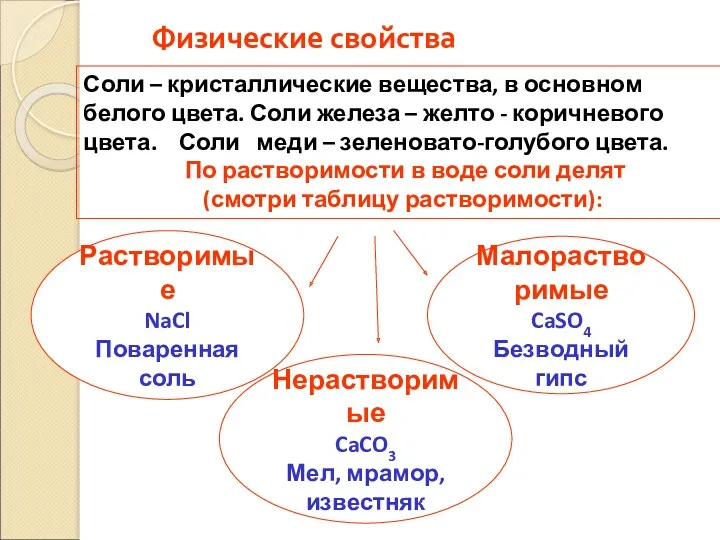
- 28. Физические свойства Растворимые NaCl Поваренная соль Соли – кристаллические вещества, в основном белого цвета. Соли железа
- 29. Типы солей Нормальные (средние) -это соли, в которых все атомы водорода соответствующей кислоты замещены на атомы
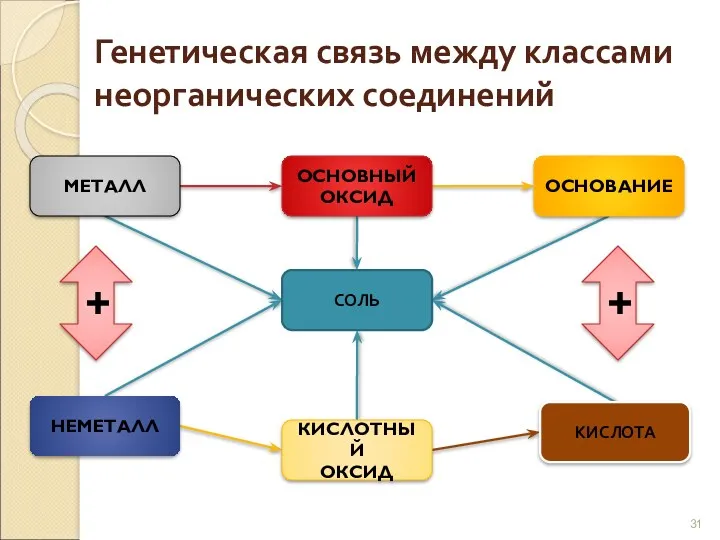
- 30. Генетическая связь Связь между классами неорганических соединений, основанная на получении веществ одного класса из веществ другого
- 31. Генетическая связь между классами неорганических соединений МЕТАЛЛ ОСНОВНЫЙ ОКСИД ОСНОВАНИЕ СОЛЬ НЕМЕТАЛЛ КИСЛОТНЫЙ ОКСИД КИСЛОТА +
- 32. Солеобразующие оксиды ОПРЕДЕЛЕНИЕ ГРУПП ОКСИДОВ Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или
- 34. Скачать презентацию



















 Вещества и тела. Состояния веществ. Смеси
Вещества и тела. Состояния веществ. Смеси Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Теория электролитической диссоциации
Теория электролитической диссоциации Строение атома и периодический закон
Строение атома и периодический закон Минерал родонит. Месторождения
Минерал родонит. Месторождения Состав, свойства, виды и способы получения дегтей
Состав, свойства, виды и способы получения дегтей Химия p-элементов
Химия p-элементов Цинк и его соединения
Цинк и его соединения Полисахаридтер – жоғары молекулалық көмірсулар
Полисахаридтер – жоғары молекулалық көмірсулар Физические и химические явления. Условия течения и признаки химических реакций
Физические и химические явления. Условия течения и признаки химических реакций Химия. 9 класс
Химия. 9 класс Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Алкандар. (қаныққан көмірсутектер. Парафиндер.)
Алкандар. (қаныққан көмірсутектер. Парафиндер.) Гель-хроматография. Бумажная хроматография
Гель-хроматография. Бумажная хроматография Минералы и их свойства
Минералы и их свойства Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Кремнийдің құрамы, құрылысы және қасиеттері
Кремнийдің құрамы, құрылысы және қасиеттері Реакции электрофильного замещения в ароматическом ряду Se
Реакции электрофильного замещения в ароматическом ряду Se Химические реакции
Химические реакции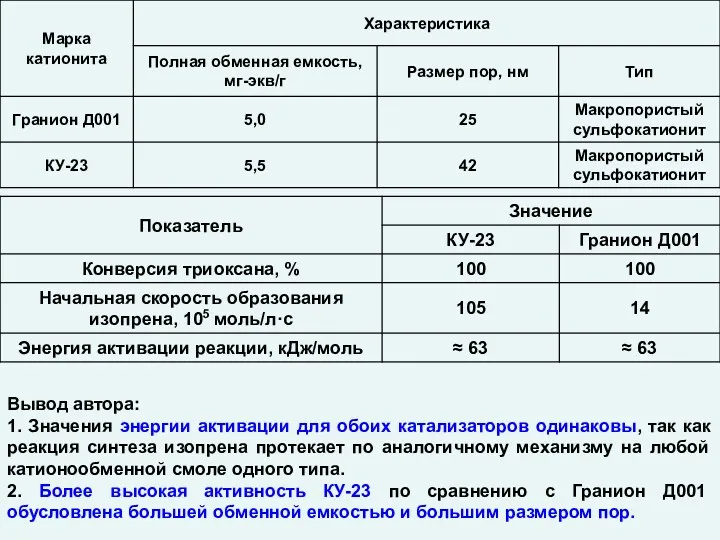 Катализ. Гетерогенные катализаторы
Катализ. Гетерогенные катализаторы Галогены в природе. Хлор, бром, иод
Галогены в природе. Хлор, бром, иод Материаловедение. Придание металлам и сплавам заданных свойств
Материаловедение. Придание металлам и сплавам заданных свойств Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3
Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3 Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів
Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів Композиты и композиционные материалы
Композиты и композиционные материалы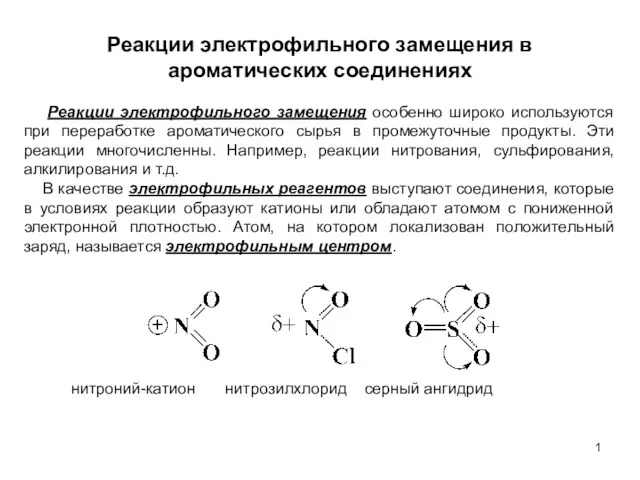 Реакции электрофильного замещения в ароматических соединениях. (Лекция 6)
Реакции электрофильного замещения в ароматических соединениях. (Лекция 6) Предмет физической и коллоидной химии. Термодинамика
Предмет физической и коллоидной химии. Термодинамика