Содержание
- 2. Галогены в природе 11. Хлор (0,19%) 43. Бром 70. Иод 94. Астат Редкие рассеянные элементы Галит
- 3. Редкие минералы Бромаргирит AgBr Иодаргирит AgI Лаутарит Ca(IO3)2 Диэтзеит 7Ca(IO3)2·8CaCrO4
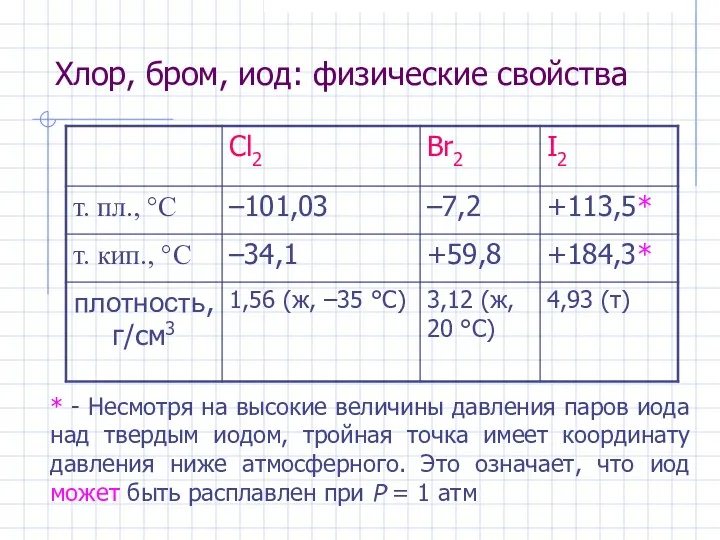
- 4. Хлор, бром, иод: физические свойства * - Несмотря на высокие величины давления паров иода над твердым
- 5. Г2: Cl Br I (At) Примеры: Cl2(Br2) + Cu → CuCl2 (CuBr2); Sтв + Cl2г →
- 6. Г2: Cl Br I (At) Примеры (продолжение): 3. H2(г) + Cl2(г) ⮀ 2 HCl(г); ΔG °
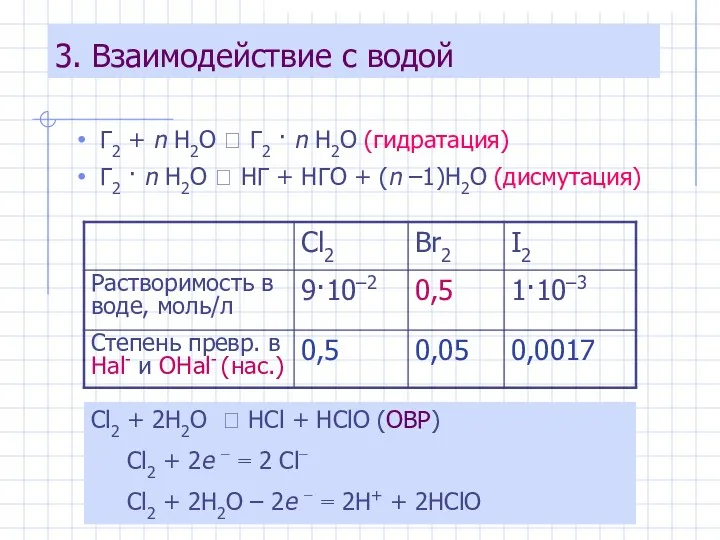
- 7. 3. Взаимодействие с водой Г2 + n H2O ⮀ Г2 · n H2O (гидратация) Г2 ·
- 8. В р-ре KI: KI + I2 (т) = K[I(I)2] I– + I2 (т) = [I(I)2]– дииодоиодат(I)-ион
- 9. В растворах щелочей Br2 + 2KOH = KBr + KBrO + H2O (на холоду) Br2 +
- 10. В органических растворителях Органические растворители, не смешивающиеся с водой, используют для извлечения (экстракции) брома и иода.
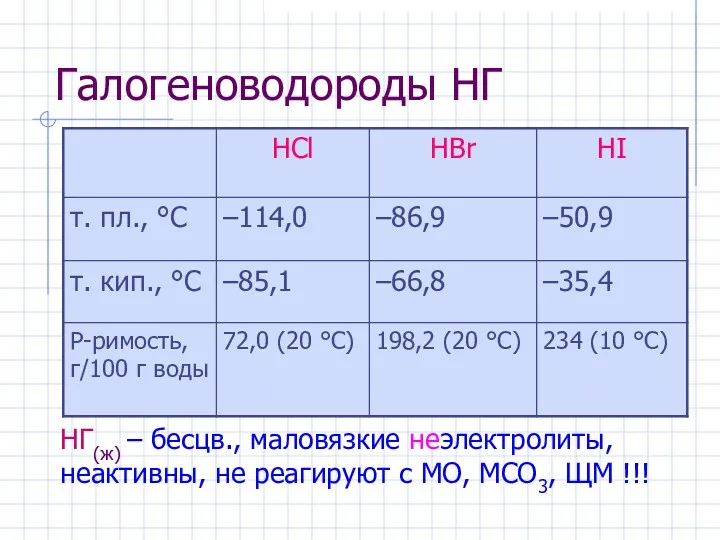
- 11. Галогеноводороды НГ НГ(ж) – бесцв., маловязкие неэлектролиты, неактивны, не реагируют c МО, МCO3, ЩМ !!!
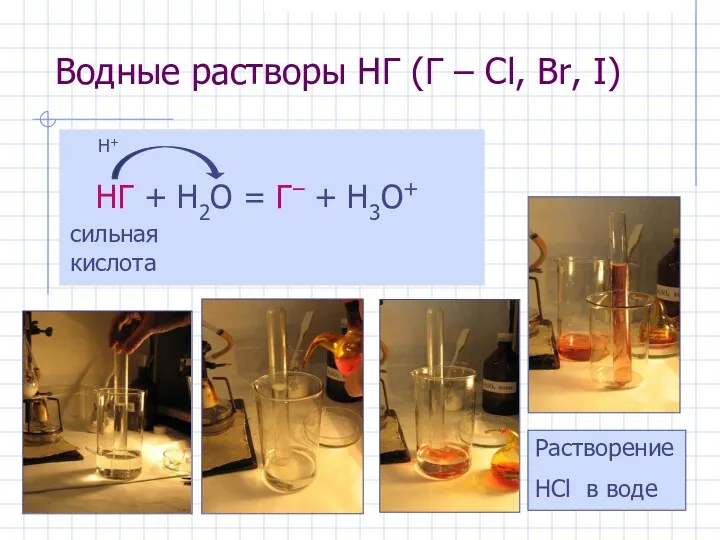
- 12. Водные растворы HГ (Г – Cl, Br, I) НГ + H2O = Г– + H3O+ сильная
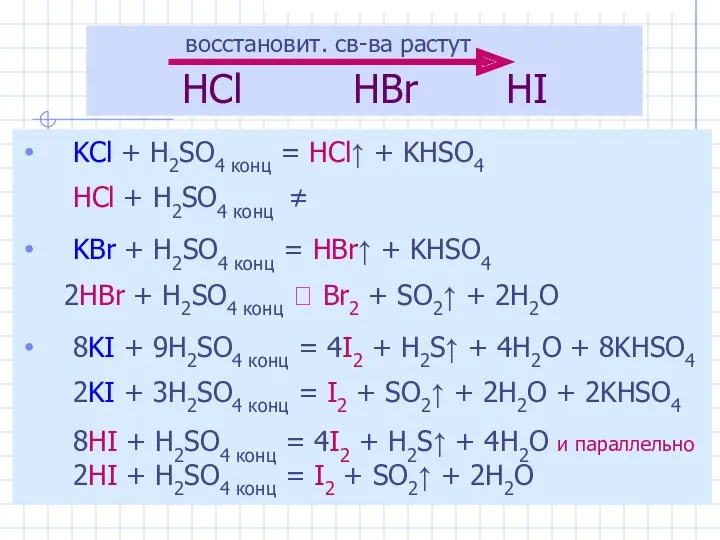
- 13. HCl HBr HI KCl + H2SO4 конц = HCl↑ + KHSO4 HCl + H2SO4 конц ≠
- 14. Получение НCl В промышл. – прямым синтезом: H2 + Cl2 = 2HCl В лаборатории: NaCl +
- 15. Получение НBr и HI В лаборатории и в промышл. усл. – синтез галогенидов фосфора с последующим
- 16. Кислородные кислоты
- 17. Взаимодействие с водой В водном растворе HClO, HClO2, HBrO и H5IO6 – слабые кислоты: HClO +
- 18. Оксиды галогенов: все, кроме I2O5 метастабильны
- 19. Получение и реакции оксидов: Cl2 + Ag2O → Cl2O + 2AgCl (в неводном растворителе); 3KClO3 +
- 20. В щелочной среде – дисмутация: 3Г2 + 6NaOH = 5NaГ + NaГO3 + 3H2O Г2 +
- 22. Скачать презентацию




![В р-ре KI: KI + I2 (т) = K[I(I)2] I–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/267434/slide-7.jpg)









 Классификация минералов по химическому принципу. Занятие 9
Классификация минералов по химическому принципу. Занятие 9 Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру
Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева Химия и продукты питания
Химия и продукты питания Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Золото
Золото Этанол. Одноатомный спирт
Этанол. Одноатомный спирт Важнейшие нефтепродукты. Области их применения
Важнейшие нефтепродукты. Области их применения 29 Кинетика идеальных проточных ректоров (2)
29 Кинетика идеальных проточных ректоров (2) Полиамиды. Классификация по методу получения
Полиамиды. Классификация по методу получения Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли
Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли Занимательные опыты
Занимательные опыты Роль металлов в нашей жизни
Роль металлов в нашей жизни Керамические материалы
Керамические материалы Нитрофенилалкиламины
Нитрофенилалкиламины Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Сильные и слабые электролиты. Кислотность среды. 9 класс
Сильные и слабые электролиты. Кислотность среды. 9 класс Растворы. Часть 2
Растворы. Часть 2 Методы осаждения. Аналитическая химия
Методы осаждения. Аналитическая химия Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Центрифугирование
Центрифугирование Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів
Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе
Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе Общая характеристика элементов главной подгруппы второй группы
Общая характеристика элементов главной подгруппы второй группы fosfor_i_ego_soedineniya
fosfor_i_ego_soedineniya Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Извлечение из растворов экстракцией органическими растворителями
Извлечение из растворов экстракцией органическими растворителями