Содержание
- 2. Ко II группе главной подгруппы периодической системы элементов относятся бериллий, магний щелочноземельные металлы: кальций, стронций, барий
- 3. Был открыт Л. Н. Вокленом в 1798 г. Металлический бериллий применяется для изготовления окон к рентгеновским
- 4. Впервые был выделен в чистом виде сэром Г. Дэви в 1808 г. дистилляцией ртути из магниевой
- 5. Название элемента происходит от лат. calx (в родительном падеже calcis) — «известь», «мягкий камень». Оно было
- 6. Впервые был выделен в виде оксида А. Крофордом в 1790 г., а в чистом виде получен
- 7. Был открыт К. В. Шееле в 1774 г. и Г. Деви в 1808 г. Из соединений
- 8. Be +4 )2)2 1s22s2 Mg +12)2)8)2 1s22s22p63s2 Ca +20)2)8)8)2 1s22s22p63s23p64s2 Sr +38)2)8)18)8)2 1s22s22p63s23p63d104s24p65s2 Ba +56)2)8)18)18)8)2 1s22s22p63s23p63d104s24p64d105s25p66s2
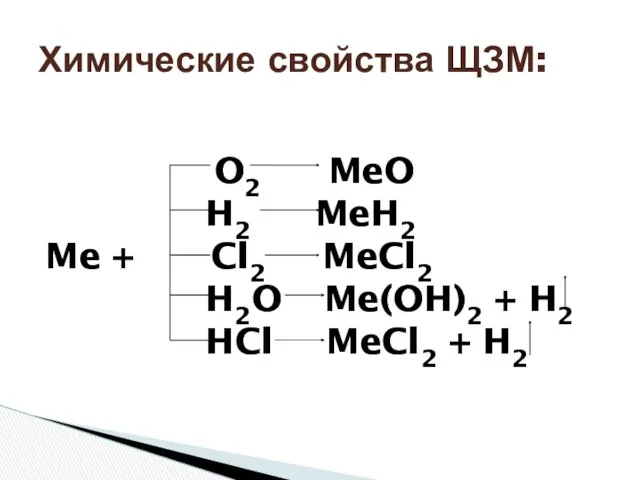
- 9. O2 MeO H2 MeH2 Me + Cl2 MeCl2 H2O Me(OH)2 + H2 HCl MeCl2 + H2
- 10. С кислородом: 2Ca + O2 2CaO Ca0 – 2e- Ca+2 2 2 В-ль O20 + 4e-
- 11. С водой: 2Ca + H2O Ca(OH)2 + H2 Ca0 – 2e- Ca+2 2 1 В-ль 2H+1+
- 12. Магниетермия: Mg + TiO2 t 2MgO + Ti Кальциетермия: 5Ca + V2O5 t 5CaO + 2V
- 14. Скачать презентацию










 Нуклеиновые кислоты
Нуклеиновые кислоты Фосфор
Фосфор Теория возникновения электродных и ОВ-потенциалов
Теория возникновения электродных и ОВ-потенциалов Органическая химия. Подготовка к контрольной работе № 2
Органическая химия. Подготовка к контрольной работе № 2 Электролиз. Сущность электролиза
Электролиз. Сущность электролиза Полимеры
Полимеры Алкины. Номенклатура и изомерия
Алкины. Номенклатура и изомерия Распределение лучистой энергии в спектре солнечной радиации до поступления в атмосферу и в спектре абсолютно черного тела
Распределение лучистой энергии в спектре солнечной радиации до поступления в атмосферу и в спектре абсолютно черного тела Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Химия - тұрмыста
Химия - тұрмыста Муравьиная кислота
Муравьиная кислота Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Многоядерные ароматические углеводороды
Многоядерные ароматические углеводороды Ионы и ионная химическая связь
Ионы и ионная химическая связь Способы разделения смесей
Способы разделения смесей Відкриття та походження хімічних елементів
Відкриття та походження хімічних елементів Номенклатура алканов
Номенклатура алканов Выделение транс-анетола из эфирных масел
Выделение транс-анетола из эфирных масел Теплогенерация. Топливо и его горение
Теплогенерация. Топливо и его горение Камни и Козерог
Камни и Козерог Углерод. Металлы. 9 класс
Углерод. Металлы. 9 класс Спирты. Классификация, номенклатура, изомерия спиртов
Спирты. Классификация, номенклатура, изомерия спиртов Атомовиты. Анатомо-физиологические свойства
Атомовиты. Анатомо-физиологические свойства Удивительный мир камня
Удивительный мир камня Сформировать понятие о химическом составе пищи
Сформировать понятие о химическом составе пищи Получение полимеров из низкомолекулярных соединений
Получение полимеров из низкомолекулярных соединений алкадиены
алкадиены Платина. Свойства
Платина. Свойства