Содержание
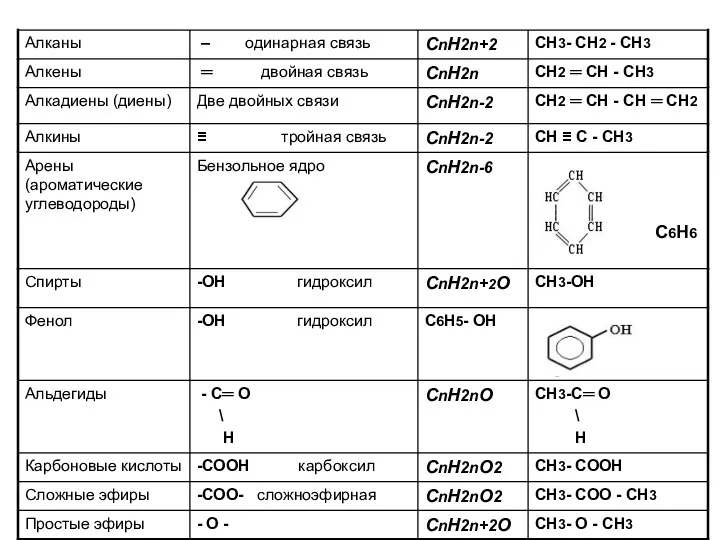
- 3. Гомологи – вещества одного класса (схожее строение и свойства), различающиеся по составу на одну или несколько
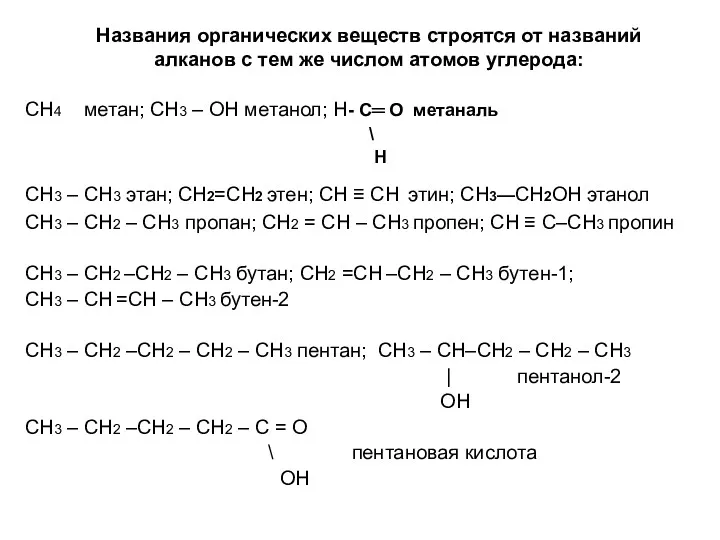
- 4. Названия органических веществ строятся от названий алканов с тем же числом атомов углерода: СН4 метан; СН3
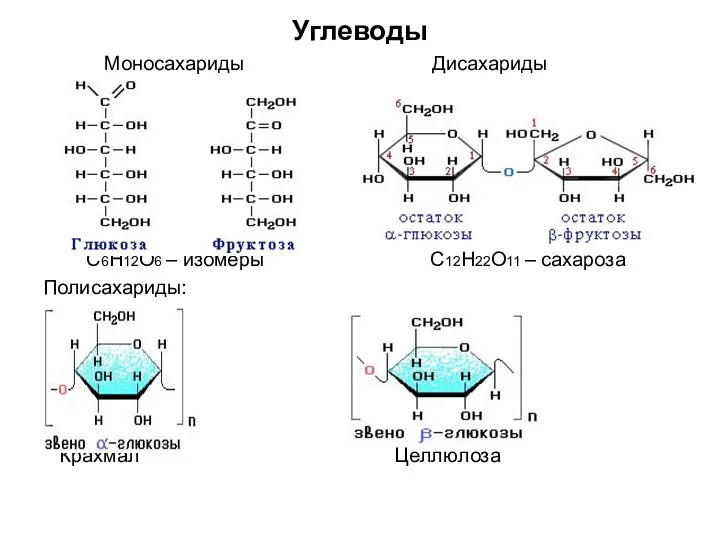
- 5. Углеводы Моносахариды Дисахариды С6Н12О6 – изомеры С12Н22О11 – сахароза Полисахариды: Крахмал Целлюлоза
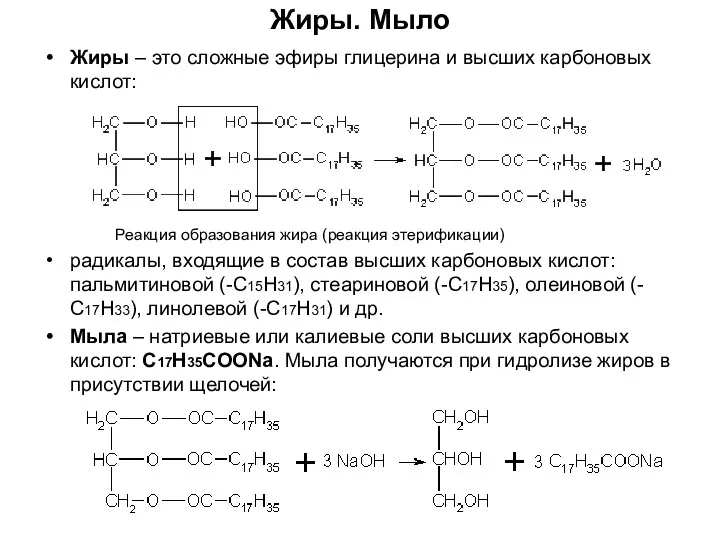
- 6. Жиры. Мыло Жиры – это сложные эфиры глицерина и высших карбоновых кислот: Реакция образования жира (реакция
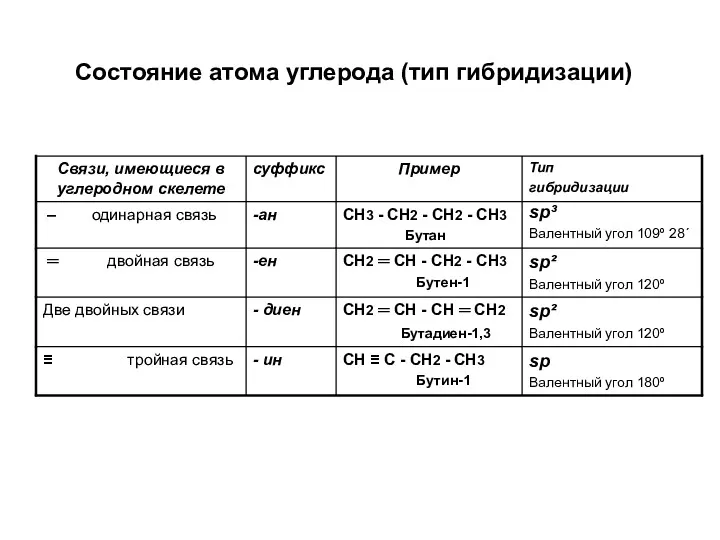
- 7. Состояние атома углерода (тип гибридизации)
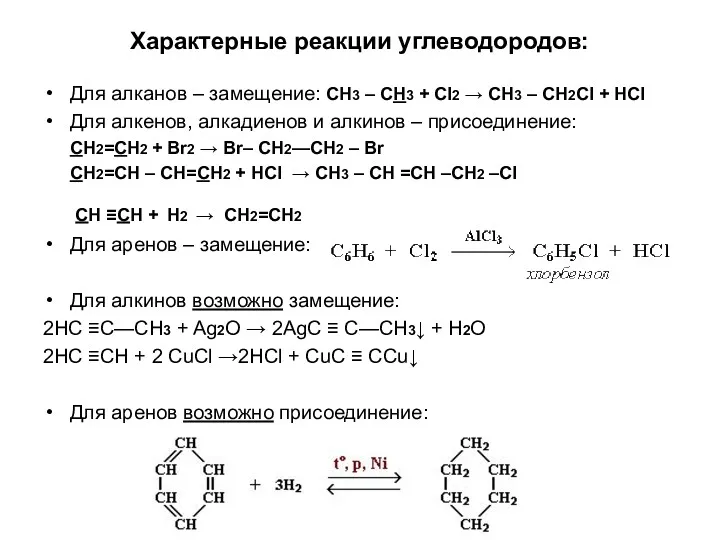
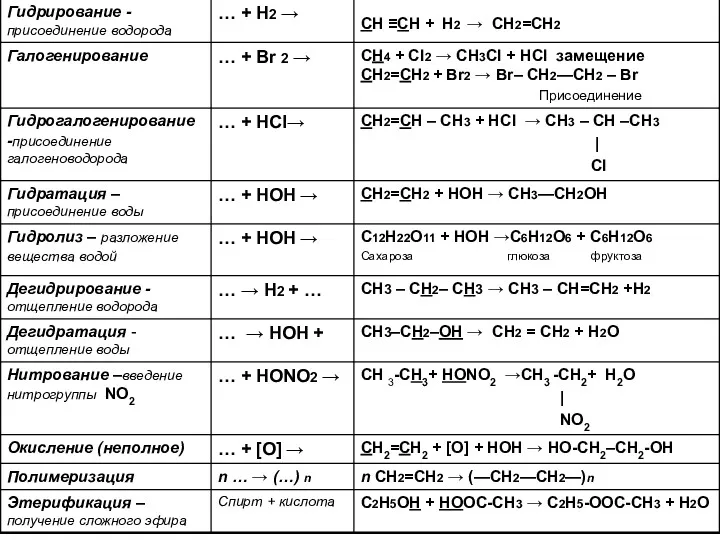
- 8. Характерные реакции углеводородов: Для алканов – замещение: CH3 – CH3 + Cl2 → CH3 – CH2Cl
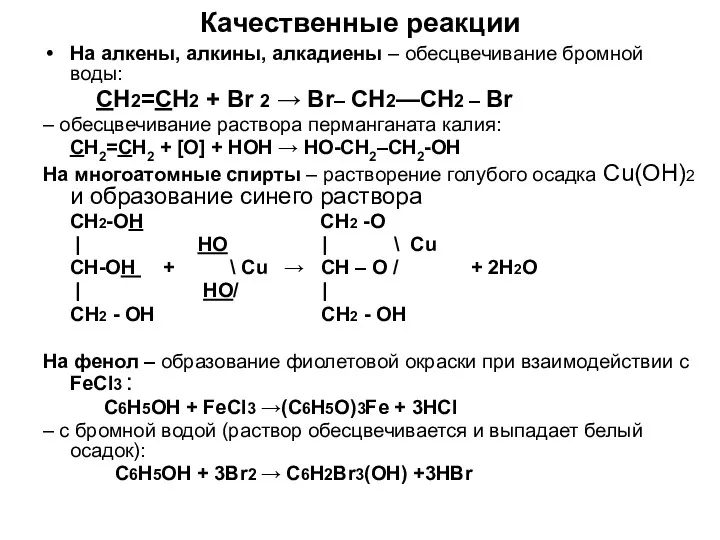
- 10. Качественные реакции На алкены, алкины, алкадиены – обесцвечивание бромной воды: CH2=CH2 + Br 2 → Br–
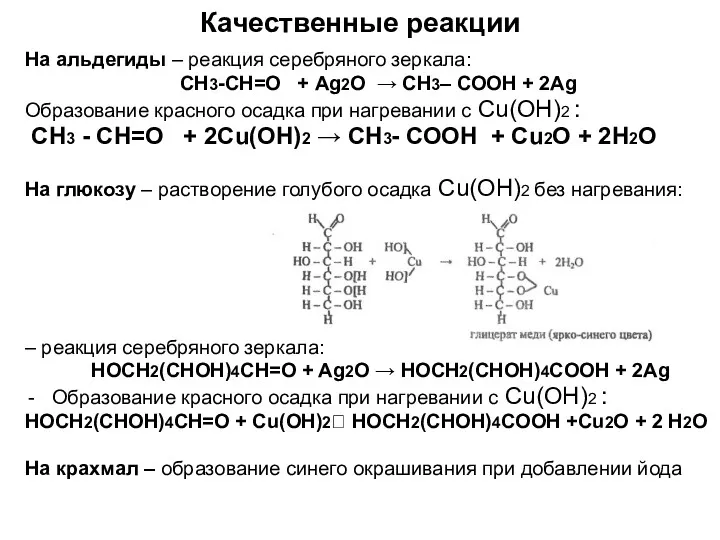
- 11. Качественные реакции На альдегиды – реакция серебряного зеркала: СН3-СН=О + Ag2O → СН3– СОOH + 2Ag
- 12. Именные реакции: Реакция Кучерова – получение уксусного альдегида (ацетальдегида) гидратацией ацетилена (этина): CH ≡ CH +
- 14. Скачать презентацию


 Углерод. Элемент IV группы
Углерод. Элемент IV группы Электронный помощник по химии 8 класс
Электронный помощник по химии 8 класс Химия переходных элементов IV – V группы
Химия переходных элементов IV – V группы Общая характеристика неметаллов
Общая характеристика неметаллов Ископаемые углеводороды
Ископаемые углеводороды Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Гидролиз солей
Гидролиз солей Неорганическая химия
Неорганическая химия Химический анализ веществ
Химический анализ веществ Альдегиды и кетоны
Альдегиды и кетоны Углеводы. 10 класс
Углеводы. 10 класс Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки Состав, строение и свойства натурального каучука
Состав, строение и свойства натурального каучука Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары
Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Кислые породы умеренно-щелочного ряда
Кислые породы умеренно-щелочного ряда Классификация химических реакций
Классификация химических реакций Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Первые шаги в минералогию: от новичка до знатока
Первые шаги в минералогию: от новичка до знатока Инертные газы
Инертные газы Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги
Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги Диссоциация кислот, оснований, солей
Диссоциация кислот, оснований, солей 20231110_zakon_avogadro
20231110_zakon_avogadro Спирттер мен фенолдар
Спирттер мен фенолдар Аминокислоты и белки
Аминокислоты и белки Карбон
Карбон Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем
Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем Азотная кислота
Азотная кислота