Содержание
- 2. Из высказываний древних алхимиков «“…“Крепкая водка” пожирает “луну”, выпуская “лисий хвост”. Сгущение полученной жидкости порождает “адский
- 3. Цели урока: Образовательная: Расширить представление о свойствах кислот, изучить особенности свойств азотной кислоты; Углубить познания в
- 4. Ло г и к а р а с с у ж д е н и я:
- 5. Ключ к тесту 1 – 4 Без ошибок - 5 2 – 3 1 ошибка -
- 6. У атома азота имеется три неспаренных p-электрона на внешнем слое, за счет которых он образует с
- 7. Физические свойства Бесцветная жидкость, дымящая на воздухе. Едкий запах. Желтый цвет концентрированной кислоты (разложение с образованием
- 8. Химические свойства Разбавленная азотная кислота проявляет свойства, общие для всех кислот: Диссоциация в водном растворе: HNO3
- 9. Окисление металлов: Продукты восстановления зависят от активности металла и разбавленности азотной кислоты. HNO3(конц)+ в-ль II. Азотная
- 10. 4HNO33(конц) + Hg = Hg(NO3)2 + 2NO2↑ + 2H2O 4Zn + 10HNO33(разб)= = 4Zn(NO3)2 + NH4NO3
- 11. Получение азотной кислоты В промышленности – окислением аммиака: 4NH3 + 5O2 = 4NO + 6H2O 2NO
- 12. красители лекарства удобрения пластмасса пиротехника взрывчатые вещества Применение азотной кислоты и нитратов HNO3 и нитраты
- 14. Скачать презентацию
 Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ
Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ Спирты одноатомные и многоатомные
Спирты одноатомные и многоатомные Нуклеиновые кислоты
Нуклеиновые кислоты Чистые вещества. Смеси. Способы разделения смесей (7 класс)
Чистые вещества. Смеси. Способы разделения смесей (7 класс) Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі
Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі Основные понятия и законы химии
Основные понятия и законы химии Возраст в геологии
Возраст в геологии Термодинамика химического равновесия
Термодинамика химического равновесия Металлы и их соединения
Металлы и их соединения Кремний в природе. Использование кремнезема для производства стекла. 9 класс
Кремний в природе. Использование кремнезема для производства стекла. 9 класс Химия в быту
Химия в быту Влияние катализатора на скорость химической реакции. Катализ
Влияние катализатора на скорость химической реакции. Катализ Железо. Соединения железа
Железо. Соединения железа Щелочные металлы
Щелочные металлы Марганец
Марганец Предпосылки открытия периодического закона
Предпосылки открытия периодического закона Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Періодична система Д.І.Менделєєва
Періодична система Д.І.Менделєєва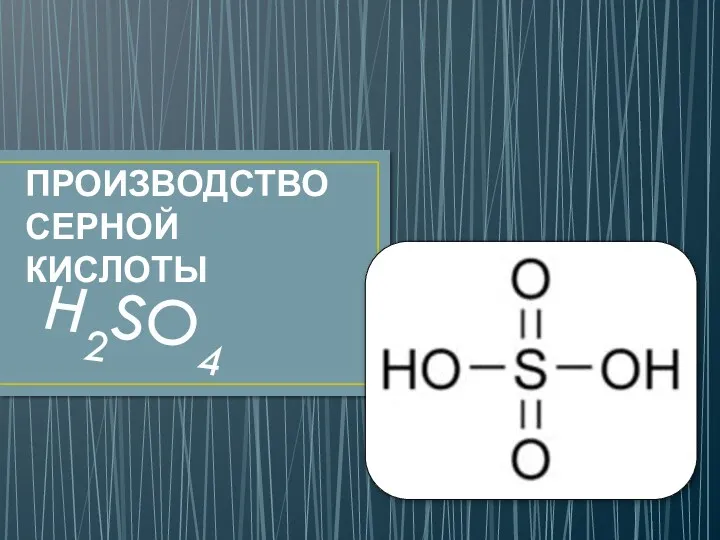 Производство серной кислоты
Производство серной кислоты Физико-диагностические свойства минералов
Физико-диагностические свойства минералов Губна помада та ії призначення
Губна помада та ії призначення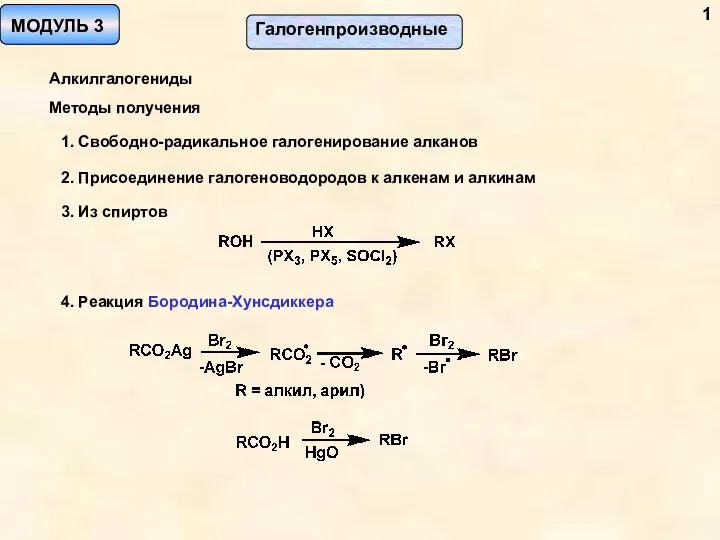 Галогенпроизводные. Алкилгалогениды. Методы получения. (Модуль 3)
Галогенпроизводные. Алкилгалогениды. Методы получения. (Модуль 3) Основные сведения о строении атома
Основные сведения о строении атома Алкандар. Метан және оның құрылысы
Алкандар. Метан және оның құрылысы Визитка химического элемента. Водород
Визитка химического элемента. Водород Альдегиды и кетоны
Альдегиды и кетоны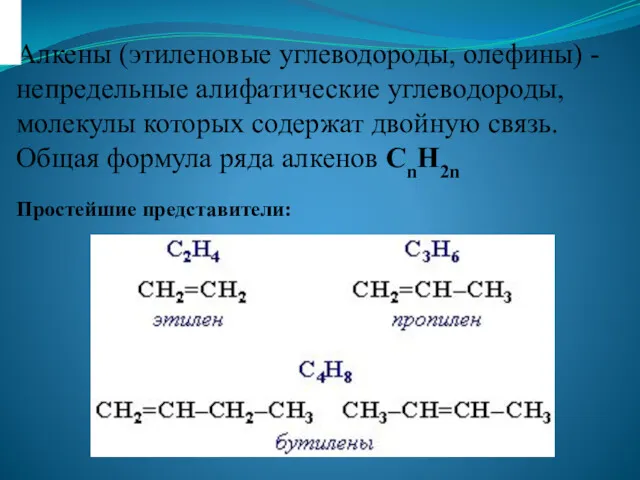 Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Окислительно-восстановительные реакции. Подготовка к К/Р. 9 класс
Окислительно-восстановительные реакции. Подготовка к К/Р. 9 класс