Содержание
- 2. У Періодичній системі Д.І.Менделєєва хімічні елементи розміщені у порядку зменшення їх відносних атомних мас.
- 3. Період – це горизонтальний ряд хімічних елементів, розміщених в порядку зростання їх відносної атомної маси, що
- 4. Періоди бувають великими, середніми і малими.
- 5. Періоди, що складаютья з одного ряду хімічних елементів називаються малими.
- 6. Елементом ІІ періоду є Сульфур.
- 7. Група – це вертикальний стовбчик, де містяться подібні елементи.
- 8. До IV групи належить елемент Нітроген.
- 9. ПРАВИЛЬНЕ ТВЕРДЖЕННЯ. В ОСНОВУ КЛАСИФІКАЦІЇ ПЕРІОДИЧНОЇ СИСТЕМИ ПОКЛАДЕНО ВІДНОСНУ АТОМНУ МАСУ ХІМІЧНИХ ЕЛЕМЕНТІВ
- 10. НЕПРАВИЛЬНЕ ТВЕРДЖЕННЯ ХІМІЧНІ ЕЛЕМЕНТИ РОЗМІЩЕНІ В ПОРЯДКУ ЗРОСТАННЯ ЇХ ВІДНОСНИХ АТОМНИХ МАС.
- 11. ПРАВИЛЬНЕ ТВЕРДЖЕННЯ Період – це горизонтальний ряд хімічних елементів, розміщених в порядку зростання їх відносної атомної
- 12. НЕПРАВИЛЬНЕ ТВЕРДЖЕННЯ ІСНУЮТЬ МАЛІ ТА ВЕЛИКІ ПЕРІОДИ
- 13. ПРАВИЛЬНЕ ТВЕРДЖЕННЯ ДО МАЛИХ ПЕРІОДІВ НАЛЕЖАТЬ 1,2,3, ЯКІ СКЛАДАЮТЬСЯ З ОДНОГО РЯДУ ХІМІЧНИХ ЕЛЕМЕНТІВ.
- 14. НЕПРАВИЛЬНЕ ТВЕРДЖЕННЯ ЕЛЕМЕНТ СУЛЬФУР НАЛЕЖИТЬ ДО ТРЕТЬОГО ПЕРІОДУ ПЕРІОДИЧНОЇ СИСТЕМИ ХІМІЧНИХ ЕЛЕМЕНТІВ.
- 15. ПРАВИЛЬНЕ ТВЕРДЖЕННЯ. ДО ГРУПИ ВІДНОСЯТЬСЯ ЕЛЕМЕНТИ ПОДІБНІ ЗА ВЛАСТИВОСТЯМИ.
- 16. НЕПРАВИЛЬНЕ ТВЕРДЖЕННЯ. ЕЛЕМЕНТ НІТРОГЕН ЗНАХОДИТЬСЯ У V ГРУПІ ПЕРІОДИЧНОЇ СИСТЕМІ ХІМІЧНИХ ЕЛЕМЕНТІВ.
- 17. Зверніть увагу на суперчність у періодичній системі Д.І.Менделєєва на три пари елементів: Телур – Іод (№52
- 18. ТЕМА УРОКУ БУДОВА АТОМА
- 19. Ядро атому приблизно в 10 000 разів менше, ніж сам атом. Таким чином, якщо збільшити атом
- 20. ІСТОРІЯ ДОСЛІДЖЕННЯ ДЕМОКРІТ: вся природа складається з атомів, найдрібніших часток речовини, які спочивають чи рухаються в
- 21. ІСТОРІЯ ВІДКРИТТЯ Марія Склодовська-Кюрі (1867—1934) Польська і французька вчена — фізик і хімік, одна з творців
- 22. ІСТОРІЯ ВІДКРИТТЯ Ернест Резерфорд показав експериментально, що атом складається з ядра, оточеного негативно зарядженими частинками —
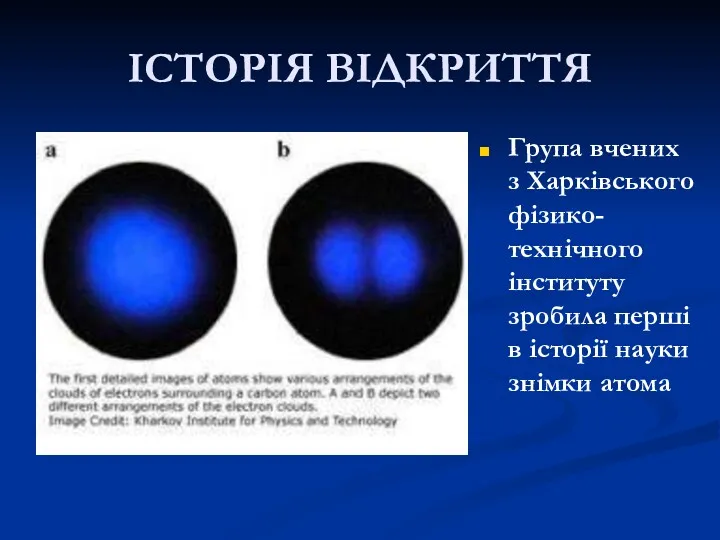
- 23. ІСТОРІЯ ВІДКРИТТЯ Група вчених з Харківського фізико-технічного інституту зробила перші в історії науки знімки атома
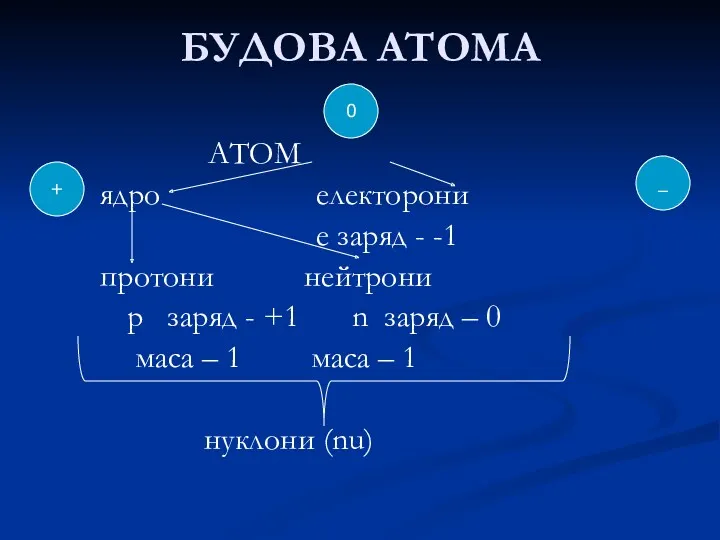
- 24. БУДОВА АТОМА АТОМ (електронейтральна частинка, що складається з позитивно зарядженого ядра та негативно заряджених електронів) Ядро
- 25. БУДОВА АТОМА АТОМ ядро електорони е заряд - -1 протони нейтрони р заряд - +1 n
- 26. БУДОВА АТОМА ПОРЯДКОВИЙ НОМЕР ПРОТОННЕ ЧИСЛО (p) КІЛЬКІСТЬ ЕЛЕКТРОНІВ (e) = = №8 (ОКСИГЕН) 8 (З
- 27. На основі відкриття фізичного значення порядкового номера періодичний закон Д. І. Менделєєва нині формулюється так: властивості
- 28. Планетарну модель будови атома запропонував … Англійський вчений Ернест Резерфорд
- 29. Атом це … Електронейтральна частинка, що складається з позитивно зарядженого ядра та негативно заряджених електронів
- 30. Частинки з яких складається ядро атома називаються… Протонами та нейтронами. Загальна назва – нуклони.
- 31. 1 а.о.м. Маси протна і нейтрона приблизно дорівнюють (в а.о.м.) …
- 32. Загальне число протонів в ядрі атома елемента дорівнює його … Заряду ядра або порядковому номеру
- 33. Розрахувати кількість нейтронів можна за формулою… n = nu – p
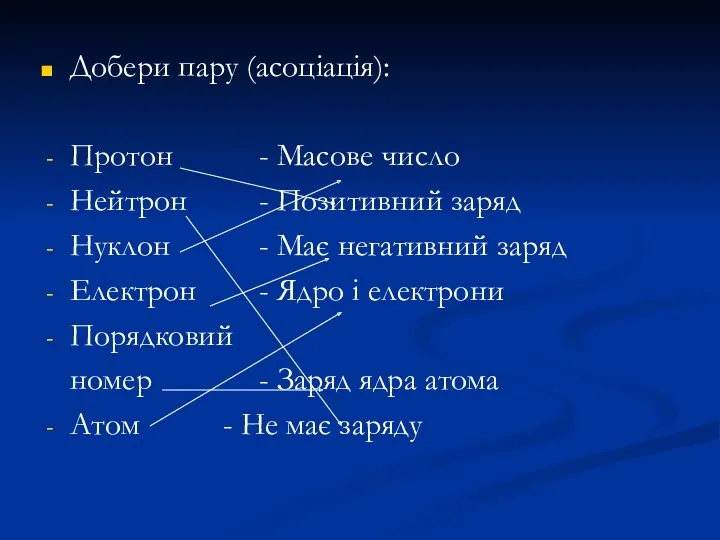
- 34. Добери пару (асоціація): Протон - Масове число Нейтрон - Позитивний заряд Нуклон - Має негативний заряд
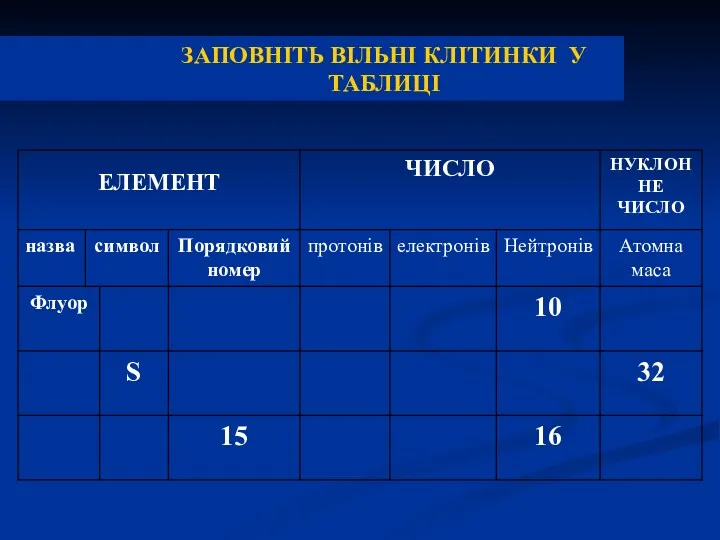
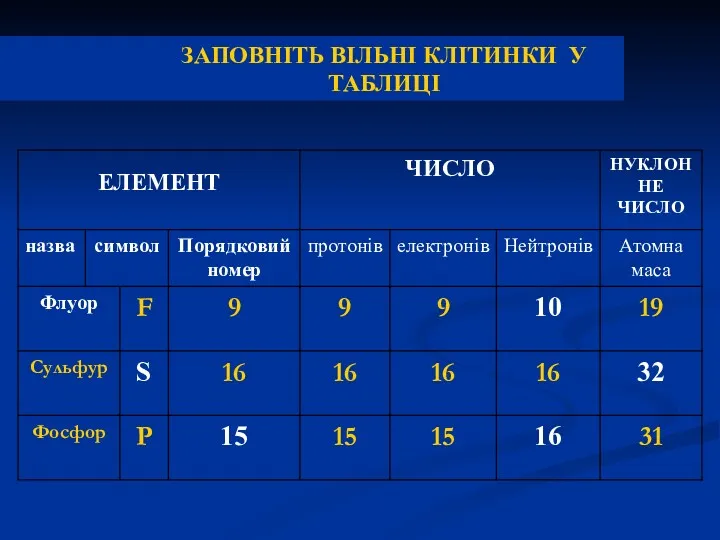
- 35. ЗАПОВНІТЬ ВІЛЬНІ КЛІТИНКИ У ТАБЛИЦІ
- 36. ЗАПОВНІТЬ ВІЛЬНІ КЛІТИНКИ У ТАБЛИЦІ
- 37. НА УРОЦІ Я. . . . ДІЗНАВСЯ . . . ЗРОЗУМІВ . . . НАВЧИВСЯ .
- 39. Скачать презентацию































 ВОДОРОД
ВОДОРОД Магматические породы и постмагматические процессы
Магматические породы и постмагматические процессы Количественное определение лекарственных веществ
Количественное определение лекарственных веществ Чистые вещества и смеси
Чистые вещества и смеси Вуглеводні. Лекція 11
Вуглеводні. Лекція 11 Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины
Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины Фенол и его свойства
Фенол и его свойства Химические свойства воды
Химические свойства воды Углеводы Cn(H2O)m
Углеводы Cn(H2O)m Атом - сложная частица
Атом - сложная частица Хлороводород. Соляная кислота
Хлороводород. Соляная кислота Зависимость биохимических изменений в мясе от условий хранения
Зависимость биохимических изменений в мясе от условий хранения Основные понятия и законы химии
Основные понятия и законы химии Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Электролиз
Электролиз Водородная связь
Водородная связь Фторопласт-4 (тефлон, політетрафлуоретен)
Фторопласт-4 (тефлон, політетрафлуоретен) Застосування неметалів
Застосування неметалів Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Углерод. Общая характеристика элементов подгруппы углерода
Углерод. Общая характеристика элементов подгруппы углерода Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс
Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс Контроль качества неорганических лекарственных средств элементов VII группы периодической системы Д. И. Менделеева
Контроль качества неорганических лекарственных средств элементов VII группы периодической системы Д. И. Менделеева Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019
Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019 Сероводород
Сероводород Пируватдегидрогеназный комплекс
Пируватдегидрогеназный комплекс Поширення та колообіг оксигену в природі
Поширення та колообіг оксигену в природі Спирты. Состав, строение спиртов
Спирты. Состав, строение спиртов Введение в геохимию
Введение в геохимию