Содержание
- 2. УМК «ХИМИЯ» Тема лекции: Электролиз Лектор – Иванов М.Г.
- 3. Цель лекции: изложение основных понятий электролиза водных растворов и расплав электролитовий в рамках современной химической теории
- 4. СОДЕРЖАНИЕ Основные понятия Электролиз расплавов электролитов Электролиз водных растворов электролитов Катодные процессы Поведение ионов металлов Перенапряжение
- 5. Основные понятия Электролиз – это совокупность окислительно-восстановительных процессов, которые протекают на электродах, помещенных в раствор или
- 6. содержание Е = -nF/ΔG Если ЭДС будет отрицательной, то самопроизвольное протекание ОВР становится невозможным. Основные понятия
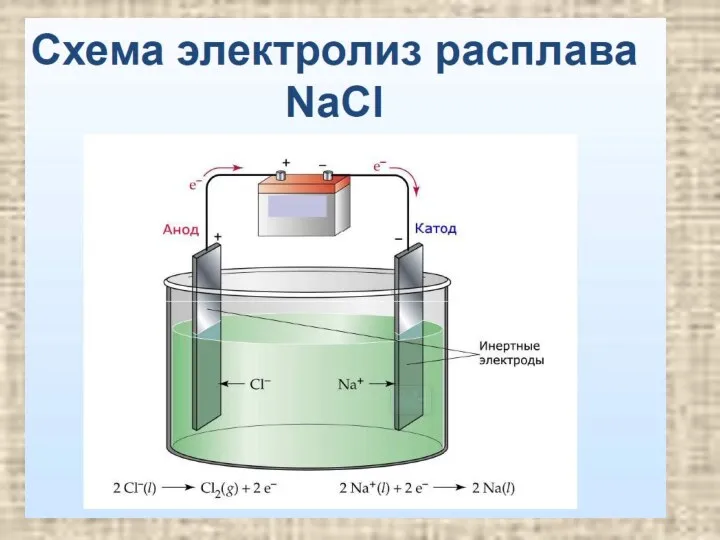
- 7. Электролиз расплавов электролитов содержание В простейших бинарных электролитах типа MeHal , MeHal2 (Me – металл IA
- 10. Электролиз расплавов электролитов содержание При электролизе расплава гидродифторида калия (анод – угольный, катод – никелевый) протекает
- 14. Катодные процессы На катоде идет процесс восстановления окислителя: содержание Ox + ne = Red Men+ +
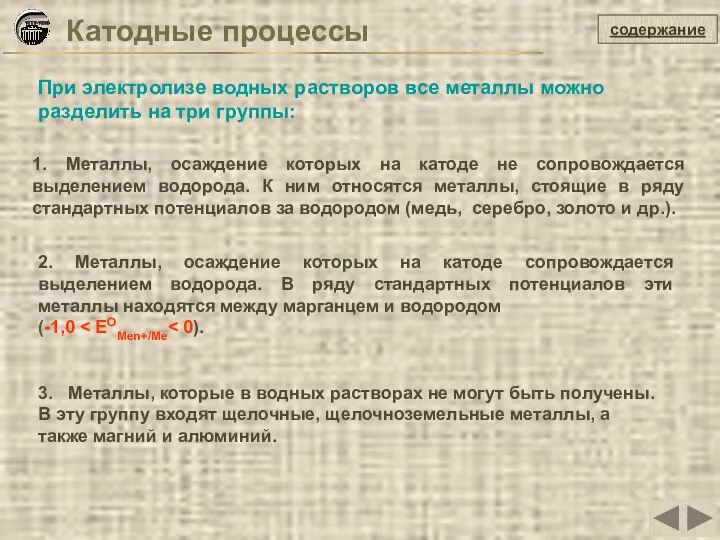
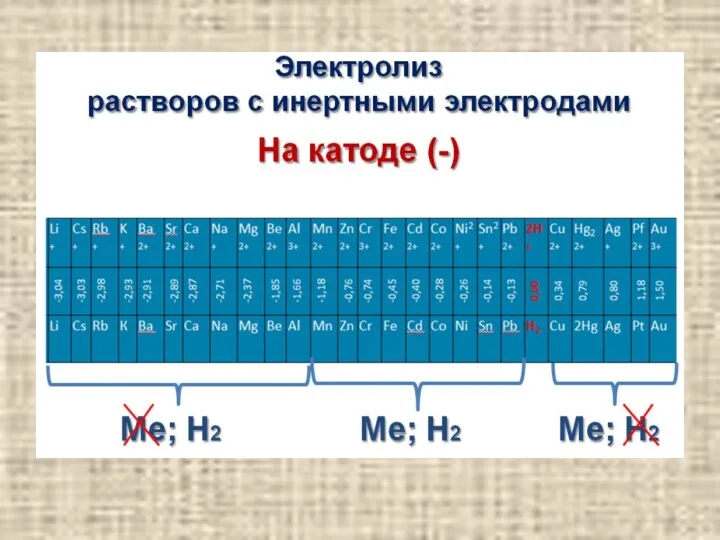
- 16. Катодные процессы содержание При электролизе водных растворов все металлы можно разделить на три группы: 1. Металлы,
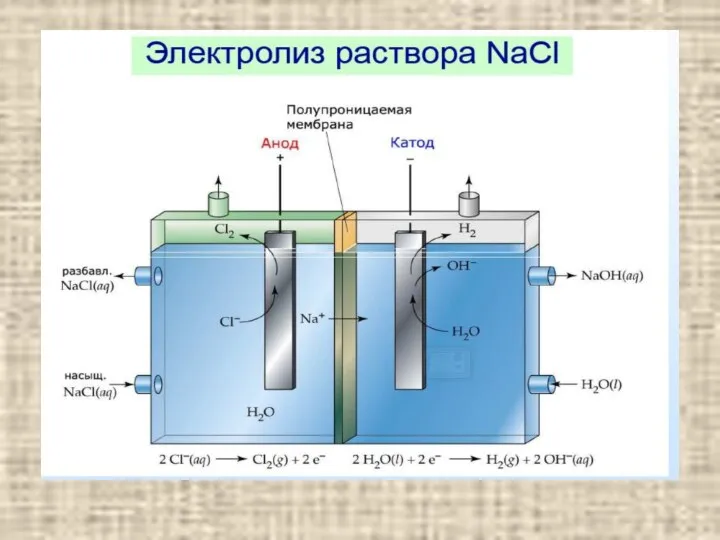
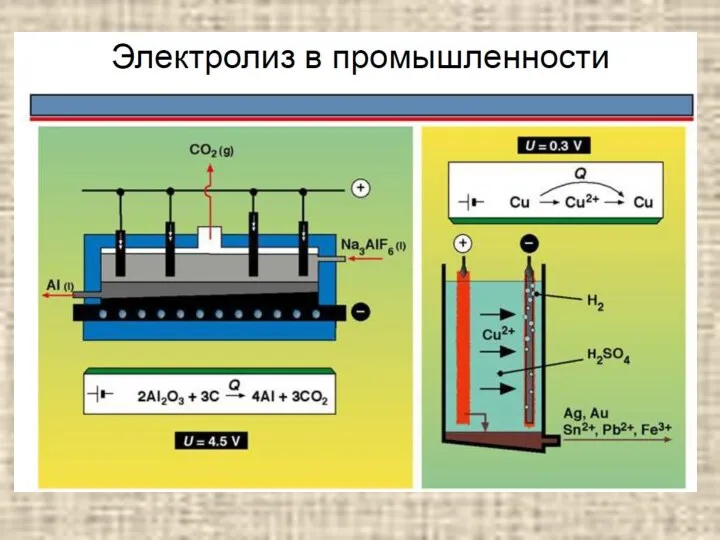
- 19. Электролиз с растворимым анодом содержание Электролиз с растворимым анодом используют для рафинирования некоторых металлов – меди,
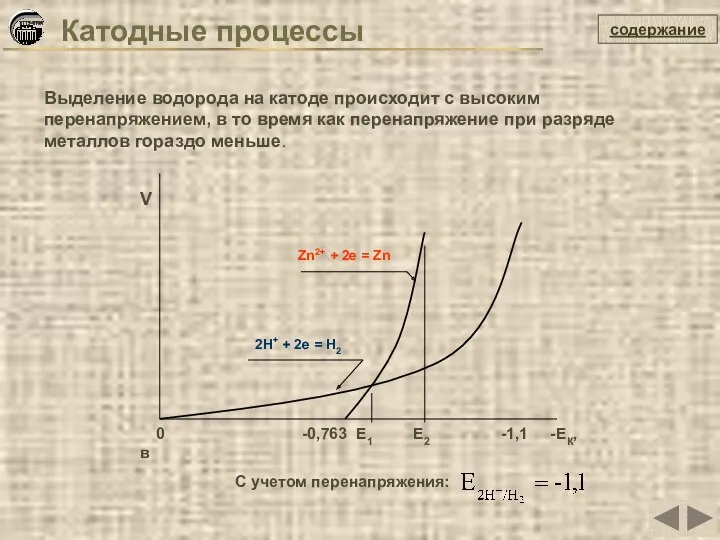
- 20. Катодные процессы содержание Выделение водорода на катоде происходит с высоким перенапряжением, в то время как перенапряжение
- 21. Анодные процессы содержание Red – ne = Ох На аноде идет процесс окисления восстановителя: 2Н2О –
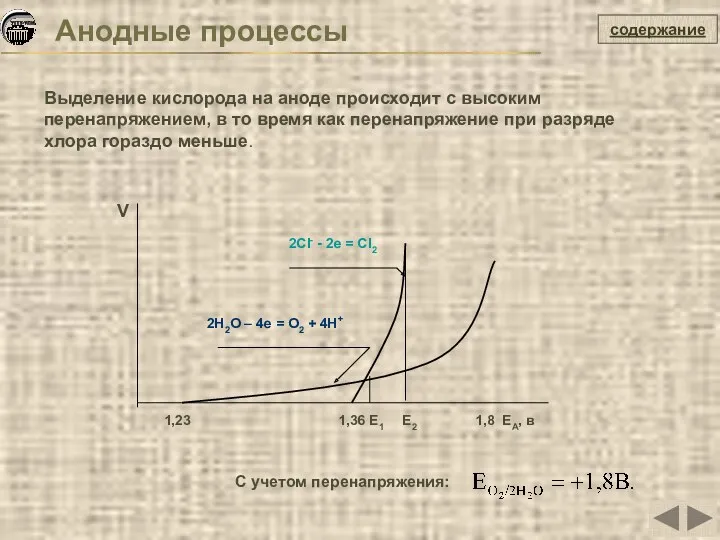
- 22. содержание С учетом перенапряжения: Выделение кислорода на аноде происходит с высоким перенапряжением, в то время как
- 23. содержание Анионы кислородсодержащих кислот SO42-, PO43-, NO3- и др., в которых центральный атом имеет высшую степень
- 24. содержание Пpи высоких анодных плотностях тока некотоpые анионы могут окисляться до пеpоксоанионов, напpимеp: 2SO42− − 2e
- 26. Законы электролиза содержание Установил (1833-1834) законы электролиза, названные его именем. Фарадей (Faraday) Майкл (1791-1867).
- 28. Законы электролиза содержание I закон. Масса вещества, окисленного на аноде или восстановленного на катоде, пропорциональна количеству
- 29. содержание Число Фарадея F - это фундаментальная постоянная, равная заряду одного моля электронов. F = e·NA
- 34. Скачать презентацию






















 Химические свойства металлов
Химические свойства металлов Молекулярно-кинетические свойства дисперсных систем
Молекулярно-кинетические свойства дисперсных систем Теория строения органических веществ. Предельные углеводороды. 9 класс
Теория строения органических веществ. Предельные углеводороды. 9 класс Межмолекулярные силы (силы Ван дер Ваальса)
Межмолекулярные силы (силы Ван дер Ваальса) Заттардың агрегаттық күйі
Заттардың агрегаттық күйі Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Классификация органических реакций
Классификация органических реакций Арени. Бензен: молекулярна і структурна формули, фізичні властивості
Арени. Бензен: молекулярна і структурна формули, фізичні властивості Історія хімії
Історія хімії F элементы
F элементы Аммиак: состав вещества, получение, применение, строение, свойства
Аммиак: состав вещества, получение, применение, строение, свойства Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Изучение состава чая
Изучение состава чая Содержание кислорода и углекислого газа в помещениях школы
Содержание кислорода и углекислого газа в помещениях школы Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку
Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку Реакции ионного обмена между растворами электролитов
Реакции ионного обмена между растворами электролитов Химическое загрязнение атмосферы
Химическое загрязнение атмосферы Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла
Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла Физико-химия дисперсных систем. Физико-химия поверхностных явлений
Физико-химия дисперсных систем. Физико-химия поверхностных явлений Золото и серебро
Золото и серебро Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Бензол. Физические и химические свойства
Бензол. Физические и химические свойства Металлы – простые вещества
Металлы – простые вещества 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Химические реакции. (8 класс)
Химические реакции. (8 класс) Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Виды присадок к моторным топливам. Бензин
Виды присадок к моторным топливам. Бензин Теоретические основы и технология первичной переработки нефти. Тема 4
Теоретические основы и технология первичной переработки нефти. Тема 4