Содержание
- 2. f-блок в периодической таблице элементов — электронная оболочка атомов, валентные электроны которых с наивысшей энергией занимают
- 4. f-Элементы делятся на лантаноиды и актиноиды. Лантаноиды – это 14 элементов, следующих за лантаном, у которых
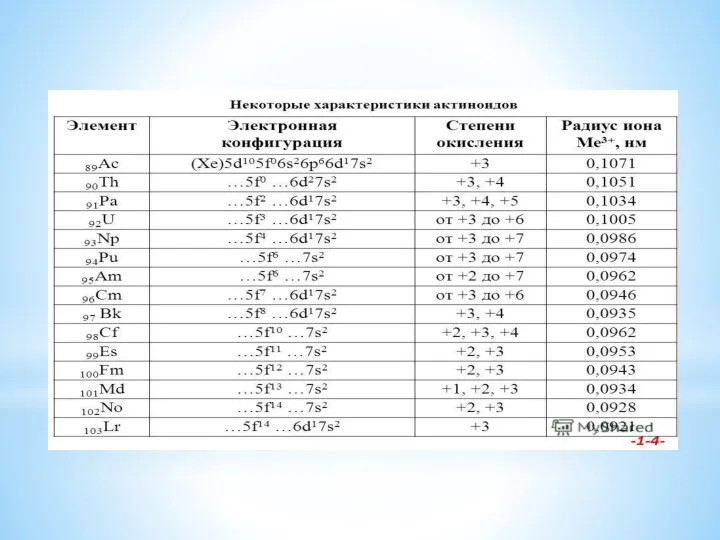
- 6. Устойчивость энергетических уровней 5f и 6d у актиноидов
- 7. Отличия актиноидов и лантаноидов что у актиноидов энергетические уровни 5f и 6d стабилизируются по мере возрастания
- 8. С водородом актиноиды образуют гидриды переменного состава (ThH2, Th4H15; PaH2–2,7; AmH2–2,7), но для урана можно получить
- 9. Особая устойчивость оксоионов объясняется тем, что связь между атомами актиноида и кислорода формально можно рассматривать как
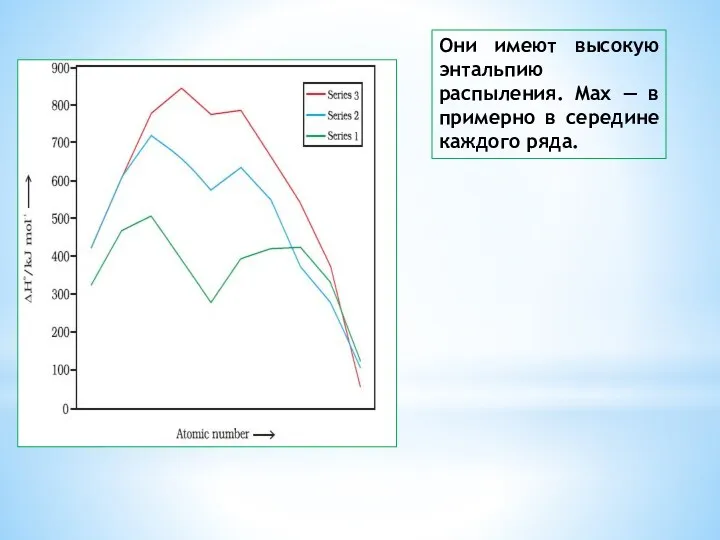
- 12. ТОЧКИ ПЛАВЛЕНИЯ И КИПЕНИЯ (ЭНТАЛЬПИИ РАСПЫЛЕНИЯ высокие температуры плавления и кипения. Большое число неспаренных электронов принимают
- 13. Они имеют высокую энтальпию распыления. Max — в примерно в середине каждого ряда.
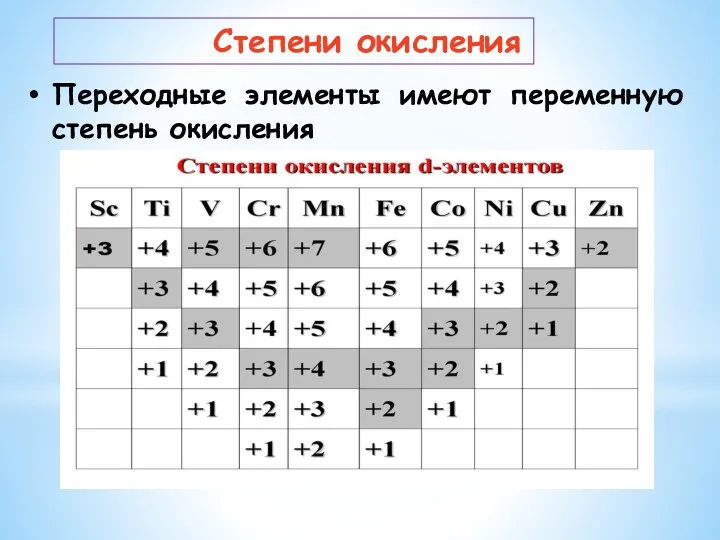
- 14. Переходные элементы имеют переменную степень окисления Степени окисления
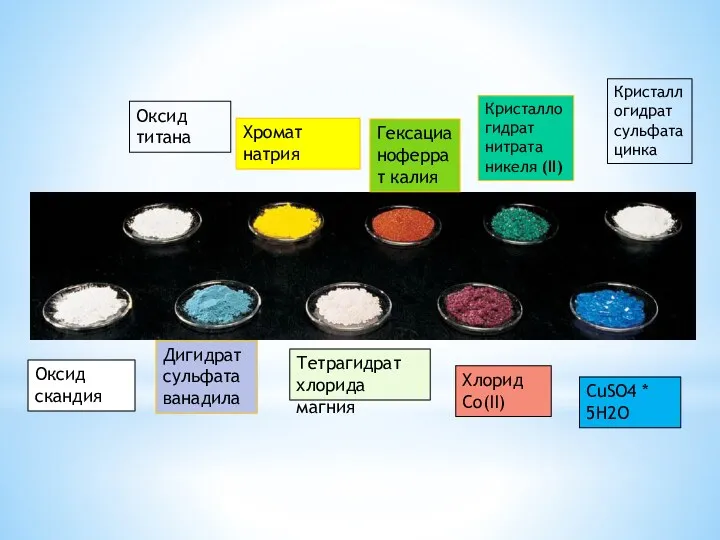
- 15. Большинство соединений переходных металлов (ионный а также ковалентные) окрашены как в твердом состоянии и в водном
- 16. Оксид скандия Дигидрат сульфата ванадила Оксид титана Хромат натрия Гексацианоферрат калия Кристаллогидрат нитрата никеля (II) Кристаллогидрат
- 17. Химические свойства d-элементов Сравнение d- и р-элементов в высших СО Группа р-элементы d-элементы VII VI V
- 18. VIIB Mn: II, IV, VI, VII TcRe (IV,V) VII VIB Cr: II, III, VI MoW (IV,
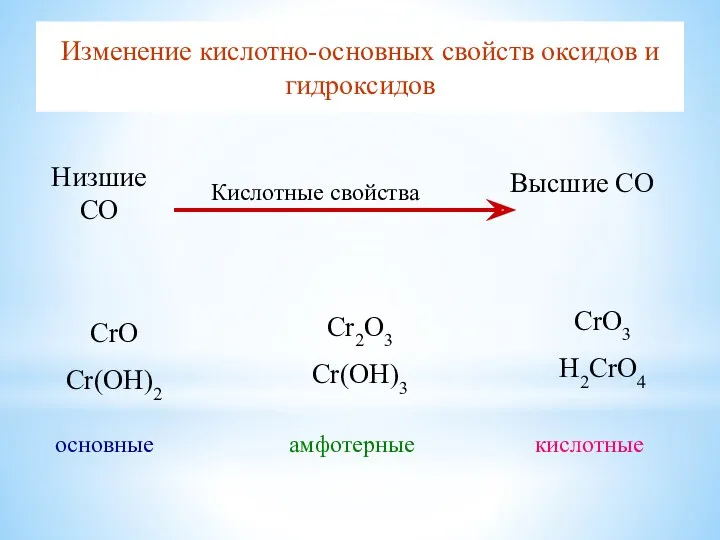
- 19. Изменение кислотно-основных свойcтв оксидов и гидроксидов CrO Cr(OH)2 основные Cr2O3 Cr(OH)3 CrO3 H2CrO4 амфотерные кислотные Низшие
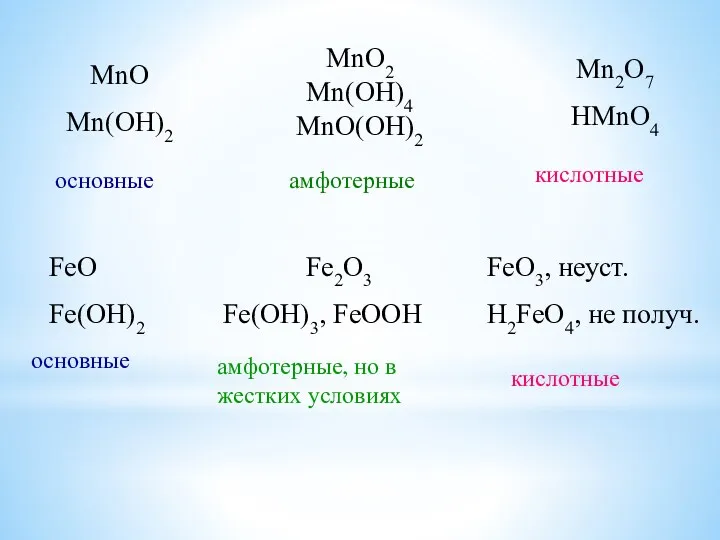
- 20. MnO Mn(OH)2 MnO2 Mn(OH)4 MnO(OH)2 Mn2O7 HMnO4 основные амфотерные кислотные FeO Fe(OH)2 Fe2O3 Fe(OH)3, FeOOH FeO3,
- 21. Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2O Cr(OH)3 + NaOH = Na[Cr(OH)4] тетрагидроксохромит натрия Cr2O3 +
- 22. Fe2O3 - обладает амфотерными свойствами, но в жестких условиях: Fe2O3 + HCl = FeCl3 + H2O
- 23. V2+, Cr2+… Ni2+…. Zn2+ Энергичные восстановители Окисляется только сильными окислителями V2+ Cr2+ Mn2+ Fe2+ … Ni2+
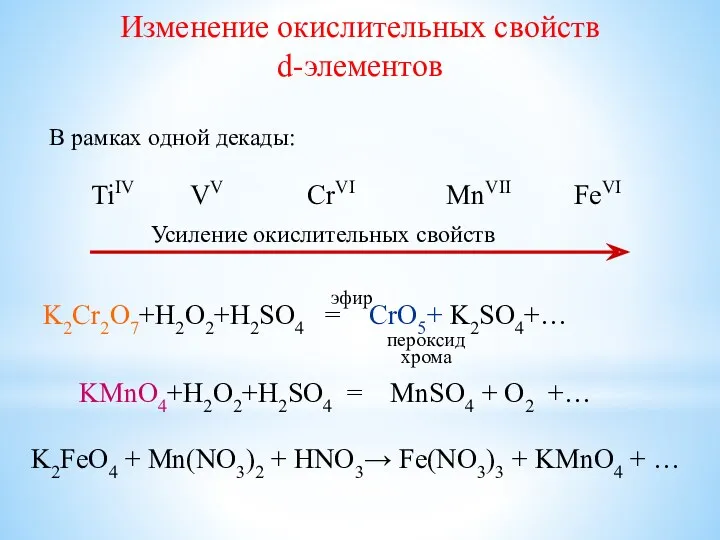
- 24. Изменение окислительных свойств d-элементов В рамках одной декады: TiIV VV CrVI MnVII FeVI Усиление окислительных свойств
- 25. Cr(OH)2 + H2O + O2 = Cr(OH)3 В степени +II соединения хрома являются сильными восстановителями: Cоли
- 26. Дихроматы и хроматы являются сильными окислителями: K2Cr2O7 + KJ + H2SO4 = J2 + Cr2(SO4)3 +
- 27. CoCl2 + 4KSCN → K2[Co(SCN)4] + 2KCl Эту способность используют: 1) для очистки d-элементов от примесей
- 28. РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ Li Cs Ca Na Mg Al Zn Fe Ni Pb H2 Cu Ag
- 29. Растворение металлов в кислотах и щелочах 1. Кислоты неокислители: HCl, H2SO4, HBr… Zn + HCl =
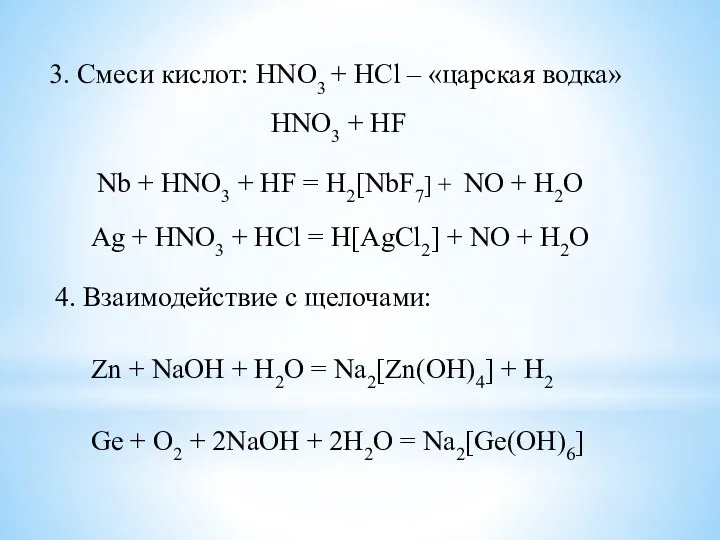
- 30. 3. Смеси кислот: HNO3 + HCl – «царская водка» HNO3 + HF Nb + HNO3 +
- 31. 5. Взаимодействие с гидратом аммиака: Zn + NH3·H2O = [Zn(NH3)4](OH)2 + H2↑ Cd + O2 +
- 32. 1. Пирометаллургия – окислительный обжиг сульфидов и восстановление металлов из оксидов при высокой температуре. Fe2O3 +
- 33. 3. Гидрометаллургия - выделение металлов из растворов их солей более активными металлами CdSO4 + Zn Cd↓+
- 34. Au + KCN + O2 + H2O = K[Au(CN)2] + KOH K[Au(CN)2] + Zn = K2[Zn(CN)4]
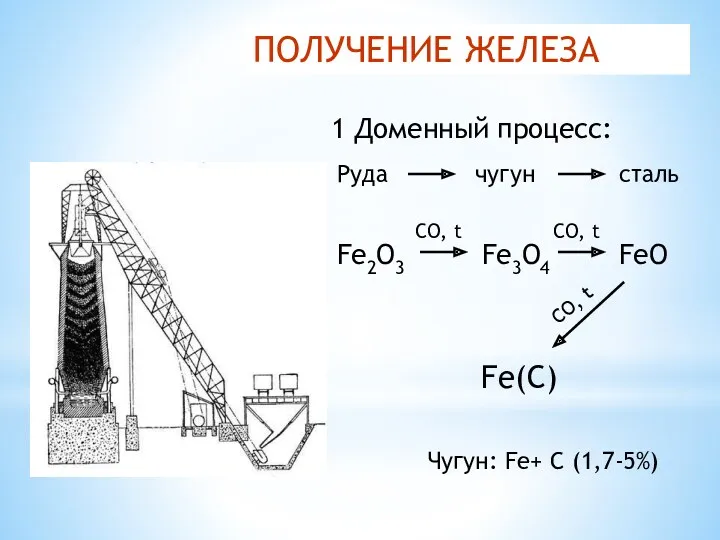
- 35. ПОЛУЧЕНИЕ ЖЕЛЕЗА 1 Доменный процесс: Руда чугун сталь Fe3O4 Fe2O3 CO, t CO, t FeO Fe(C)
- 36. 1. Разложение карбонильных комплексов (Ni, Co, Cr…) Fe + 5CO = Fe(CO)5 Порошок желтая жидкость пентакарбонил
- 38. Скачать презентацию


















![CoCl2 + 4KSCN → K2[Co(SCN)4] + 2KCl Эту способность используют:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/340690/slide-26.jpg)


2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/340690/slide-30.jpg)


![Au + KCN + O2 + H2O = K[Au(CN)2] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/340690/slide-33.jpg)

 Концентрация кобальта
Концентрация кобальта 20230205_metally_pobochnyh_podgrupp
20230205_metally_pobochnyh_podgrupp Непредельные углеводороды: общая характеристика
Непредельные углеводороды: общая характеристика Карбонаты. Классификация
Карбонаты. Классификация Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки. Складання формули сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки. Складання формули сполуки Основы химической термодинамики
Основы химической термодинамики Prezentatciya
Prezentatciya №9 зертханалық жұмыс
№9 зертханалық жұмыс Роль хімії у суспільстві
Роль хімії у суспільстві Облучение. Радиационная окраска
Облучение. Радиационная окраска Растворимость малорастворимого сильного электролита
Растворимость малорастворимого сильного электролита Растворы. Приготовление растворов
Растворы. Приготовление растворов Йод. Йодтың ашылуы
Йод. Йодтың ашылуы Радиусы атомов и ионов
Радиусы атомов и ионов История развития химии
История развития химии Оксид серы (IV). Сернистая кислота и её соли
Оксид серы (IV). Сернистая кислота и её соли Понятие Химический элемент
Понятие Химический элемент Теплота горения
Теплота горения Жиры и масла в косметическом производстве
Жиры и масла в косметическом производстве Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Функциональные производные с простой связью C-“Э”. Часть 2. Галогенпроизводные
Функциональные производные с простой связью C-“Э”. Часть 2. Галогенпроизводные Оценка химической обстановки при авариях на химически опасных объектах
Оценка химической обстановки при авариях на химически опасных объектах 20230306_oksidy
20230306_oksidy Аминокислоты 2
Аминокислоты 2 Углеводороды. Алканы
Углеводороды. Алканы Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Water vapor. Nitrous oxide. Aerosols
Water vapor. Nitrous oxide. Aerosols