Слайд 2

Растворимость –концентрация вещества в его насыщенном растворе.
Молярная растворимость S – число
молей растворенного вещества, содержащихся в 1 л насыщенного раствора (моль/л)
Массовая растворимость Cm – масса растворенного вещества, содержащаяся в 1 л насыщенного раствора (г/л)
Слайд 3

S < 1·10–4 малорастворимые электролиты
S < 1·10–2 среднерастворимые электролиты
S >
1·10–2 хорошо растворимые электролиты
Слайд 4
![ПРK(AmBn) = [A]m·[B]n = (mS)m·(nS)n = mmnnSm+n ПРK(AmBn) = mmnnSm+n](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-3.jpg)
ПРK(AmBn) = [A]m·[B]n = (mS)m·(nS)n = mmnnSm+n
ПРK(AmBn) = mmnnSm+n
Слайд 5

Малорастворимый электролит AmBn в воде:
I < 10−4 ≈ 0, f =
1
Тогда:
Слайд 6
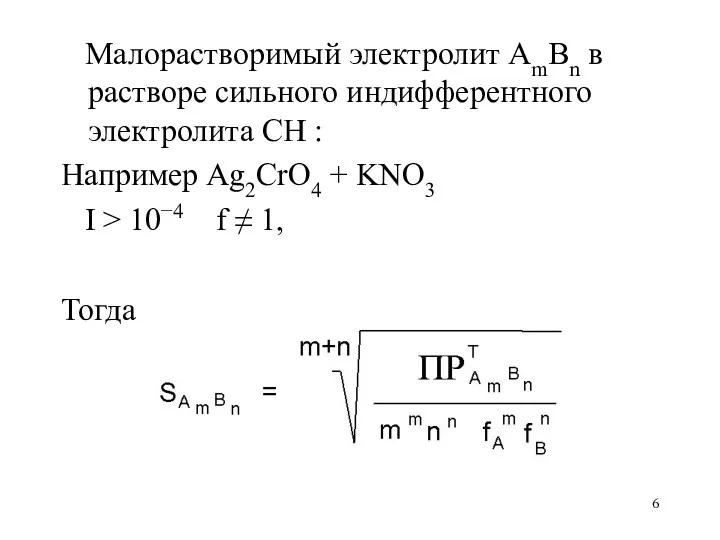
Малорастворимый электролит AmBn в растворе сильного индифферентного электролита CH :
Например
Ag2CrO4 + KNO3
I > 10−4 f ≠ 1,
Тогда
Слайд 7

Солевой эффект проявляется в увеличении растворимости малорастворимого сильного электролита с увеличением
ионной силы раствора
(разные сильные электролиты, прилитые в одинаковом количестве, дают разный солевой эффект)
Слайд 8

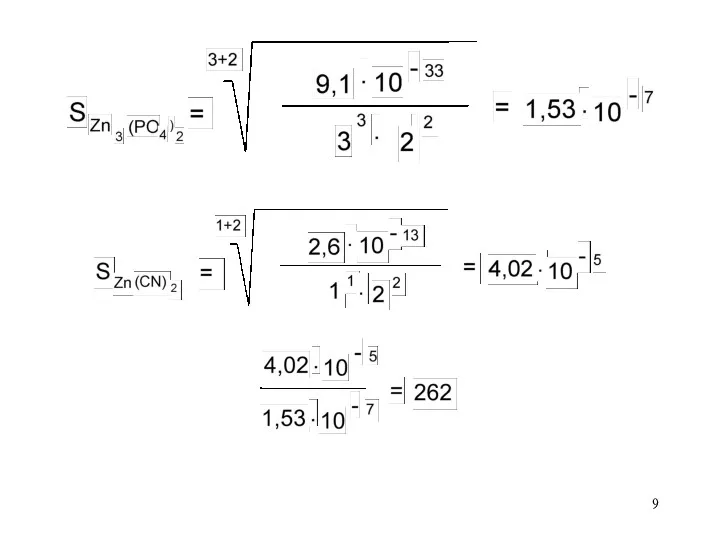
Задача: Какая соль более растворима в воде: фосфат цинка или цианид
цинка, и во сколько раз?
Решение: Zn3(PO4)2 Zn(CN)2
m=3 m=1
n=2 n= 2
ПР = 9,1·10–33 ПР = 2,6·10–13
Слайд 9
Слайд 10

Задача: Вычислить растворимость Ag2CrO4 в чистой воде, в 0,01 М растворе
NaNO3 и 0,01 М растворе Na3PO4.
Решение:
В чистой воде I ≈ 0, f = 1
Слайд 11

Ag2CrO4
m=2
n=1
ПР=1,1·10–12
Слайд 12

в растворе 0,01 М NaNO3 I = 0,01 моль/л
f(Ag) = 0,898
f(CrO4) = 0,660
Слайд 13

в растворе 0,01 М Na3PO4
Na3PO4 → 3Na+ + PO3–
0,01 0,03 0,01
I = ½(0,03 · 12 + 0,01 · 32) = 0,045 ≈ 0,05 (M)
f(Ag) = 0,80 f(CrO4) = 0,445
Слайд 14

Растворимость Ag2CrO4
в чистой воде 6,50 ·10–5
в 0,01 М NaNO3
8,02 ·10–5 (1,23↑)
в 0,01 М Na3PO4 9,85 ·10–5 (1,52↑)
Слайд 15

Задача: Сколько г роданида серебра раство-ряется в 250 мл воды? ПР(AgSCN)
= 1,1 ·10–12
Решение.
1. Найдем растворимость AgSCN в чистой воде
2. Найдем массу растворившегося AgSCN в
250 мл раствора
Слайд 16

Слайд 17

Растворимость малорастворимого электролита в присутствии
одноименных ионов
Слайд 18

AmBn + AC (AgCl + AgNO3)
AmBn + DB (AgCl + KCl)
Слайд 19
![ПРK(AmBn) = [A]m·[B]n = [A]m·(nS)n = nn · Sn ·](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-18.jpg)
ПРK(AmBn) = [A]m·[B]n = [A]m·(nS)n =
nn · Sn ·
[A]m
ПРK(AmBn) = nn · Sn · [A]m
Слайд 20
![ПРK(AmBn) = [A]m·[B]n = [B]n · (mS)m = mm ·](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-19.jpg)
ПРK(AmBn) = [A]m·[B]n = [B]n · (mS)m =
mm ·
Sm · [B]n
ПРK(AmBn) = mm · Sm · [B]n
Слайд 21

Задача. Вычислить растворимость гидроксида железа(III) в чистой воде и 0,025 М
растворе гидроксида натрия.
Решение. В чистой воде:
Fe(OH)3 ПР = 6,3 ·10–38
m = 1
n = 3
Слайд 22

В 0,025 М растворе NaOH
I = 0,025 M fFe= 0,325 fOH
= 0,855
Ответ: 2,9 ·10–10
1,9 ·10–32
Слайд 23

Условие образования осадков малорастворимых электролитов
Слайд 24

ИП > ПР осадок выпадет
ИП < ПР осадок не
выпадет
ИП = ПР система в состоянии
равновесия
AmBn
ПР = [A]m · [B]n для насыщенного раствора
ИП = [A]m · [B]n для данного раствора
ИП = ПК
ИП – ионное произведение
ПК – произведение концентраций
Слайд 25

Задача. Выпадет ли осадок при смешивании 10 мл 0,01 М раствора
CaCl2 и 5 мл 0,05 М раствора K2CrO4.
Решение.
CaCl2 + K2CrO4 → CaCrO4↓ + 2KCl
ИП(CaCrO4) ? ПР(CaCrO4)
ИП(CaCrO4) = [Ca] · [CrO4]
C(Ca) = ?
С(CrO4) = ?
Слайд 26

C(CaCl2)1· V1 0,01 · 10
С(CaCl2) = ————— =
———— = 6,7·10–3 M
V2 15
Т.к. CaCl2 → Ca + 2Cl
C(Ca) = С(CaCl2) = 6,7·10–3 M
C(CrO4)1· V1 0,05 · 5
С(K2CrO4) = ————— = ———— = 1,7·10–2 M
V2 15
Т.к. K2CrO4 → 2K + CrO4
C(CrO4) = С(K2CrO4) = 1,7·10–2 M
Слайд 27
![ИП(CaCrO4) = [Ca] · [CrO4] ИП(CaCrO4) = 6,7·10–3 · 1,7·10–2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-26.jpg)
ИП(CaCrO4) = [Ca] · [CrO4]
ИП(CaCrO4) = 6,7·10–3 · 1,7·10–2 =
1,1·10–4
ПР(CaCrO4) = 7,1·10–4
ИП(CaCrO4) ? ПР(CaCrO4)
1,1·10–4 < 7,1·10–4
Ответ: Осадок не выпадет.
Слайд 28

Задача. Образуется ли осадок гидроксида кальция, если смешать равные объемы 0,03
М раствора CaCl2 и 0,05 М раствора NaOH.
Решение.
CaCl2 + 2NaOH → Ca(OH)2↓ + 2NaCl
ИП(Ca(OH)2) = [Ca] · [OH]2
C(CaCl2)1· V1 0,03 · x
С(CaCl2) = ————— = ———— = 0,015 M
V2 2 x
C(Ca) = 0,015 M
Слайд 29
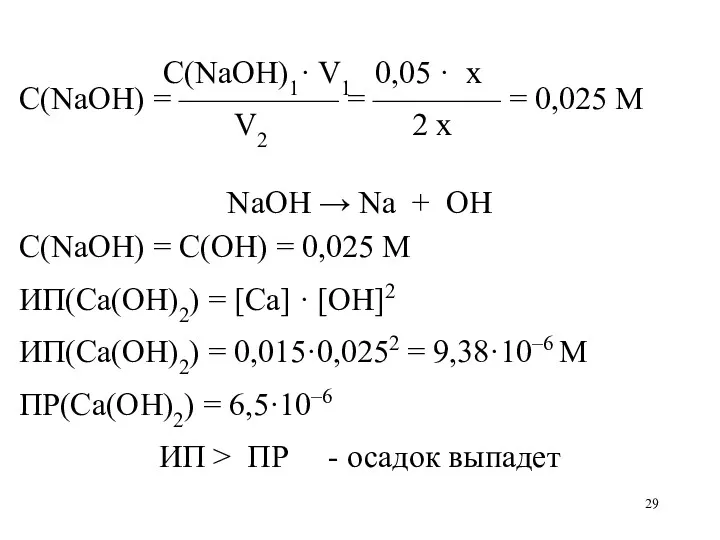
C(NaOH)1· V1 0,05 · x
С(NaOH) = ————— = ———— = 0,025
M
V2 2 x
NaOH → Na + OH
С(NaOH) = C(OH) = 0,025 M
ИП(Ca(OH)2) = [Ca] · [OH]2
ИП(Ca(OH)2) = 0,015·0,0252 = 9,38·10–6 M
ПР(Ca(OH)2) = 6,5·10–6
ИП > ПР - осадок выпадет
Слайд 30

Задача. Образуется ли осадок гидроксида кальция, если смешать равные объемы 0,03
М раствора CaCl2 и 0,05 М раствора аммиака.
Решение.
CaCl2 + 2NH4OH → Ca(OH)2↓ + 2NH4Cl
ИП(Ca(OH)2) = [Ca] · [OH]2
C(CaCl2)1· V1 0,03 · x
С(CaCl2) = ————— = ———— = 0,015 M
V2 2 x
C(Ca) = 0,015 M
Слайд 31

C(NH4OH)1· V1 0,05 · x
С(NH4OH) = —————— = ————
= 0,025 M
V2 2 x
NH4OH → NH4 + OH α < 3%
С(NH4OH) ≠ C(OH) ≠ 0,025 M Kосн = 1,76·10–5
Слайд 32
![ИП(Ca(OH)2) = [Ca] · [OH]2 ИП(Ca(OH)2) = 0,015·(6,63·10–4 )2 =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-31.jpg)
ИП(Ca(OH)2) = [Ca] · [OH]2
ИП(Ca(OH)2) = 0,015·(6,63·10–4 )2 =
= 6,59·10–9
M
ПР(Ca(OH)2) = 6,5·10–6
ИП < ПР - осадок не выпадет
Слайд 33

Задача. При какой концентрации ионов кальция будет образовываться осадок гидроксида кальция
из раствора с рН = 9.
Решение.
ПР(Ca(OH)2) = [Ca] · [OH]2 = 6,5·10–6
ПР(Ca(OH)2)
[Ca] = ——————
[OH]2
[OH] = 10–pOH
т.к. pH + pOH = 14 ⇒ pOH = 14 – 9 = 5
Слайд 34
![ПР(Ca(OH)2) 6,5·10–6 [Ca] = —————— = ———— = 6,5·103 [OH]2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-33.jpg)
ПР(Ca(OH)2) 6,5·10–6
[Ca] = —————— = ———— = 6,5·103
[OH]2 (10 –5)2
Ответ: При рН=9 осадок Ca(OH)2 выпадет, если концентрация Ca2+ будет 6,5·103 М и выше.
Слайд 35

Задача. При каком значении рН начнется образование осадка Zn(OH)2 из 0,01
М раствора хлорида цинка.
Решение.
ПР(Zn(OH)2) = [Zn] · [OH]2 = 1,4·10–17
Слайд 36
![pOH = – lg[OH] = – lg 3,74·10–8 = 7,43](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-35.jpg)
pOH = – lg[OH] = – lg 3,74·10–8 = 7,43
т.к.
pH + pOH = 14
pH = 14 – 7,43 = 6,57
Ответ: При рН = 6,57 выпадет Zn(OH)2 из
0,01 М раствора хлорида цинка.
Слайд 37

Перевод малорастворимого осадка в раствор
Mg(OH)2↓ → Mg2+ + 2OH–
+
2HCl
→ 2Cl– + 2H+
↓↑
2H2O
Mg(OH)2↓ → Mg2+ + 2OH–
+
2NH4Cl → 2Cl– + 2NH4+
↓↑
2NH4OH
Слайд 38

Перевод одного малорастворимого электролита в другой
Ag2CrO4↓ → 2Ag+ + CrO42–
+
2KCl → 2Cl– + 2K+
↓↑
2AgCl ↓
ПР(AgCl) = 1,78·10–10 S(AgCl) = 1,33·10–5
ПР(Ag2CrO4) = 3,5·10–11 S(Ag2CrO4) = 2,06·10–4
Слайд 39

Перевод СaSO4,,, SrSO4 , BaSO4 в карбонаты:
Реакция
идет слева направо практически до
конца, т.к.
ПР(CaCO3) = 4,8·10–9 много <
ПР(CaSO4) = 2,37·10–5
Слайд 40

Реакция
идет труднее, т.к. разность между
ПР(SrCO3) = 1,1·10–10 и ПР(SrSO4) =
3,2·10–7 значительно меньше, чем в предыдущей реакции
Слайд 41

Реакция
BaSO4 ↓ + Na2CO3 → BaCO3 ↓ + Na2SO4
сама по себе
не идет, т.к. слабая угольная кислота не
может вытеснить из солей более сильную серную
кислоту и к тому же S(BaSO4) = 1,05·10–5 меньше
S(BaCO3) = 7,14·10–5
ПР(BaSO4) = 1,1·10–10 ПР(BaCO3) = 5,1·10–9
Однако если, учитывая закон действующих масс, действовать на осадок BaSO4 большим избытком Na2CO3, то можно вызвать смещение равновесия слева направо и получить осадок BaCO3
Слайд 42

Осадок BaCO3 образуется тогда, когда ПР его будет превышенным, т.е.
[Ba2+][CO3 2–]
> ПР(BaCO3)
Здесь концентрация [Ba2+] определяется растворимостью BaSO4 и равна:
ПР(BaSO4)
[Ba2+] = —————
[SO4 2–]
Если увеличивать концентрацию только [CO3 2–]
и добиваться, чтобы
ПР(BaSO4) ПР(BaCO3)
————— > —————
[SO4 2–] [CO3 2–]
Слайд 43
![или [CO3 2–] ПР(BaCO3) ————— > ————— [SO4 2–] ПР(BaSO4)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-42.jpg)
или
[CO3 2–] ПР(BaCO3)
————— > —————
[SO4 2–] ПР(BaSO4)
тогда
[CO3 2–] 5,1·10–9
————— > ————— = 46,4
[SO4 2–] 1,1·10–10
Т. обр., чтобы превращение BaSO4 в BaCO3
происходило, необходимо, чтобы концентрация [CO3 2–] в растворе была в 46,4 раза больше
[SO4 2–].


![ПРK(AmBn) = [A]m·[B]n = (mS)m·(nS)n = mmnnSm+n ПРK(AmBn) = mmnnSm+n](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-3.jpg)














![ПРK(AmBn) = [A]m·[B]n = [A]m·(nS)n = nn · Sn ·](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-18.jpg)
![ПРK(AmBn) = [A]m·[B]n = [B]n · (mS)m = mm ·](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-19.jpg)






![ИП(CaCrO4) = [Ca] · [CrO4] ИП(CaCrO4) = 6,7·10–3 · 1,7·10–2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-26.jpg)




![ИП(Ca(OH)2) = [Ca] · [OH]2 ИП(Ca(OH)2) = 0,015·(6,63·10–4 )2 =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-31.jpg)

![ПР(Ca(OH)2) 6,5·10–6 [Ca] = —————— = ———— = 6,5·103 [OH]2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-33.jpg)

![pOH = – lg[OH] = – lg 3,74·10–8 = 7,43](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-35.jpg)






![или [CO3 2–] ПР(BaCO3) ————— > ————— [SO4 2–] ПР(BaSO4)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/291430/slide-42.jpg)
 Равновесие в растворах электролитов
Равновесие в растворах электролитов Генетическая связь между основными классами неорганических веществ
Генетическая связь между основными классами неорганических веществ Электролитическая диссоциация. Степень и константа диссоциации
Электролитическая диссоциация. Степень и константа диссоциации Классификация химических реакций по тепловому эффекту
Классификация химических реакций по тепловому эффекту 20230419_osnovaniya
20230419_osnovaniya Фенолы
Фенолы Строение и свойства металлов и сплавов. Тема 1
Строение и свойства металлов и сплавов. Тема 1 Introduction to effective permeability and relative permeability
Introduction to effective permeability and relative permeability Циклоалканы. Предельные углеводороды
Циклоалканы. Предельные углеводороды Carbohydrate metabolism
Carbohydrate metabolism Комплексные (или координационные) соединения
Комплексные (или координационные) соединения Виртуозы химического эксперимента
Виртуозы химического эксперимента Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья
Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья Химические свойства альдегидов
Химические свойства альдегидов Химия и косметика
Химия и косметика 20230419_soli
20230419_soli Полимеры и пластические массы
Полимеры и пластические массы Каменный уголь. Физические и химические свойства
Каменный уголь. Физические и химические свойства Alternative fuel
Alternative fuel Обезвреживающая функция печени
Обезвреживающая функция печени Атом құрылысы
Атом құрылысы Теорія горіння та вибуху
Теорія горіння та вибуху Щелочные металлы
Щелочные металлы Поверхностный мембранный потенциал. Равновесие Доннана
Поверхностный мембранный потенциал. Равновесие Доннана Цинк и его соединения
Цинк и его соединения Органические соединения серы
Органические соединения серы Бережём планету вместе. Нефть
Бережём планету вместе. Нефть Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей