Содержание
- 2. Общая формула - СnH2n Циклоалканы – это углеводороды, в которых все атомы углерода замкнуты в цикл.
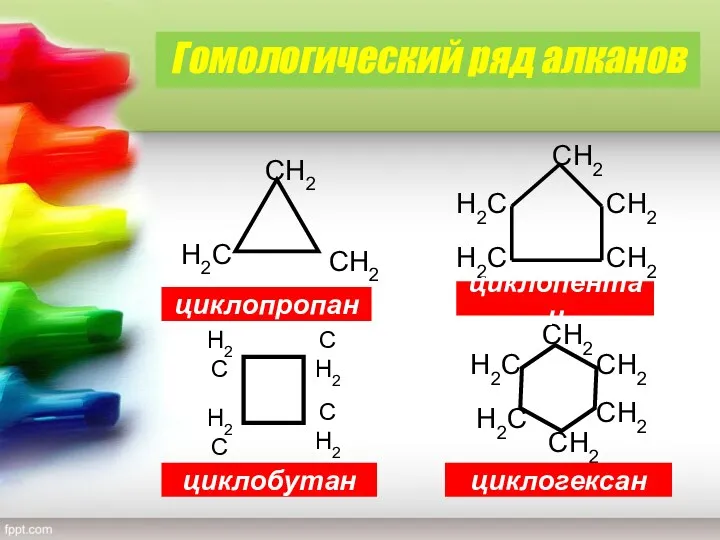
- 3. циклопропан циклобутан циклопентан циклогексан Гомологический ряд алканов
- 4. Строение молекул Гибридизация sp3
- 5. Строение молекул Сходство с предельными углеводородами: Каждый атом углерода в циклоалканах находится в состоянии sp3-гибридизации и
- 6. Строение молекул Отличие от предельных: Углы между связями зависят от размера цикла: чем меньше цикл, тем
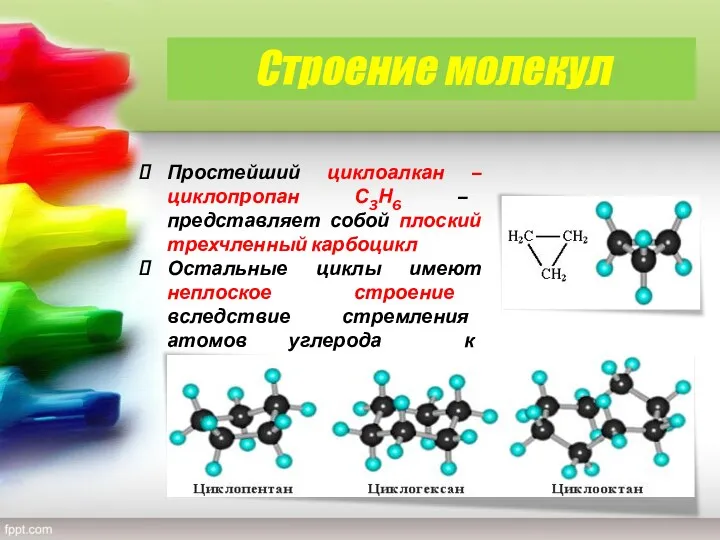
- 7. Строение молекул Простейший циклоалкан – циклопpопан С3Н6 – представляет собой плоский трехчленный карбоцикл Остальные циклы имеют
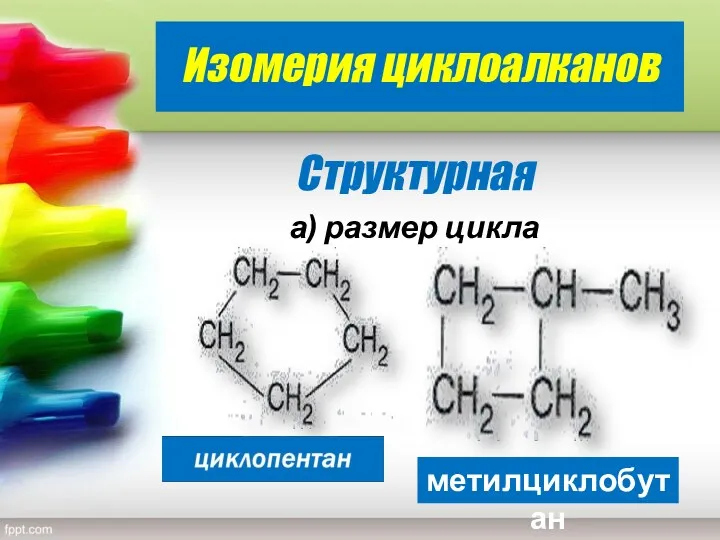
- 8. Изомерия циклоалканов Структурная а) размер цикла метилциклобутан
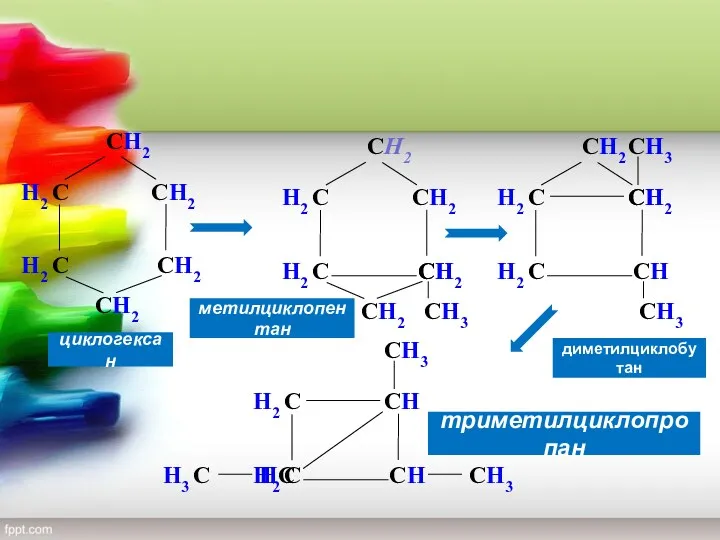
- 9. СH2 СH2 СH2 H2 С H2 С СH2 СH2 H2 С H2 С СH2 СH2 СH2
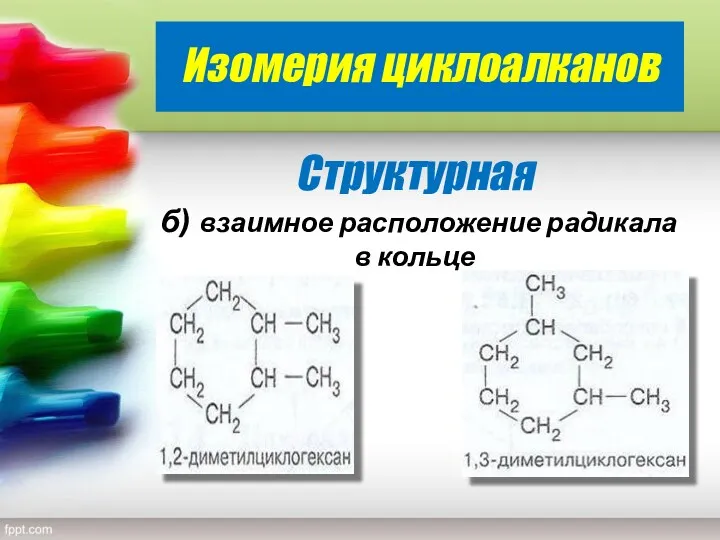
- 10. Изомерия циклоалканов Структурная б) взаимное расположение радикала в кольце
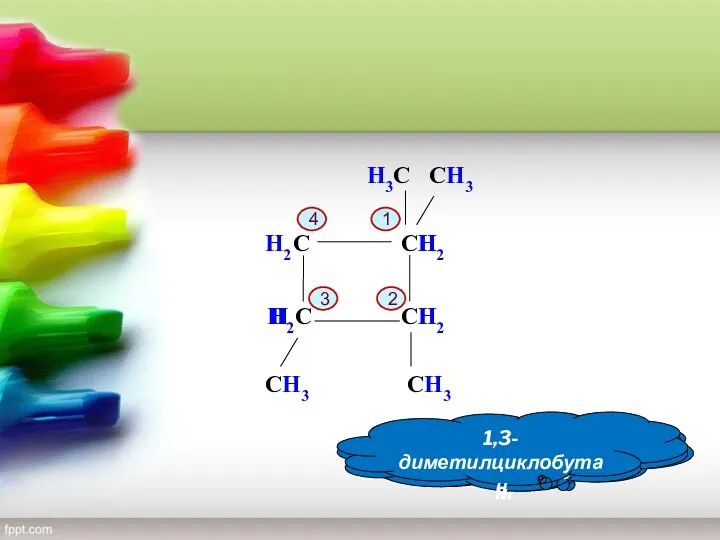
- 11. С С С С H3С СH3 1,1-диметилциклобутан 4 3 2 1 СH3 СH3 H2 H H2
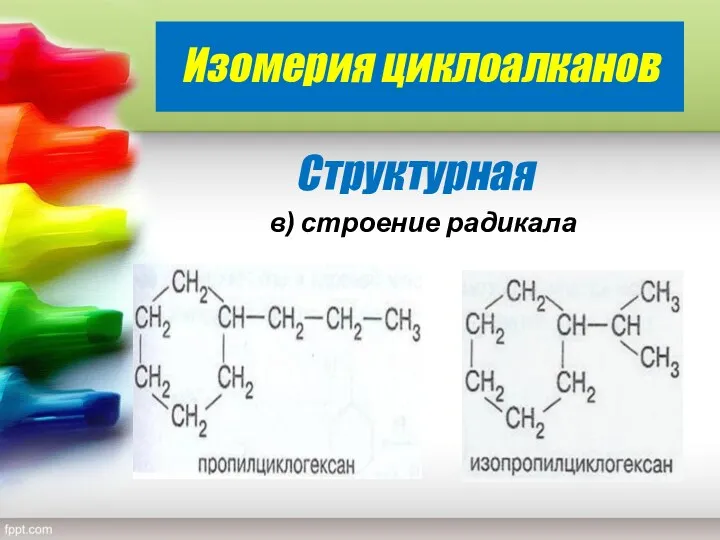
- 12. Изомерия циклоалканов Структурная в) строение радикала
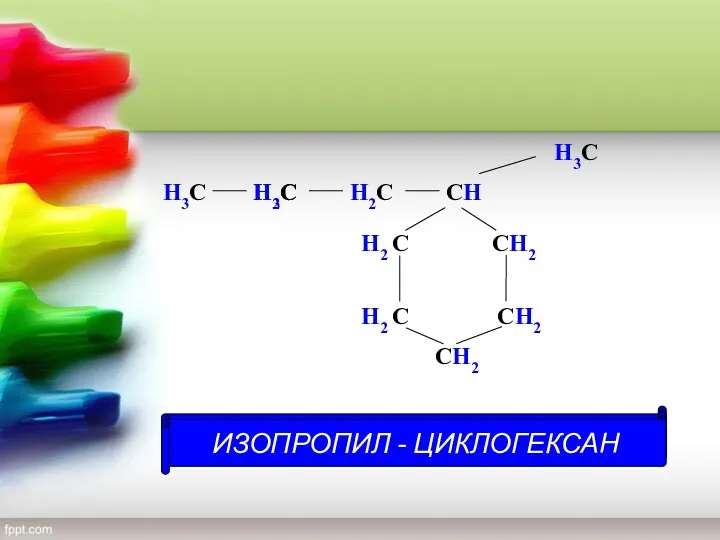
- 13. С СH2 СH2 H2 С H2 С СH2 H2С H2С H3С H H3С H3С Н -
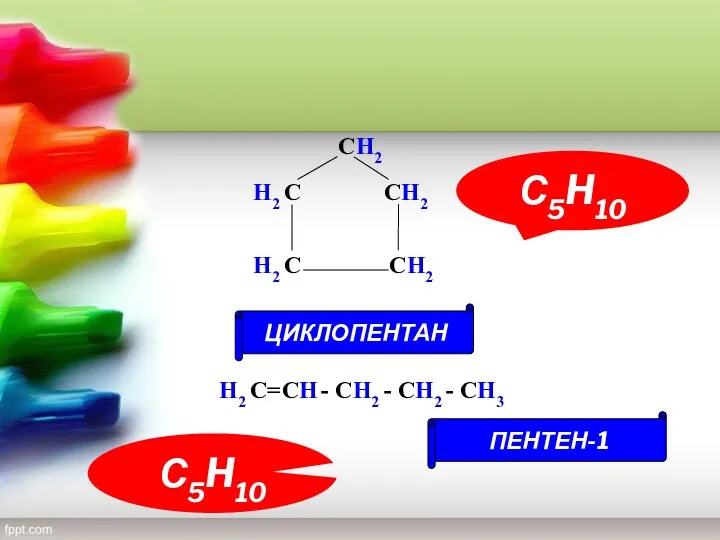
- 14. Изомерия циклоалканов Структурная г) межклассовая Циклоалканы Сn H2n Алкены Сn H2n Имеют одну молекулярную формулу, но
- 15. H2 С H2 С СH2 СH2 СH2 С5H10 С5H10 ЦИКЛОПЕНТАН ПЕНТЕН-1
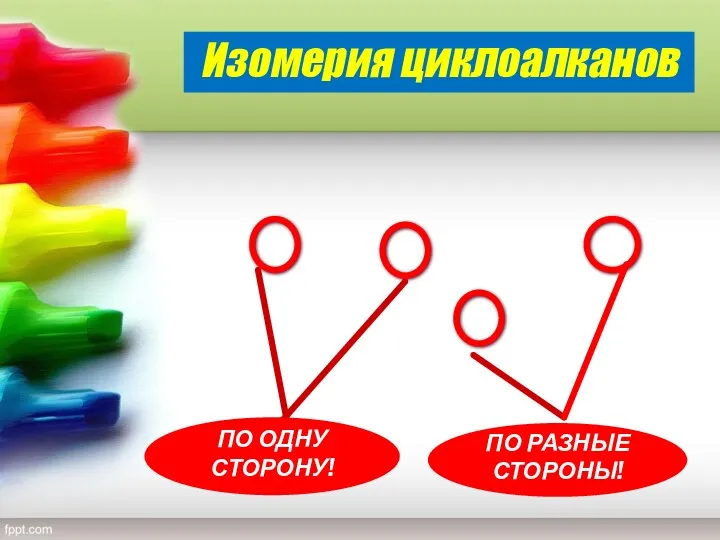
- 16. Изомерия циклоалканов Пространственная изомерия (геометрическая цис-транс-изомерия) у некоторых замещённых циклоалканов объясняется отсутствием свободного вращения вокруг связей
- 17. Изомерия циклоалканов ПО РАЗНЫЕ СТОРОНЫ! ПО ОДНУ СТОРОНУ!
- 18. Нахождение в природе Циклоалканы главным образом находятся в составе некоторых нефти. Отсюда и другое название циклоалканов
- 19. ФИЗИЧЕСКИЕ СВОЙСТВА Температура кипения и плавления циклоалканов выше, чем у алканов с равным количеством атомов углерода
- 20. Химические СВОЙСТВА Химические свойства циклопарафинов зависят от числа атомов углерода, составляющих цикл. Низшие циклоалканы (циклопропан и
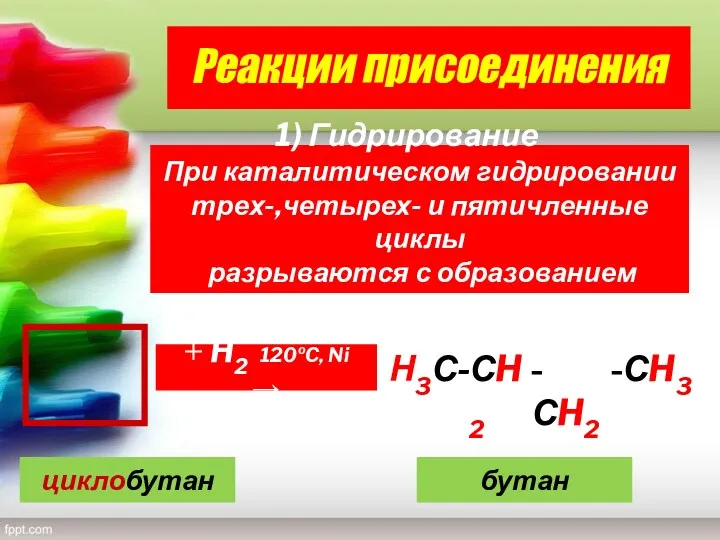
- 21. Реакции присоединения Гидрирование При каталитическом гидрировании трех-,четырех- и пятичленные циклы разрываются с образованием алканов + H2
- 22. Реакции присоединения 2) Галогенирование Трехчленный цикл при галогенировании разрывается, присоединяя атомы галогена + Br2 → BrCH2–CH2–CH2Br
- 23. Реакции присоединения 3) Гидрогалогенирование Циклопропан и его гомологи взаимодействуют с галогеноводородами с разрывом цикла. + HBr
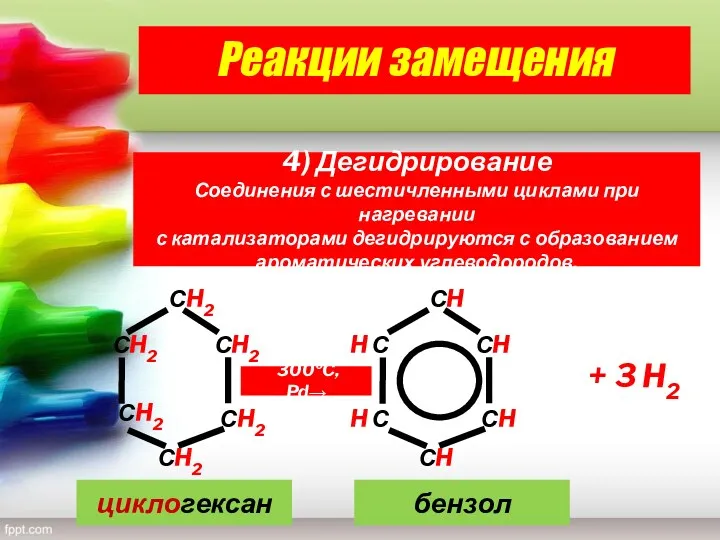
- 24. СH2 СH2 СH2 СH2 СH2 СH2 СH СH СH СH H С H С 300ºC, Pd→
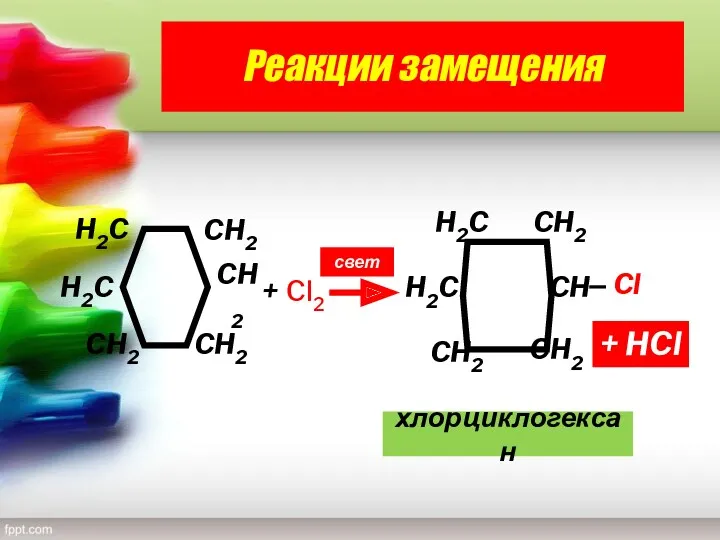
- 25. Реакции замещения свет + HCl
- 26. Реакция горения свет Полное окисление (горение) с образованием воды и углекислого газа 2 С5Н10 + 15
- 27. Получение 1) Из нефти При переработке нефти выделяют главным образом циклоалканы С5 - С7 I. В
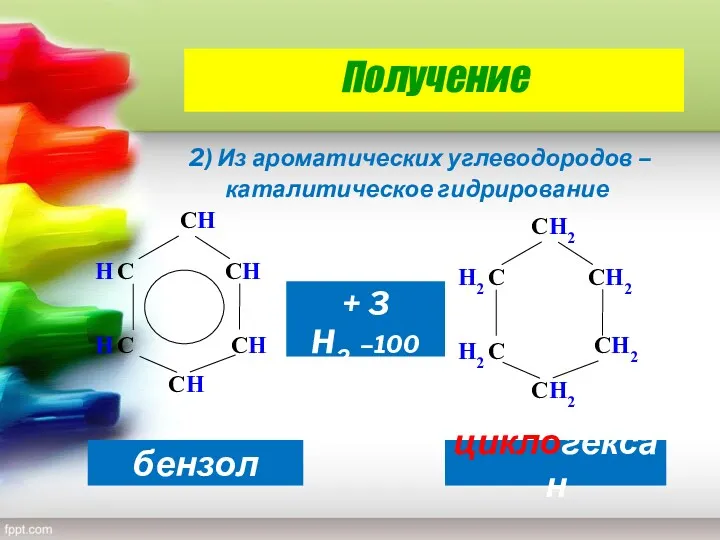
- 28. Получение 2) Из ароматических углеводородов – каталитическое гидрирование СH СH СH H С H С СH
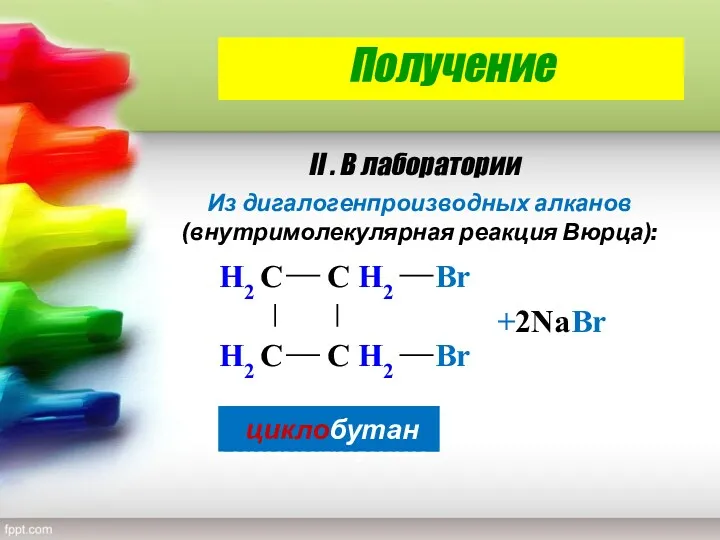
- 29. Получение H2 С H2 С С H2 С H2 Br Br +2Na Br 1,4-дибромбутан циклобутан II
- 31. Скачать презентацию













 Уксусная кислота. Продуценты. Практическое использование
Уксусная кислота. Продуценты. Практическое использование Строение и свойства циклоалканов
Строение и свойства циклоалканов Качественный анализ. Таблица растворимости соединений
Качественный анализ. Таблица растворимости соединений Карбонові кислоти. Хімія. 9 клас
Карбонові кислоти. Хімія. 9 клас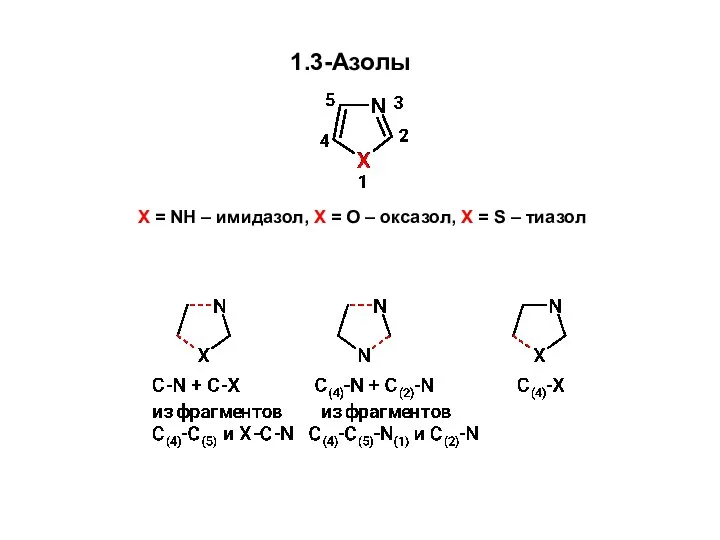 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Поліметилметакрилат
Поліметилметакрилат Валентность химических элементов
Валентность химических элементов Інертні гази
Інертні гази Студенттің өзіндік жұмысы
Студенттің өзіндік жұмысы Области применения лития
Области применения лития Тема. Водородная связь
Тема. Водородная связь Типы химических реакций
Типы химических реакций Кислородные соединения азота
Кислородные соединения азота Водород. Урок химии
Водород. Урок химии Термический анализ. Прибор синхронного термического анализа
Термический анализ. Прибор синхронного термического анализа Сера и ее соединения
Сера и ее соединения Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы Пористые адсорбенты. Лекция 06
Пористые адсорбенты. Лекция 06 Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева
Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева Степени окисления атомов и формулы веществ
Степени окисления атомов и формулы веществ Строение вещества. Химические элементы
Строение вещества. Химические элементы Химические методы выявления потожировых следов
Химические методы выявления потожировых следов Карбоновые кислоты. Строение
Карбоновые кислоты. Строение Кислотные дожди
Кислотные дожди Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Химическая кинетика и катализ
Химическая кинетика и катализ Пена и пенообразователи. Назначение, виды, состав и свойства
Пена и пенообразователи. Назначение, виды, состав и свойства Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений