Содержание
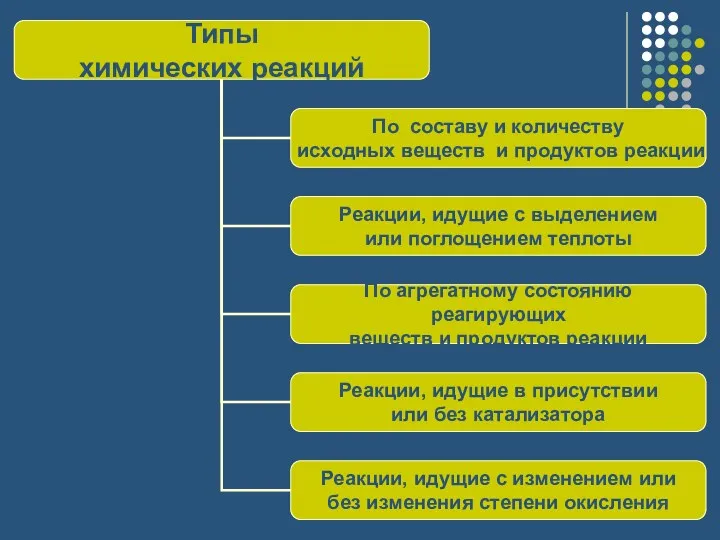
- 3. По составу и количеству исходных веществ и продуктов реакции: Реакции соединения ЭТО ТАКИЕ РЕАКЦИИ, В РЕЗУЛЬТАТЕ
- 4. Fe + S ? FeS
- 5. Реакции разложения ЭТО ТАКИЕ РЕАКЦИИ, В РЕЗУЛЬТАТЕ КОТОРЫХ ИЗ ОДНОГО СЛОЖНОГО ВЕЩЕСТВА ПОЛУЧАЮТСЯ НЕСКОЛЬКО ПРОСТЫХ ИЛИ
- 6. 2KMnO4 ? K2MnO4 + MnO2 + O2
- 7. Реакции замещения ЭТО РЕАКЦИИ МЕЖДУ ОДНИМ ПРОСТЫМ И ОДНИМ СЛОЖНЫМ ВЕЩЕСТВАМИ, В РЕЗУЛЬТАТЕ КОТОРЫХ АТОМЫ ПРОСТОГО
- 8. Fe + CuSO4 ? FeSO4 + Cu
- 9. Реакции обмена ЭТО РЕАКЦИИ МЕЖДУ ДВУМЯ СЛОЖНЫМИ ВЕЩЕСТВАМИ, В РЕЗУЛЬТАТЕ КОТОРЫХ ОНИ ОБМЕНИВАЮТСЯ СВОИМИ СОСТАВНЫМИ ЧАСТЯМИ
- 10. Fe2O3 +3H2SO4?Fe2 (SO4 )3+3H2O
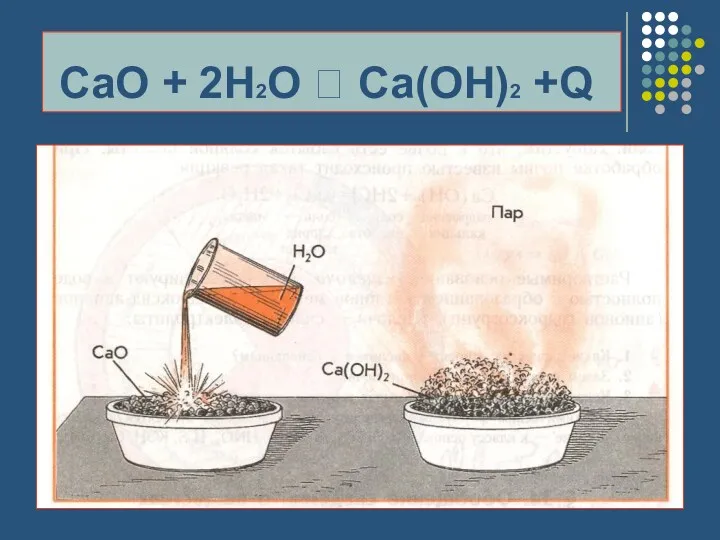
- 11. Реакции, идущие с выделением или поглощением теплоты: Экзотермические реакции ЭТО РЕАКЦИИ, ИДУЩИЕ С ВЫДЕЛЕНИЕМ ТЕПЛОТЫ
- 12. CaO + 2H2O ? Ca(OH)2 +Q
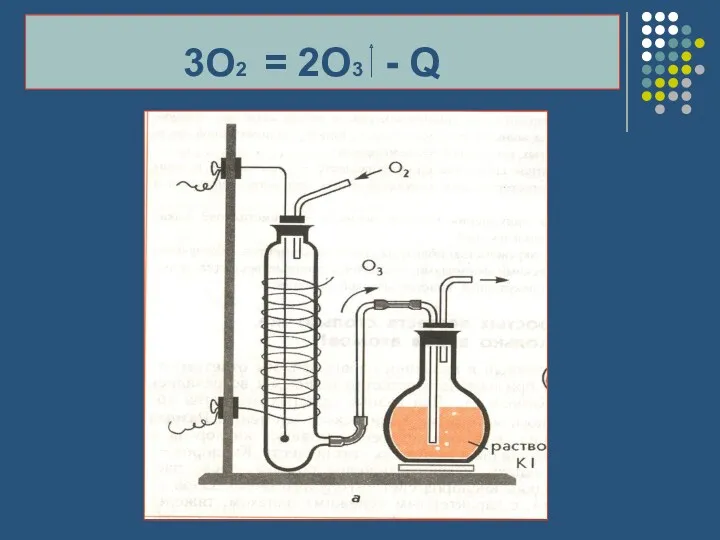
- 13. Эндотермические реакции ЭТО РЕАКЦИИ, ИДУЩИЕ С ПОГЛОЩЕНИЕМ ТЕПЛОТЫ
- 14. 3O2 = 2O3 - Q
- 15. По агрегатному состоянию исходных веществ и продуктов реакции: Гетерогенные реакции ЭТО РЕАКЦИИ, В КОТОРЫХ РЕАГИРУЮЩИЕ ВЕЩЕСТВА
- 16. Гомогенные реакции ЭТО РЕАКЦИИ, В КОТОРЫХ РЕАГИРУЮЩИЕ ВЕЩЕСТВА И ПРОДУКТЫ РЕАКЦИИ НАХОДЯТСЯ В ОДНОМ АГРЕГАТНОМ СОСТОЯНИИ
- 17. Реакции, идущие в присутствии или без катализатора: Каталитические реакции ЭТО РЕАКЦИИ, ИДУЩИЕ В ПРИСУТСТВИИ КАТАЛИЗАТОРА Некаталитические
- 18. Реакции, идущие с изменением или без изменения степени окисления: ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ ЭТО РЕАКЦИИ, В РЕЗУЛЬТАТЕ КОТОРЫХ
- 19. Реакции, идущие без изменения степени окисления НАПРИМЕР, РЕАКЦИИ ИОННОГО ОБМЕНА NaOH + HCl ? NaCl +
- 20. Проверь себя. Определи к какому типу реакций можно отнести следующие: a) 2Na + Cl2 ? 2NaCl
- 22. Скачать презентацию
















 Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Соединения галогенов
Соединения галогенов Аминокислоты. Пептиды. Хроматографические методы исследования
Аминокислоты. Пептиды. Хроматографические методы исследования Химическая связь
Химическая связь Массовая доля вещества в растворе
Массовая доля вещества в растворе Визначення іонів лужних і лужноземельних іонів у природних водах
Визначення іонів лужних і лужноземельних іонів у природних водах Уникальная соль (для дошколников)
Уникальная соль (для дошколников) Пищевые добавки
Пищевые добавки Коллигативные свойства растворов
Коллигативные свойства растворов Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Литий. Физические свойства лития
Литий. Физические свойства лития Типы заданий. ЕГЭ №32
Типы заданий. ЕГЭ №32 20230419_izomery
20230419_izomery Растворы и растворители
Растворы и растворители Фосфор и его соединения
Фосфор и его соединения Общая характеристика неметаллов
Общая характеристика неметаллов Простые вещества. Игра Счастливый случай
Простые вещества. Игра Счастливый случай Элемент, имеющий относительную атомную массу
Элемент, имеющий относительную атомную массу Введение в аналитическую химию. Введение в качественный анализ
Введение в аналитическую химию. Введение в качественный анализ Алканы. Гомологи
Алканы. Гомологи Методы разделения и исследования состава нефти и газа
Методы разделения и исследования состава нефти и газа Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики Хром. Элемент под № 24
Хром. Элемент под № 24 Аммиак. Состав вещества
Аммиак. Состав вещества Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Породообразующие минералы
Породообразующие минералы Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений Взрывоопасные грузы
Взрывоопасные грузы