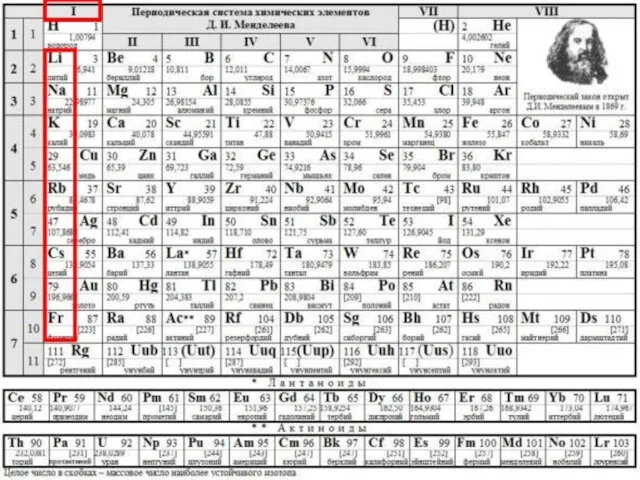
Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева презентация
Содержание
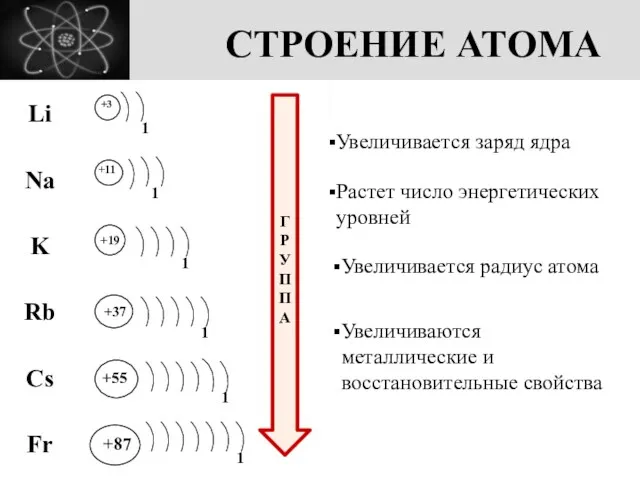
- 3. СТРОЕНИЕ АТОМА +3 1 +11 +19 +37 +55 +87 1 1 1 1 1 ГРУППА Увеличивается
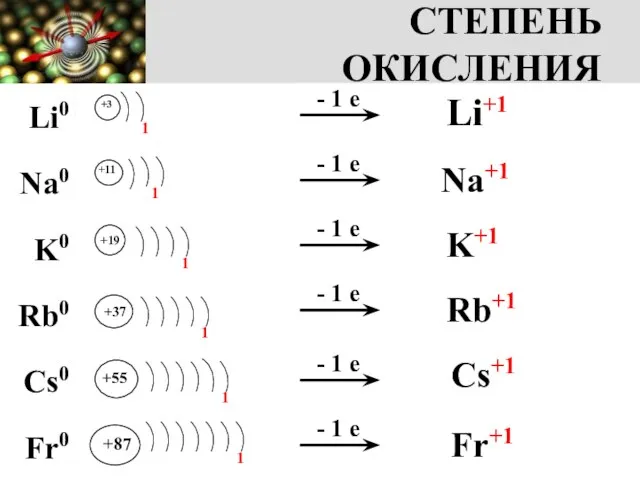
- 4. СТЕПЕНЬ ОКИСЛЕНИЯ +3 1 +11 +19 +37 +55 +87 1 1 1 1 1 - 1
- 5. ЗАПОМНИ! Степень окисления металлов I группы главной подгруппы в соединениях постоянная и равна +1 NaOH, K2O,
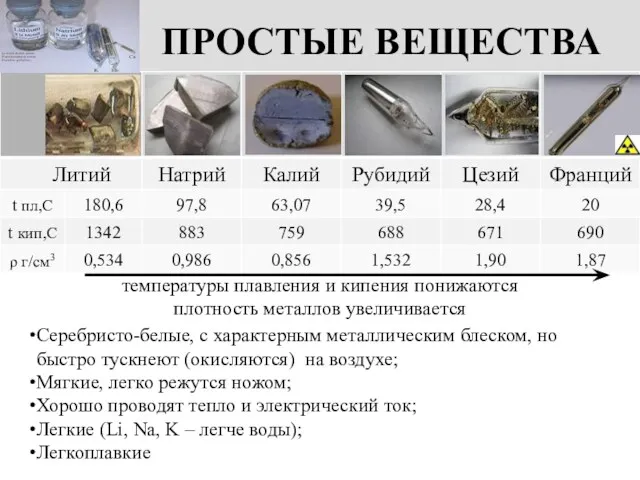
- 6. ПРОСТЫЕ ВЕЩЕСТВА Серебристо-белые, с характерным металлическим блеском, но быстро тускнеют (окисляются) на воздухе; Мягкие, легко режутся
- 7. ХИМИЧЕСКИЕ СВОЙСТВА Металлы I группы главной подгруппы – наиболее активные металлы, обладают высокой восстановительной способностью В
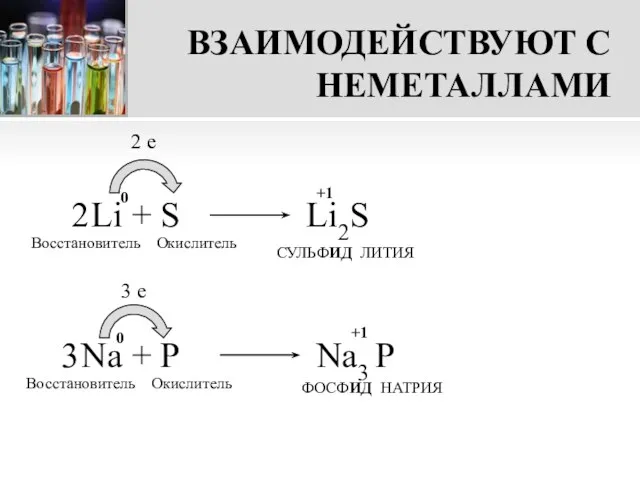
- 8. ВЗАИМОДЕЙСТВУЮТ С НЕМЕТАЛЛАМИ Li + S 2 e Восстановитель Окислитель СУЛЬФИД ЛИТИЯ Na + P 3
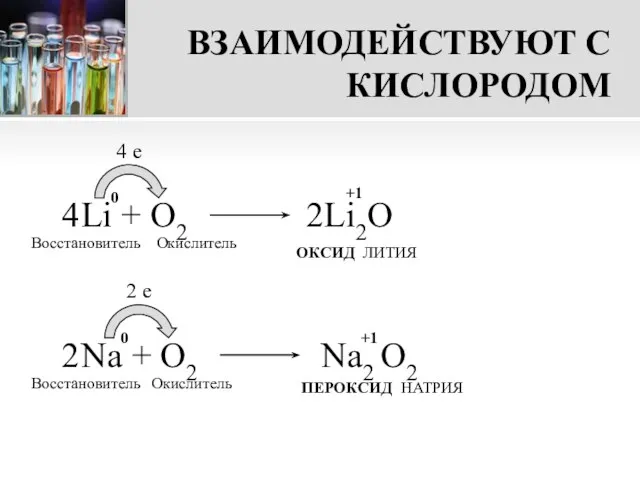
- 9. ВЗАИМОДЕЙСТВУЮТ С КИСЛОРОДОМ Li + О2 4 e Восстановитель Окислитель ОКСИД ЛИТИЯ Na + O2 2
- 10. ВНИМАНИЕ! При взаимодействии с кислородом только литий образует оксид. Другие металлы I группы главной подгруппы при
- 11. A ЗНАЕТЕ ЛИ ВЫ? При взаимодействии пероксида натрия с углекислым газом протекает процесс, обратный дыханию -
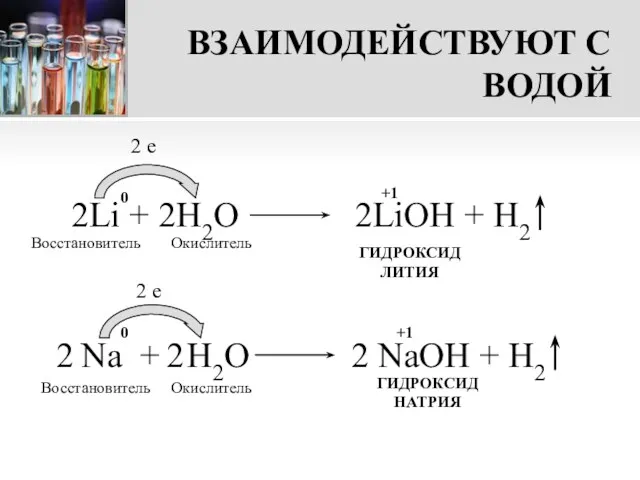
- 12. ВЗАИМОДЕЙСТВУЮТ С ВОДОЙ Металлы I группы главной подгруппы реагируют с водой бурно, с выделением теплоты. В
- 13. ВЗАИМОДЕЙСТВУЮТ С ВОДОЙ 2Li + 2H2О 2LiOH + H2 2 e Восстановитель Окислитель ГИДРОКСИД ЛИТИЯ Восстановитель
- 14. ХРАНЕНИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ Так как щелочные металлы легко окисляются и обладают высокой химической активностью, их хранят
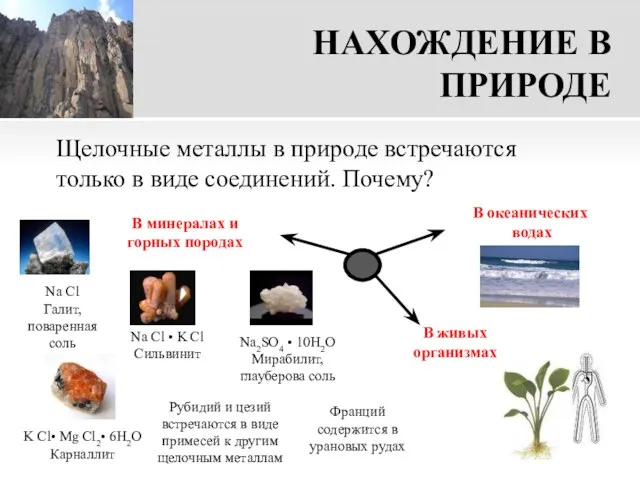
- 15. НАХОЖДЕНИЕ В ПРИРОДЕ Щелочные металлы в природе встречаются только в виде соединений. Почему? Na Cl Галит,
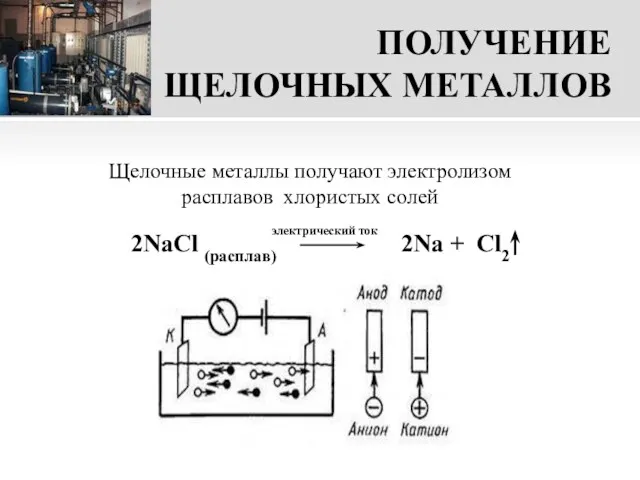
- 16. ПОЛУЧЕНИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ 2NaCl (расплав) 2Na + Cl2 Щелочные металлы получают электролизом расплавов хлористых солей электрический
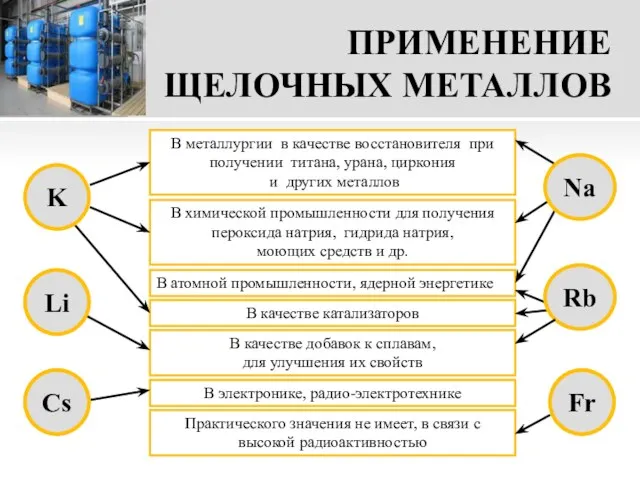
- 17. ПРИМЕНЕНИЕ ЩЕЛОЧНЫХ МЕТАЛЛОВ В металлургии в качестве восстановителя при получении титана, урана, циркония и других металлов
- 19. Скачать презентацию






 Строение атома, изотопы
Строение атома, изотопы Кислородсодержащие органические соединения- спирты. 10 класс
Кислородсодержащие органические соединения- спирты. 10 класс Признаки химических реакций. (Практическая работа 5,4)
Признаки химических реакций. (Практическая работа 5,4) Редкоземельные металлы
Редкоземельные металлы Золото. Виды золота
Золото. Виды золота Химическая промышленность
Химическая промышленность Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Гидролиз солей
Гидролиз солей Ароматты комирсутектер Бензол
Ароматты комирсутектер Бензол Основные и опасные свойства природного газа
Основные и опасные свойства природного газа Атомы, молекулы и ионы
Атомы, молекулы и ионы Лекция 4. Физико-химические свойства растворов
Лекция 4. Физико-химические свойства растворов Пурины. Строение пурина
Пурины. Строение пурина Периодическая система химических элементов. Периоды
Периодическая система химических элементов. Периоды Периодический закон и система элементов Д.И. Менделеева
Периодический закон и система элементов Д.И. Менделеева Количество вещества. 8 класс
Количество вещества. 8 класс Азотная кислота и нитраты
Азотная кислота и нитраты Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды
Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды Хром, марганец
Хром, марганец Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури
Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури Относительная атомная и молекулярная массы
Относительная атомная и молекулярная массы Комплексные соединения
Комплексные соединения Щелочной металл натрий
Щелочной металл натрий Алканы в природе
Алканы в природе Оксид фосфора P2O5
Оксид фосфора P2O5 Аккумуляторные батареи
Аккумуляторные батареи Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2)