Содержание
- 2. Электролитическая диссоциация (С. Аррениус, 1887 г.) - процесс распада электролита в водном растворе (или расплаве) на
- 3. Сила кислот (по степени диссоциации) HCl H2SO4 → HNO3 → H2SO3 → H2CO3 → CH3COOH →
- 4. Диссоциация растворимых солей: NaCI Na+ + CI- AI2(SO4)3 2AI3+ + 3SO42-
- 5. Диссоциация воды: Н2О → Н+ + ОН –
- 6. В чистой воде соотношение ионов водорода и гидроксид-ионов равное: Н+ = ОН- среда нейтральная; При добавлении
- 7. Гидролиз - от греч. «гидро» - вода, «лизис» - разложение.
- 8. Гидролиз солей – реакция обмена между солью и водой, приводящая к образованию слабого электролита.
- 9. 4 типа солей: соль, образованная сильной кислотой и слабым основанием (ALCl3); сильным основанием и слабой кислотой
- 10. : Соль, образованная сильной кислотой и слабым основанием. AlCl3 → Al3+ + 3Cl-; Н2О → Н+
- 11. Соль, образованная, сильным основанием и слабой кислотой. Na2S 2Na++S2- Н2О → Н+ + ОН –; S2-
- 12. Соль, образованная сильным основанием и сильной кислотой КСl + Н2О ↔ КСl ↔ К + +
- 13. Соль, образованная слабым основанием и сильной кислотой. CH3COONH4 CH3COO- +NH4+ Н2О → Н+ + ОН –;
- 14. Индикаторы –вещества, которые меняют окраску в зависимости от среды.
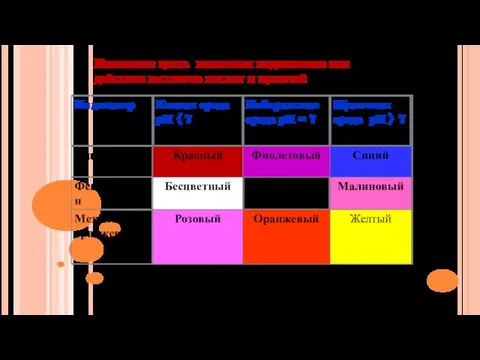
- 15. Изменение цвета различных индикаторов при действии растворов кислот и щелочей
- 16. Демонстрационный опыт: к раствору соды Na2CO3 приливаем поочерёдно индикаторы лакмус и метилоранж, фенолфталеин. Na2CO3
- 17. Значение гидролиза С древности – зола – моющее средство (в состав входит поташ – карбонат калия
- 18. Выводы: Гидролиз – процесс взаимодействия ионов соли с ионами воды с изменением рН среды. Обязательное условие
- 19. Каждой группе предлагаю по одному примеру провести исследование солей: Al2(SO4)3, NH4NO3, СuSO4, Na3PO4, NaCl, Na2CO3, Na2SO3
- 20. Задание №1. а) используя метилоранж или лакмус, определите среду раствора соли сульфата алюминия.
- 21. Вывод: раствор соли, образованной слабым основанием и сильной кислотой имеет кислую среду.
- 22. Задание №2. а) используя метилоранж или лакмус, определите среду раствора соли фосфата натрия.
- 23. Какой вывод можно сделать, исходя из состава соли и средой её раствора? Раствор соли, образованной сильным
- 24. Задание №3. а) определить среду раствора соли, образованной сильной кислотой и сильным основанием NaCI. б) обосновать
- 25. Вывод: Среда нейтральная,т.к. не образуется слабый электролит; такие соли гидролизу не подвергаются.
- 27. Количественной характеристикой гидролиза является степень гидролиза α (которую выражают в процентах). где n - число моль
- 28. Для большинства солей гидролиз обратимый процесс. Однако есть соли, продукты гидролиза которых выводятся из сферы реакции,
- 29. Силу уму придают упражнения 1.Кислую среду имеет водный раствор: а.Na3PO4 б.KCl в.Na2CO3 г. ZnSO4 2.Щелочную среду
- 30. 3.Нейтральную среду имеет раствор: а. Нитрата меди (II) Cu(NO3)2 б.Нитрата бария BaNO3 в.Ацетата калия CH3COONH4 г.Карбоната
- 31. 5.Кислую реакцию среды имеет каждый из двух растворов: а.BaCl2 и ZnCl2 б.AlCl3 и FeCl2 в.FeCl3 и
- 32. 7. Установите соответствие между составом соли и реакцией среды её водного раствора Ответ:
- 33. 8. Установите соответствие между названием соли и средой её водного раствора.
- 34. 9. Установите соответствие между названием соли и отношением её к гидролизу.
- 35. 10.Установите соответствие между названием соли и отношением её к гидролизу.
- 37. Скачать презентацию

































 Неметаллические материалы
Неметаллические материалы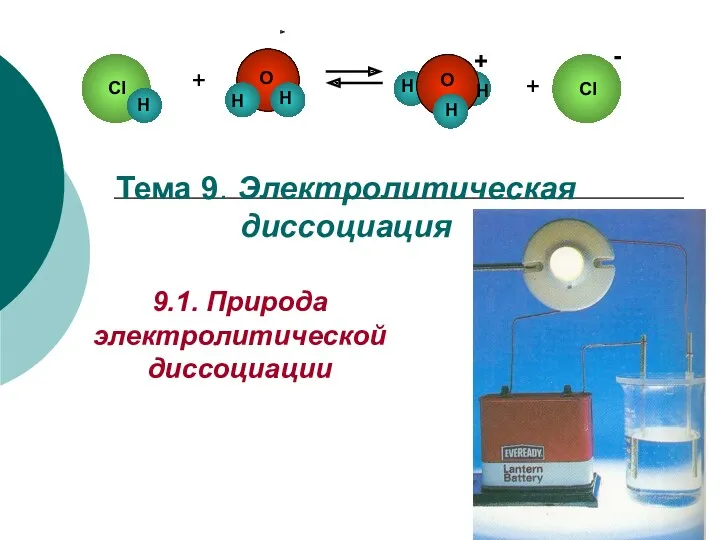 Электролитическая диссоциация
Электролитическая диссоциация Основные характеристики клеев
Основные характеристики клеев Взаємодія кисню із складними речовинами
Взаємодія кисню із складними речовинами Полимеры. Мономер
Полимеры. Мономер Растворы электролитов и неэлектролитов. Ионное произведение воды
Растворы электролитов и неэлектролитов. Ионное произведение воды Инструменты и приспособления для химической завивки волос
Инструменты и приспособления для химической завивки волос Хлорид натрия
Хлорид натрия Органическая химия. Жиры
Органическая химия. Жиры Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Продукция UNIL
Продукция UNIL Глины каолиновые и каолино-гидрослюдистые
Глины каолиновые и каолино-гидрослюдистые Химический элемент кремний
Химический элемент кремний Магматические горные породы
Магматические горные породы Супрамолекулярная химия - молекулярная социология
Супрамолекулярная химия - молекулярная социология Углеводы. Сn(H2O)m – общая формула углеводов
Углеводы. Сn(H2O)m – общая формула углеводов Общая электронная формула внешнего слоя
Общая электронная формула внешнего слоя Простые вещества
Простые вещества Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров
Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Незвичайна вода
Незвичайна вода Фунгициды. Достоинства и недостати
Фунгициды. Достоинства и недостати Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8)
Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8) Алкадиены
Алкадиены Производство цемента. Сухой цемент
Производство цемента. Сухой цемент Коррозия металлов
Коррозия металлов ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов
ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов Коррозия металлов и способы защиты от неё. (11 класс)
Коррозия металлов и способы защиты от неё. (11 класс)