Содержание
- 2. Идеальные растворы При образовании идеальных растворов не меняются агрегатные состояния веществ, входящих в его состав, а
- 3. Реальные растворы При смешивании 1 л воды и 1 л этанола объем раствора при 25 °С
- 4. Идеальные и реальные растворы Свойства идеальных растворов представляют собой функции только количественного состава растворов, а не
- 5. Электролиты и неэлектролиты Неэлектролиты – вещества, для которых не происходит изменения числа формульных единиц в растворе,
- 6. Раствор неэлектролита Число формульных единиц введенного в раствор вещества сохраняется В 1 л раствора 0,01М сахарозы
- 7. Раствор электролита Число формульных единиц введенного в раствор вещества увеличивается В 1 л 0,01М раствора KСl
- 8. Теория электролитической диссоциации (1887 г.) В водном растворе (или расплаве) происходит распад растворенных веществ – электролитов
- 9. Природа растворителя и электролитическая диссоциация В растворе связь М—А в полярной ковалентной молекуле растворяемого вещества ослабляется.
- 10. Электролиты в водном растворе Ионные кристаллы в водном растворе полностью распадаются на ионы: (M+)(A–)(т) + H2O
- 11. Гидратированные ионы в растворе Для катионов металлов - две зоны гидратации число молекул воды равно КЧ
- 12. Катион водорода – особая частица. В водном растворе он имеет 3 зоны гидратации: [H(H2O)]+ · 3H2O
- 13. Сильные электролиты Ионные кристаллы солей и гидроксидов металлов: (M+)(A–)(р) = M+(р) + A(р)– [M+] = [A–]
- 14. Слабые электролиты (M+δ–A–δ)(р) ⮀ M+(р) + A(р)– [M+] = [A–] Степень диссоциации αд в случае слабого
- 15. Факторы, от которых зависит сила электролита Прочность связи (M+δ–A–δ) или (M+) (A–) Прочность образующихся сольватов Концентрация
- 16. Количественная характеристика слабых электролитов MA(s) ⮀ M+(s) + A(s)– KC = [M+] [A–] / [MA] =
- 17. Константа, степень диссоциации и концентрация слабого электролита KC = [M+] [A–] / [MA] = (α с0
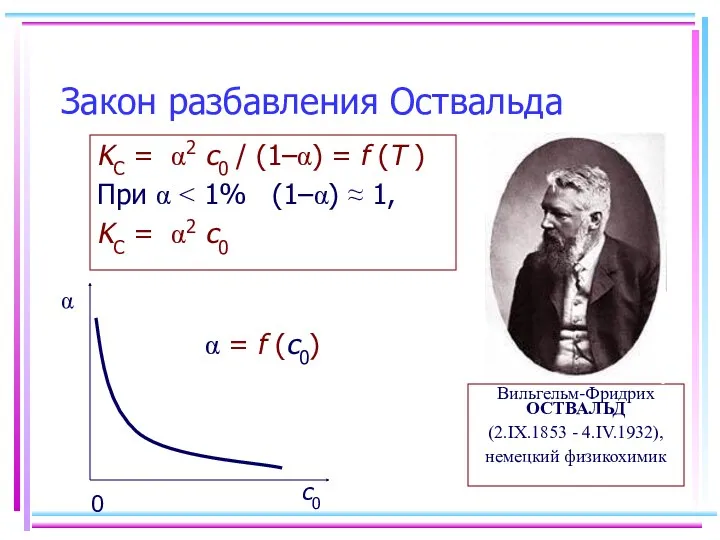
- 18. Закон разбавления Оствальда KC = α2 с0 / (1–α) = f (T ) При α KC
- 19. Протолитические равновесия Любое вещество B2, растворяясь в Ж1, реагирует с его частицами, образует сольваты (сольватная теория
- 20. Протонная теория Йоханнес-Николаус БРЁНСТЕД (1879 - 1947), датский физикохимик Томас-Мартин ЛАУРИ (1874 - 1936) английский химик
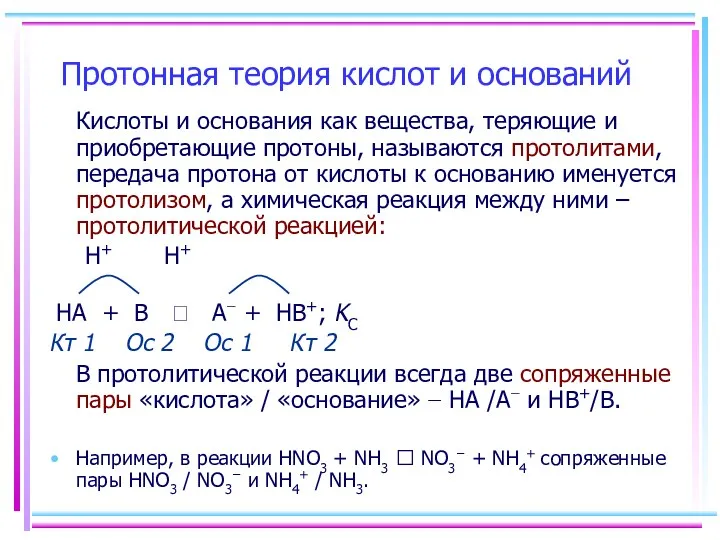
- 21. Протонная теория кислот и оснований Кислоты и основания как вещества, теряющие и приобретающие протоны, называются протолитами,
- 22. Протонодонорная и протоноакцепторная способность веществ (их кислотность и основность) определяется сродством к протону, т.е. энтальпией реакции
- 23. Виды протолитов Частицы вещества, рассматриваемые в рамках протонной теории как кислоты, могут представлять собой нейтральные молекулы
- 24. Виды протолитов В роли оснований протонная теория рассматривает нейтральные частицы (например гидрат аммиака), анионы (цианид-ион, карбонат-ион,
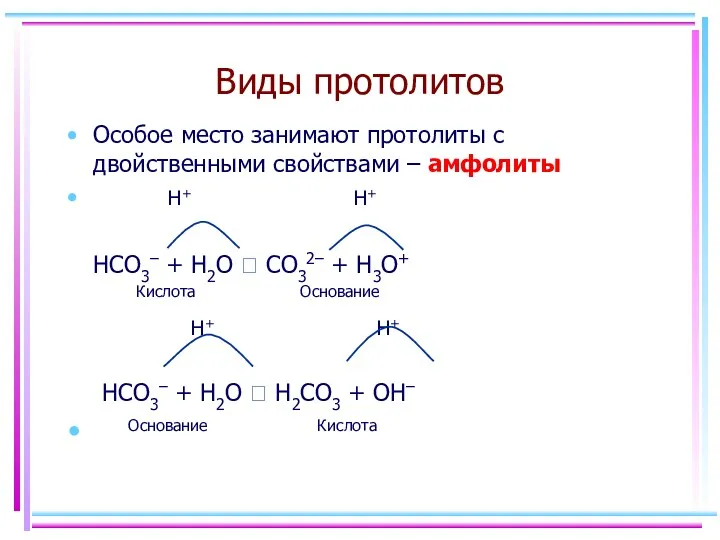
- 25. Виды протолитов Особое место занимают протолиты с двойственными свойствами – амфолиты H+ H+ HCO3– + H2O
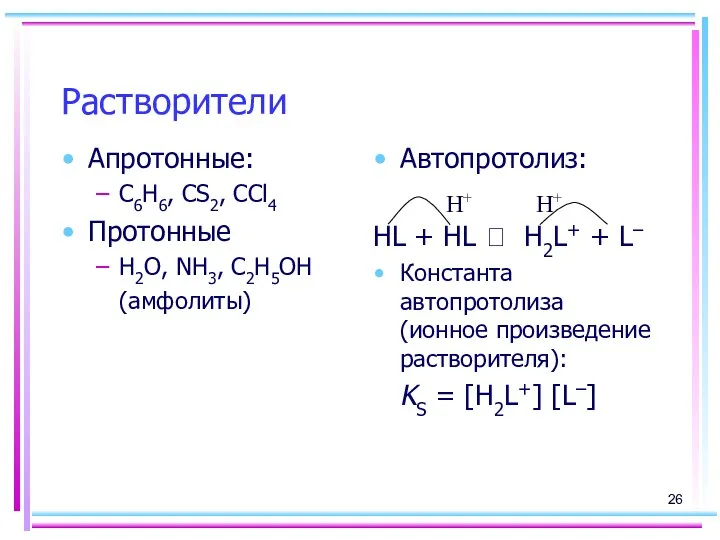
- 26. Растворители Апротонные: C6H6, CS2, CCl4 Протонные H2O, NH3, C2H5OH (амфолиты) Автопротолиз: HL + HL ⮀ H2L+
- 27. Ионное произведение воды H2O + H2O ⮀ H3O+ + OH– При стандартной температуре 298 К (25
- 28. Водородный показатель (рН) рН = –lg[H3O+] [H3O+] = 10–рН Гидроксидный показатель (рОН) pOH = –lg[OH–] [OH–]
- 29. Водородный показатель (рН) В чистой воде при 25°С рН = рОН = 7, среда нейтральная при
- 31. Скачать презентацию












![Слабые электролиты (M+δ–A–δ)(р) ⮀ M+(р) + A(р)– [M+] = [A–]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/603073/slide-13.jpg)


![Константа, степень диссоциации и концентрация слабого электролита KC = [M+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/603073/slide-16.jpg)






![Водородный показатель (рН) рН = –lg[H3O+] [H3O+] = 10–рН Гидроксидный](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/603073/slide-27.jpg)

 Чистые вещества и смеси
Чистые вещества и смеси Вода-растворитель. Работа воды в природе
Вода-растворитель. Работа воды в природе Щелочные металлы
Щелочные металлы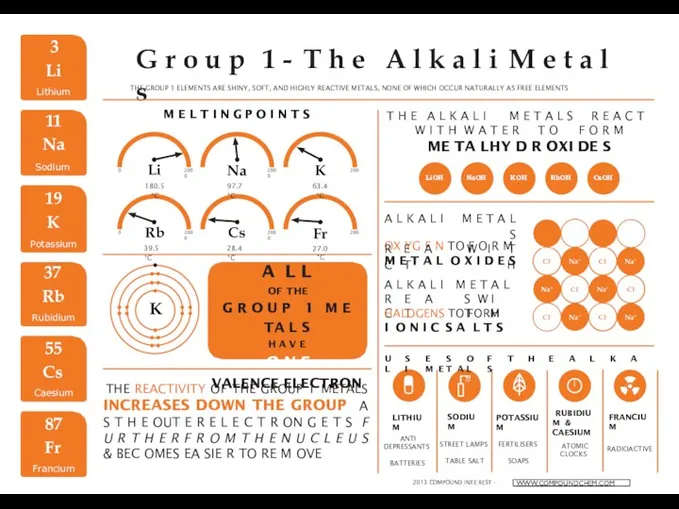 The alkali metals
The alkali metals Предмет органической химии
Предмет органической химии Приготування розчинів
Приготування розчинів Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Энергоресурсы и их использование
Энергоресурсы и их использование Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Химические соединения в организме человека
Химические соединения в организме человека Углеводы. Моносахариды
Углеводы. Моносахариды Карбоновые кислоты. Нахождение в природе
Карбоновые кислоты. Нахождение в природе Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений
Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений Химические формулы
Химические формулы Задачі на визначення ступеню електролітичної дисоціації
Задачі на визначення ступеню електролітичної дисоціації Закон збереження маси речовини. Хімічні рівняння
Закон збереження маси речовини. Хімічні рівняння Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 История мыловарения. Моющее действие мыла
История мыловарения. Моющее действие мыла Чистые вещества и смеси
Чистые вещества и смеси Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции
Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции Добування кисню
Добування кисню Основы теории смазывания и стандарты качества моторных масел
Основы теории смазывания и стандарты качества моторных масел Гидроксид аммония
Гидроксид аммония Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis
Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis Кислород O2
Кислород O2 Химия и живопись
Химия и живопись Кислородные соединения азота
Кислородные соединения азота Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату