Слайд 2

Слайд 3

Цель урока: систематизация и развитие знаний учащихся о водороде как химическом элементе
и простом веществе, освойствах водорода, способах его получения.
Слайд 4

В день, когда его запасы иссякнут, жизнь во Вселенной прекратится. Погаснут
солнца, не станет воды... Вещество, без которого жизнь невозможна, «сидит» в самом центре нашей планеты — в ядре и вокруг него, и оттуда «мигрирует» наружу.
Этот газ — начало всех начал. Его название — «водород».
Слайд 5
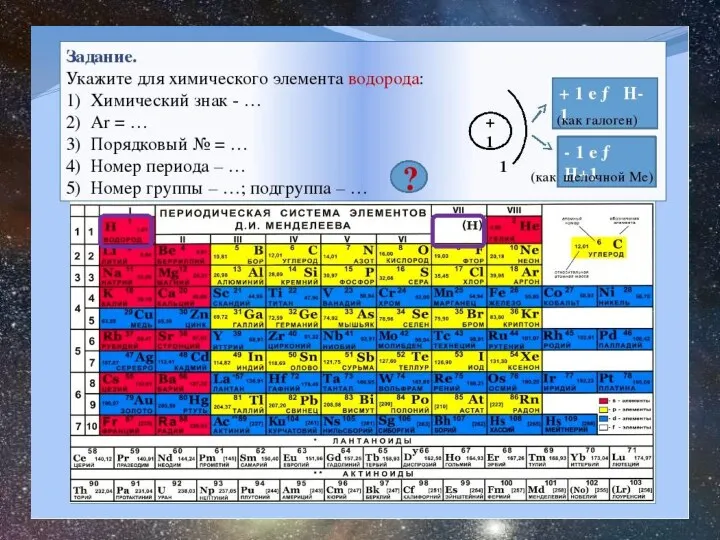
Слайд 6

Химический элемент
Порядковый номер
Группа
Период
Электронная формула
Степень окисления
?
Слайд 7

Слайд 8
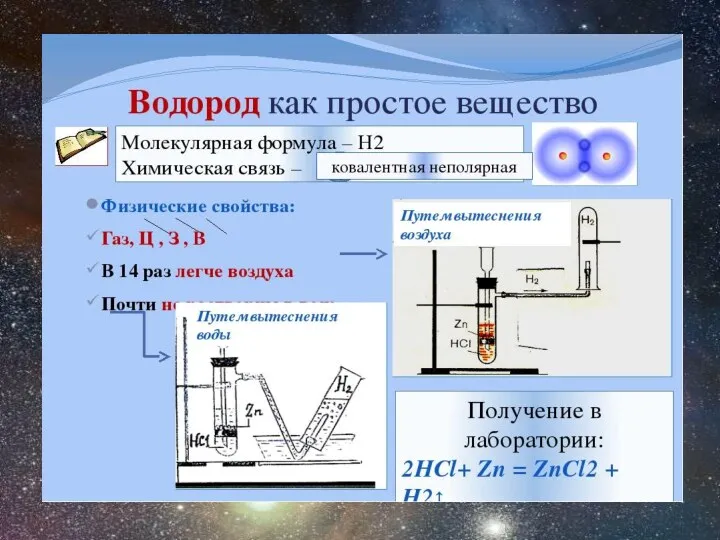
Слайд 9

Химические свойства
Строение атома 1 1 Н) 1 1s Находится в первом
периоде первой группе таблицы Д.И.Менделеева, так как на внешнем слое у него один электрон и он его отдает, проявляя степень окисления +1, и в седьмой группе, как галогены, до завершения уровня не хватает одного электрона и водород может взять его, проявляя при этом степень окисления -1.
Слайд 10

Водород как простое вещество
Химические свойства.
I. Восстановительные свойства водорода: Горение
водорода
2Н2 + О2 = 2Н2О Взаимодействие с неметаллами
3H2 + N2 = 2NH3 H2 + Cl2 = 2HCl Восстановление металлов из их оксидов H2 + CuO = Cu + H2O
Слайд 11

Водород как простое вещество Химические свойства.
II. Окислительные свойства водорода:
Взаимодействие с
металлами
H2 + 2Na = 2NaH
H2 + Ca = CaH2
Слайд 12
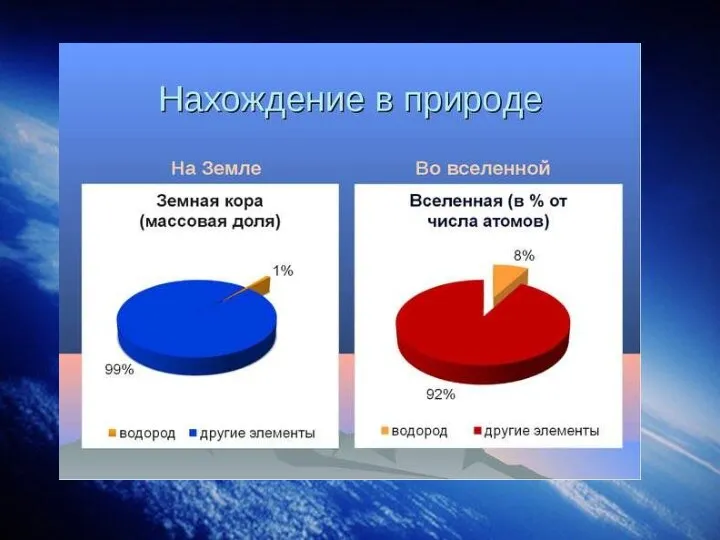
Слайд 13

Получение водорода
В лаборатории:
Цинк и разбавленная серная кислота
Zn + 2HCl =
ZnCl2 + H2
2) В промышленности:
Взаимодействием угля с водой
С + Н2О = СО + Н2
Метана с водой
СН4 + Н2О = СО + 3Н2
Электролизом воды
2Н2О = 2Н2 + О2
Слайд 14
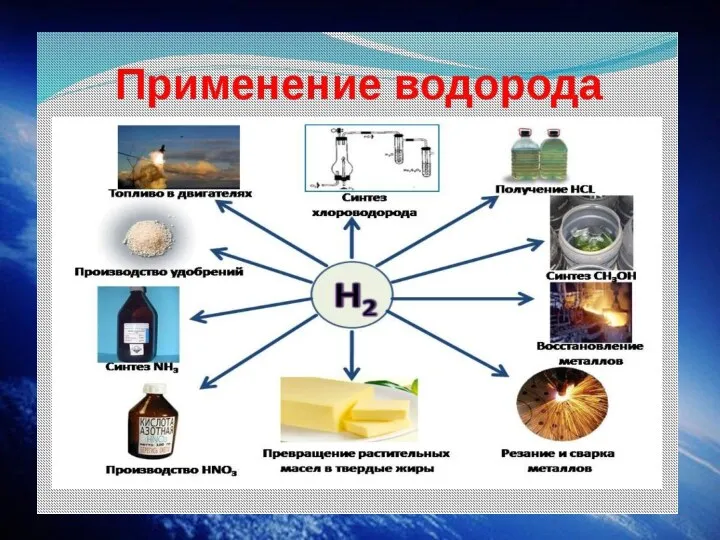
Слайд 15

Слайд 16

Слайд 17

В продажу водород поступает в баллонах под давлением свыше 150 атм.
Они окрашены в тёмно-зелёный цвет и снабжаются красной надписью "Водород".
















 Теплота згоряння. Температура горіння
Теплота згоряння. Температура горіння Методы количественного определения металлических ядов в минерализате (деструктате)
Методы количественного определения металлических ядов в минерализате (деструктате) Sulfur and its compounds. Contact method for producing sulfuric acid
Sulfur and its compounds. Contact method for producing sulfuric acid Строение атома
Строение атома Химия и продукты питания
Химия и продукты питания Электролитическая диссоциация
Электролитическая диссоциация Химический элемент фосфор
Химический элемент фосфор Твердость минералов и их применение
Твердость минералов и их применение Минеральные вяжущие вещества, материалы и изделия на их основе
Минеральные вяжущие вещества, материалы и изделия на их основе Кислотно-основные свойства органических соединений. (Лекция 3)
Кислотно-основные свойства органических соединений. (Лекция 3) Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Біологічна хімія з основами фізичної і колоїдної хімії
Біологічна хімія з основами фізичної і колоїдної хімії Спекание порошковых систем
Спекание порошковых систем Атомный и ионный радиусы. Принципы шаровых упаковок
Атомный и ионный радиусы. Принципы шаровых упаковок Аминокислоты. Свойства
Аминокислоты. Свойства Классификация и номенклатура липидов. Жирные кислоты, их классификация и номенклатура
Классификация и номенклатура липидов. Жирные кислоты, их классификация и номенклатура Теории химической кинетики. Лекция 4
Теории химической кинетики. Лекция 4 Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD
Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD Использование потенциостата-гальваностата Elins p-20x в электрохимических исследованиях
Использование потенциостата-гальваностата Elins p-20x в электрохимических исследованиях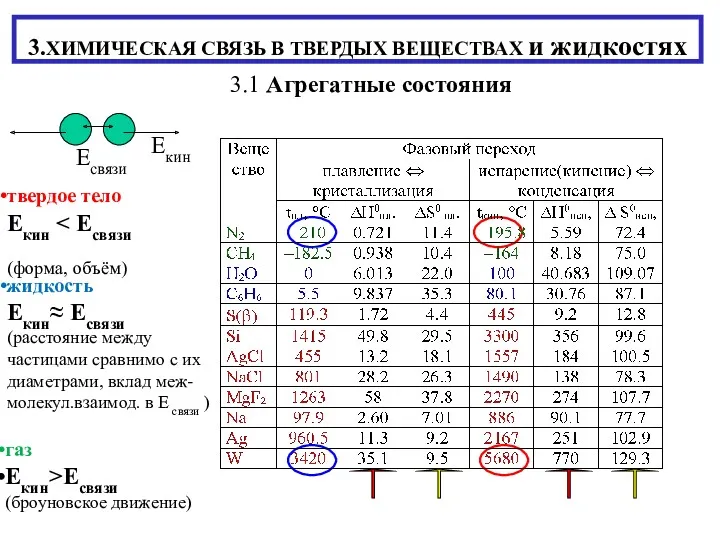 Химическая связь в твердых веществах и жидкостях
Химическая связь в твердых веществах и жидкостях Водород. Общая характеристика, нахождение в природе. Получение и физические свойства
Водород. Общая характеристика, нахождение в природе. Получение и физические свойства Тепловой эффект химических реакций
Тепловой эффект химических реакций Атомно-молекулярное учение. (Лекция 1)
Атомно-молекулярное учение. (Лекция 1) Органічні розчинники. Їх застосування
Органічні розчинники. Їх застосування Кислородсодержащие органические соединения. Лабораторная работа
Кислородсодержащие органические соединения. Лабораторная работа Применение спиртов
Применение спиртов Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации