Содержание
- 2. Основные понятия химии Атом Химический элемент Изотопы Молекула Простое вещество Аллотропия Моль
- 3. Основные понятия химии Валентность – это способность атома данного элемента присоединять к себе определённое число атомов
- 4. Стехиометрическая валентность Стехиометрическая валентность (Встех.) определяется по элементному составу вещества. Встех. - это число взаимодействий атома
- 5. Структурная валентность Структурная валентность (Встр.) определяется из геометрической структуры вещества.
- 6. Электронная валентность Электронная валентность (Вэл.) определяется из электронного строения молекулы.
- 7. Эквивалент Эквивалент – это реальная или условная частица в-ва, которая в данной кислотно-основной р-ции способна присоединять
- 8. Фактор эквивалентности (f). Количественной характеристикой эквивалента является фактор эквивалентности (f). f - показывает, какая часть реальной
- 9. Расчет эквивалентных масс Молярная масса эквивалента соединения рассчитывается по формуле: Мэк. = М · f f
- 10. Основные законы химии Различают фундаментальные законы частные (стехиометрические) законы.
- 11. Фундаментальные законы Закон сохранения массы – энергии: в изолированной системе сумма масс и энергий постоянна: Закон
- 12. Стехиометрические законы Закон эквивалентов (1792 -1794 г., Рихтер): массы реагирующих без остатка веществ относятся друг к
- 13. Стехиометрические законы Закон постоянства состава (1801 -1808 г., Пруст): любое химически чистое соединение, не зависимо от
- 14. Стехиометрические законы Закон Авогадро (1811 г.) в равных объёмах различных газов при одинаковых условиях содержится одинаковое
- 15. Стехиометрические законы Закон удельных теплоёмкостей (1829 г, Дюлонг, Пти): произведение удельной теплоёмкости (суд.) простого вещества в
- 17. Скачать презентацию














 Кислоты. Состав кислот
Кислоты. Состав кислот Реакції йонного обміну. Йонно-молекулярні рівняння
Реакції йонного обміну. Йонно-молекулярні рівняння Амфотерные соединения
Амфотерные соединения Гетероциклические соединения
Гетероциклические соединения Фенолы. Химические свойства и способы получения
Фенолы. Химические свойства и способы получения Chemical Formulas and Nomenclature of compounds
Chemical Formulas and Nomenclature of compounds Товары бытовой химии
Товары бытовой химии Кристаллофизика_часть_1
Кристаллофизика_часть_1 Тяжелые металлы. Опасность токсичных металлов для организма
Тяжелые металлы. Опасность токсичных металлов для организма Домашнее задание по теме Химические свойства альдегидов, их получение
Домашнее задание по теме Химические свойства альдегидов, их получение Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов
Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9 Химические соединения в организме человека
Химические соединения в организме человека Способы и степень дробления
Способы и степень дробления Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Химическая термодинамика
Химическая термодинамика Свойства воды. Оценка качества
Свойства воды. Оценка качества Состав и свойства сжиженного газа. Вопрос №1
Состав и свойства сжиженного газа. Вопрос №1 Химический элемент фосфор
Химический элемент фосфор Углерод и его соединения
Углерод и его соединения Характеристика металу Ферум
Характеристика металу Ферум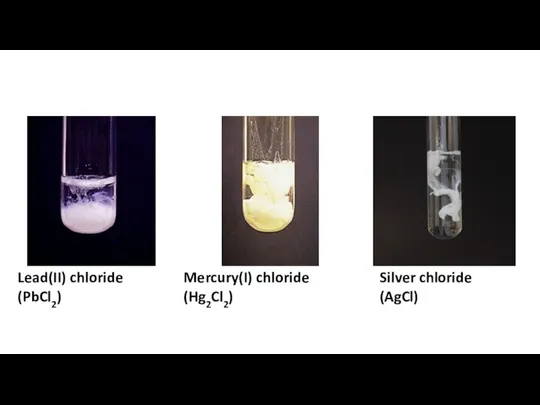 Separation amp confirmation
Separation amp confirmation Оксиды. Физические свойства
Оксиды. Физические свойства Галогены. Нахождение в природе
Галогены. Нахождение в природе Химия и проблемы экологии. Кислотные дожди
Химия и проблемы экологии. Кислотные дожди Алкины. Гомологический ряд, получение, свойства и применение
Алкины. Гомологический ряд, получение, свойства и применение Биоорганическая химия
Биоорганическая химия