Слайд 2

Железо(Fe)
Железо (Ferrum), Fe («феррум»), химический элемент, атомный номер 26, атомная
масса 55,847. В периодической системе Менделеева железо входит в группу 8 обочной подгруппы, в четвертом периоде.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 %
Железо как инструментальный материал известно с древнейших времён. Самые древние изделия из железа, найденные при археологических раскопках, датируются 4-м тысячелетием до н. э. и относятся к древнешумерской и древнеегипетской цивилизациям. Это изготовленные из метеоритного железа, то есть сплава железа и никеля. Первыми освоили метод выплавки железа хатты(народ страны Хатти,основавший свою империю на территории хаттов (современной Анатолии в Турции).Также отмечается использование железа при выплавке и изготовлении орудий и инструментов в 1200 году до н. э. в Африке южнее Сахары.В древности мастерами железных изделий слыли халибы.Аристотель описал их способ получения стали: «халибы несколько раз промывали речной песок их страны — тем самым выделяя чёрный шлих (тяжёлая фракция, состоящая в основном из магнетита и гематита), и плавили в печах; полученный таким образом металл имел серебристый цвет и был нержавеющим».
Слайд 3

Оксиды железа
Оксиды железа — соединения железа с кислородом.
Наиболее известны три оксида
железа:
Оксид железа (II) – FeO(основной), встречается в природе в виде
минерала вюстита
Оксид железа (III) – Fe2O3, Ввприроде встречается как минерал гематит.
Оксид железа (II,III) – Fe3O4, В природе встречаются больши залежи минерала магнетита — Fe3O4 с различными примесями
Слайд 4

Физические свойства
оксида железа(II)
Оксид железа(II) - Соединение чёрного цвета. Кристаллическая
решётка
по типу каменной соли. Устойчивым оксид железа(II)
становится лишь при повышении температуры.
Нерастворимый в воде, окисляется на воздухе
Слайд 5

Физические свойства
оксида железа(III)
Оксид железа (III) - это оранжево-красный порошок, образующийся
при окислении железа на воздухе.Твердый, нерастворимый в воде
Слайд 6

Физические свойства
оксида железа(II,III)
Оксид железа(II, III) представляет собой черные кубические кристаллы,
которые являются тугоплавкими и ломкими. Вещество плавится при
1538°C, а при 1787°C начинает разлагаться без кипения.
Fe3O4 является ферромагнитным соединением, хорошо проводит
электрический ток.
Слайд 7

Химические свойства
оксида железа(II)
FeO легко реагирует с разбавленной соляной кислотой
и концентрированной азотной кислотой:FeO + 2HCl = FeCl2 + H2O; FeO + 4HNO3 = Fe(NO3)3 + NO2 + 2H2O
С водой и с солями в реакцию не вступает.
При взаимодействии с водородом при t 350°С восстанавливается до чистого железа: FeO +H2 = Fe + H2O
Слайд 8

Химические свойства
оксида железа(III)
Оксид Fe2O3 – самое устойчивое природное кислородсодержащее соединение
железа. Это амфотерный оксид, нерастворимый в воде
Проявляет слабовыраженные амфотерные свойства с преобладанием основных.
Легко реагирует с кислотами:
Fe2O3 + 6HCl = 2 FeCl3 + 3H2O
При действии восстановителей выступает как окислитель:
Fe2O3 + 3H2 = (воздействие t ) 2Fe+ 3H2O
Слайд 9

Химические свойства
оксида железа(II,III)
Нагревание при температуре 1538°С приводит к его
распаду:
2Fe3O4 = 6FeO + O2
Вступает в реакцию с кислотами:
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O;
Fe3O4 + 10HNO3 = 3Fe(NO3)3 + NO2 + 5H2O
Со щелочами реагирует при сплавлении:
Fe3O4 + 14NaOH = Na3FeO3 + 2Na5FeO4 + 7H2O
Вступает в реакцию с кислородом воздуха:
4Fe3O4 + O2 = 6Fe2O3
Слайд 10

Получение оксидов железа
Оксид железа (II, III) образуется при горении железа и
при действии перегретого пара на железо:3Fe + 2O2 = Fe3O4; 3Fe + 4H2O = Fe3O4 + 4H2.
Железо реагируерт на высоких t с кислородом, образуя 2FeO (2Fe + O₂ = 2FeO)
При сгорании железа на воздухе образуется оксид Fe2О3,
Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeО









 Гидролиз солей
Гидролиз солей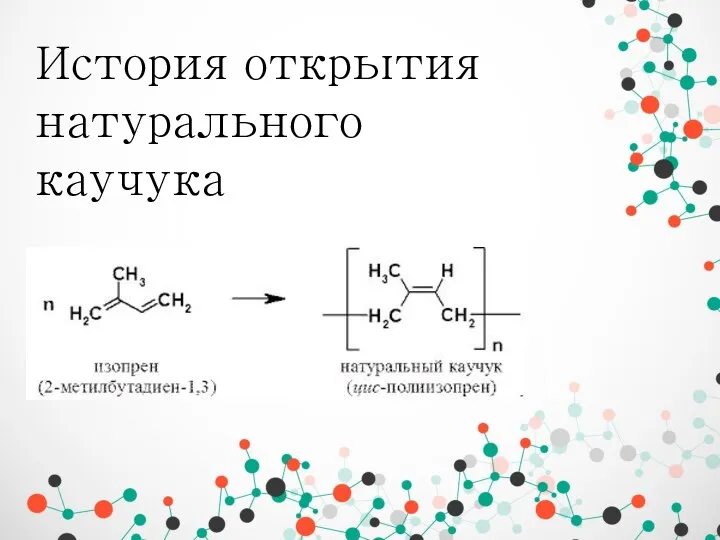 История открытия натурального каучука
История открытия натурального каучука Химическая промышленность России входит в авангардную тройку
Химическая промышленность России входит в авангардную тройку Коррозия металлов
Коррозия металлов Минералы. Химическая классификация
Минералы. Химическая классификация Свойства моторных топлив
Свойства моторных топлив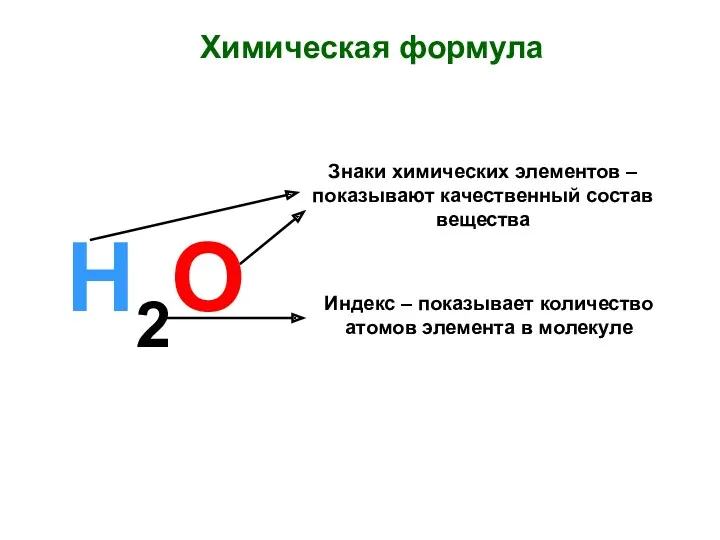 Химическая формула. Знаки химических элементов
Химическая формула. Знаки химических элементов Классификация строительных материалов. Коррозия бетона и железобетона
Классификация строительных материалов. Коррозия бетона и железобетона Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Ветеринариялық гигиена және санитария
Ветеринариялық гигиена және санитария Классификация моторных масел
Классификация моторных масел Алюминий на кухне - опасный враг или верный помощник?
Алюминий на кухне - опасный враг или верный помощник? Уравнения химических реакций
Уравнения химических реакций Природний газ
Природний газ Physical and chemical properties of oil
Physical and chemical properties of oil Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии
Подготовка учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound
Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции
Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции Химическая посуда и ее назначения (6)
Химическая посуда и ее назначения (6) Бейорганикалық заттар технологиясындағы жүйелерді термодинамикалық талдау
Бейорганикалық заттар технологиясындағы жүйелерді термодинамикалық талдау Электрохимические методы. Кондуктометрия в анализе объектов окружающей среды
Электрохимические методы. Кондуктометрия в анализе объектов окружающей среды Хімічні властивості оксидів
Хімічні властивості оксидів Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Виды соли и ее значение в питании
Виды соли и ее значение в питании Производство извести в домашних условиях. 7 класс
Производство извести в домашних условиях. 7 класс Альдегиды и кетоны. 10 класс
Альдегиды и кетоны. 10 класс Координационные комплексные соединения
Координационные комплексные соединения Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН