Слайд 2Жоспар
Энтропия – процестер тепе- теңдігімен өз- өздігін айқындаушы шама.
Термодинамикалық потенциалдар.
Тепе- теңдіктің жалпы
шарттары.
Қайтымды және қайтымсыз процестер
Слайд 3Бейорганикалық қосылыстар мен оларды алу реакцияларының термодинамикалық шамаларын есептеу тәсілдері.
Химиялық қосылыстардың жылу
сыйымдылығын, түзілу және жану жылуларын жуықтап есптеу тәсілдері (В.Ф. Капустинский тәсілі жылулық түзеткіштер тәсілі, М.Х. Карапетянцтың салыстырмалары есептеу тәсілі, Д.П. Коноваловтың теңдеуі). Энтропияны есептеп табу. Химиялық реакциялардағы Гиббс энергиясы өзгерісін есептеп табу. Химиялық реакциялардың жылу балансын изотермиялық және адиабаттық қалыптарда құрастыру тәсілі.
Слайд 4Энтропия мәліметтері процестердің бағытталуының бағалау қатынасы үшін қажет.
ΔS > 0 өзіндік пайда болу
процесс жағдайында. ΔS белгісі бойынша бағытталғандығын, ал абсолютті мағынасы – процестің интенсивтілігін көрсетеді.
ΔS энтропиясының толық мағыналы өзгертулері химия-технологиялық процестер энтропия өзгертулерін құрайды, реакциялық жүйенің энтропия компоненттерінің алгебралық суммасы сияқты және ішкі ортада энтропияның (ΔSіш.ор.), химиялық қатынастар нәтижесіндегі жылудың жұтылуы мен бөлінуі есептеледі
Слайд 5 Бейорганикалық заттар технологиясындағы газды-сұйықтықты күйлердегі өзгерістер термодинамикасы.
Реальді газдар. Реальді газдар мен қоспалардың
калыптық теңдеуі. Затттардың аумалы күйдегі қалыпы. Аумалы қалыпты сипаттайтын шамалар. Реальді газдар қалпының өзгерісі. Газдардың сығылғыштығы. Сығылғыштық шамасы. Ұшқырлық. Ұшқырлыққа қысым мен температураның әсері. Газдардың қасиеттерін экспериментальдық мәліметтер негізінде есептеу. Тұман пайда болуы. Тұман пайда болу шарты. Газдар көлемінде булардың сұйықтануы. Тұманның құрамдасуы мен ыдырауы.
Слайд 6Төменгі температуралар алу термодинамикасы
Төменгі температуралар алу тәсілдерінің құрлымдары. Газдардың изоэнталпиялық ұлғаюы. Дифференциалдық және
интегралдық және дроссельдік әсер. Газдардың изоэнтропиялық сыртқы жұмыс жасап ұлғаюы. Газ сүйықтануынының идеалды циклы. Газ сұйықгануының ең аз теориялық жұмысы. Терең салқындатудың реальді циклдары.
Слайд 7 Термодинамикалық потенциалдардың сипаттамалық функциялары
Химия-технологиялық процестерді талдау жасауда шешуді қажет ететін ең негізгі
мәліметтердің бірі қарастырып отырған заттардың әрекеттесуін айқындауға қажетті шамалардың мүмкінді мәндерін анықтау. Гиббс, Гельмгольц, Вант-Гофф атты ғалымдардың еңбектерінің нәтижесінде осындай шамалар термодинамикалық потенциалдар деп аталады. Олар ретінде ішкі энергия (U), энтальпия (Н), Гиббс және Гельмгольц бос энергиялары (G, F) қарастырылады
Слайд 8Жоғарыда келтіргендей олардың арасында процестерге әсер етуші негізгі сыртқы факторларға қатысты қарастырғанда төмендегідей
байланыстар бар:
U = F + TS
H = U + PV
F = U – TS
G = F + PV
T = const, P = const жағдайларға қатысты технологиялық процестердегі термодинамикалық потенциялдар өзгерістері төмендегідей көрсетіледі:
∆U = ∆F + T∆S ∆F =∆ U -∆TS
∆H = ∆U + PdV ∆G = ∆F + PdV
Слайд 9Осы теңдеулерден ішкі энергия және энтальпия өзгерістері үшін төмендегідей теңдіктер алынады:
∆U = ∆F
+ T∆S
∆H =∆G + T∆S
Осы теңдіктерден көрінгендей ішкі энергия өзгерісі екі құрамдастан тұрады: физикалық-химиялық әрекеттесуге жұмсалатын бос энергия ∆F және қоршаған ортаға жылу ретінде таралып кететін байланысқан энергия Т∆S.
Осы тұрғыдан қарағанда энтальпия өзгерісі ∆H та сәйкес екі құрамдастан тұрады: бос энергия ∆G және байланысқан энергия Т∆S.
Слайд 10
∆F бос энергиясы T = const, V = const кездегі процестерге тән. Оны
Гельмгольц бос энергиясы деп айтады. ∆G бос энергиясы T = const, Р = const жағдайда орын алатын процестерге тән. Оны Гиббс бос энергиясы деп атайды.
Химиялық технологиялық процестерді талдағанда ∆F және ∆G мәндері төмендегідей болуы мүмкін
∆F > 0 ∆G > 0
∆F = 0 ∆G = 0
∆F < 0 ∆G < 0
Слайд 11Осыдан төмендегідей қорытындылар жасауға болады:
а) ∆F > 0; ∆G > 0 мәндерінде қарастырылып
отырған процесс тура бағытта орын алмайды;
б) ∆F = 0; ∆G = 0 мәндерінде қарастырылып отырған процесс тепе-теңдік жағдайда;
в) ∆F < 0; ∆G < 0 мәндерінде қарастырылып отырған процесс тура бағытта орын алады;
г) ∆F пен ∆G ның абсолюттік сандық мәндері неғұрлым үлкен болса процесс соғұрлым нәтижелі жүреді.
Слайд 12Жоғарыда келтірілген термодинамикалық потенциалдар ∆U, ∆H, ∆F, ∆G өзара белгілі бір заңды байланыста.
Ол байланыстарды Т, Р, V, S-лық қалыптық көрсеткіштерді пайдаланып қорытындылап шығаруғы болатын сипаттамалық термодинамикалық функциялар негізінде көрсетуге болады.
Мысалыға, ішкі энергия өзгерісі үшін термодинамиканың I бастамасы бойынша :
dQ = dU + dA = dU +PdV
Ал термодинамика екінші бастамасынан белгілі болғандай
dQ/Т = dS осыдан dQ=TdS
яғни TdS = dU + PdV болады
немесе dU = TdS – PdV Мұнда қалыпты көрсеткіштер S және V.
Слайд 13 Күрделі жүйелердегі химиялық тепе-тендік
Химиялық тепе-тендік тұрақтысы. Біртекті және әртекті реакциялардың химиялық тепе-тендік
тұрақтысын есептеу тәсілдері. Тепе-тендік калыпқа әсер етуші факторлар: температура, қысым, әрекеттесуші заттар арасындағы бастапқы қатынас. Тепе-тендікке жуықтаудың шынайы дәрежесі.
 Бензин. Производство бензина
Бензин. Производство бензина Понятие об алкинах
Понятие об алкинах Строение и свойства циклоалканов
Строение и свойства циклоалканов Гигиена питания школьников
Гигиена питания школьников Средние породы
Средние породы Тему Соли. Нитрат серебра(I) AgNO3
Тему Соли. Нитрат серебра(I) AgNO3 Общие свойства кислот
Общие свойства кислот Почва. Интегрированный урок по химии и географии
Почва. Интегрированный урок по химии и географии Готовимся к экзамену по химии. 9 класс
Готовимся к экзамену по химии. 9 класс Розв’язування задач на приготування розчинів із кристалогідратів
Розв’язування задач на приготування розчинів із кристалогідратів Оксиды. Физические и химические свойства
Оксиды. Физические и химические свойства Водород, получение, свойства и применение
Водород, получение, свойства и применение Нанохимия
Нанохимия Текстуры метаморфических пород
Текстуры метаморфических пород Классификация химических элементов
Классификация химических элементов Спирттер мен фенолдар
Спирттер мен фенолдар Предмет химии. Вещества
Предмет химии. Вещества Карбонові кислоти
Карбонові кислоти Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Свойства катализатора. Влияние массы катализатора на скорость реакции
Свойства катализатора. Влияние массы катализатора на скорость реакции Мембранный транспорт ионов: электродиффузионная теория
Мембранный транспорт ионов: электродиффузионная теория Типы химических реакций
Типы химических реакций №2 Практикалық жұмыс. Химиялық реакция жылдамдығына әртүрлі факторлардың әсерін зерттеу
№2 Практикалық жұмыс. Химиялық реакция жылдамдығына әртүрлі факторлардың әсерін зерттеу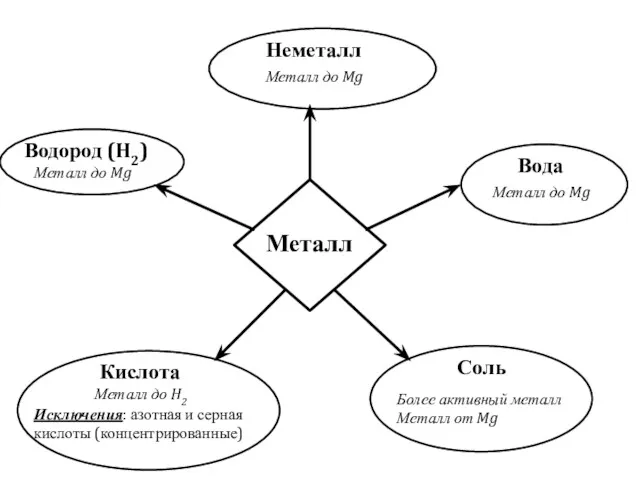 Химические свойства металлов
Химические свойства металлов Алкины. 10 класс
Алкины. 10 класс Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн
Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн Своя игра по химии
Своя игра по химии Медь и её сплавы
Медь и её сплавы