Содержание
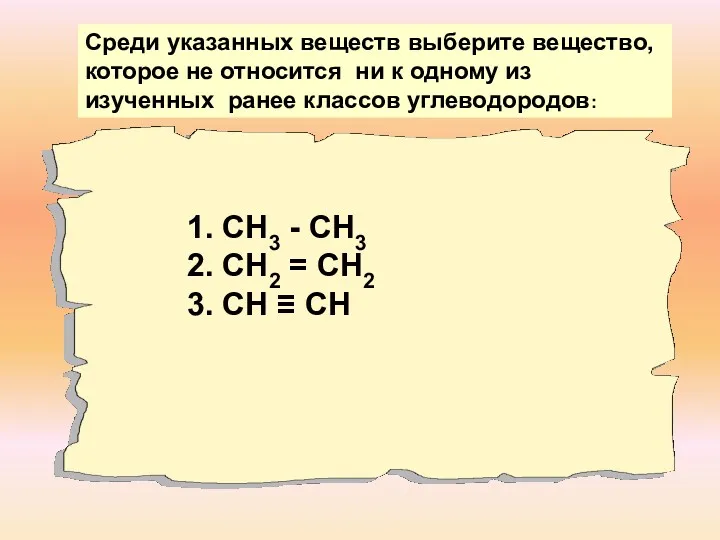
- 2. 1. СН3 - СН3 2. СН2 = СН2 3. СН ≡ СН Среди указанных веществ выберите
- 3. Понятие об алкинах Алкины – углеводороды, содержащие в молекуле одну тройную связь между атомами углерода, а
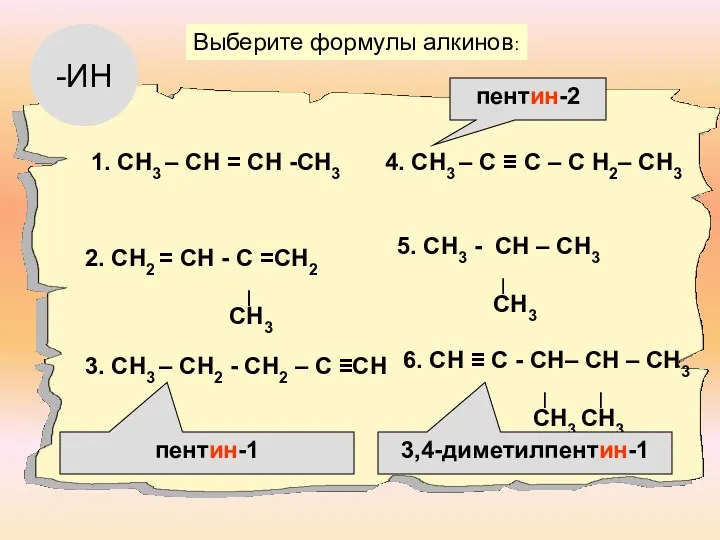
- 4. Из приведенного перечня веществ выпишите в тетрадь алкины и дайте им названия по номенклатуре IUPAC
- 5. Гомологический ряд алкинов C2H2 C3H4 C4H6 C5H8 C6H10 C7H12 Этин Пропин Бутин Пентин Гексин Гептин
- 6. 1) изомерия углеродного скелета (начиная с C5H8) CH≡C-CH2-CH2-CH3 CH≡C- CH(CH3)- CH3 пентин-1 3-метилбутин-1 2) изомерия положения
- 7. Физические свойства Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении
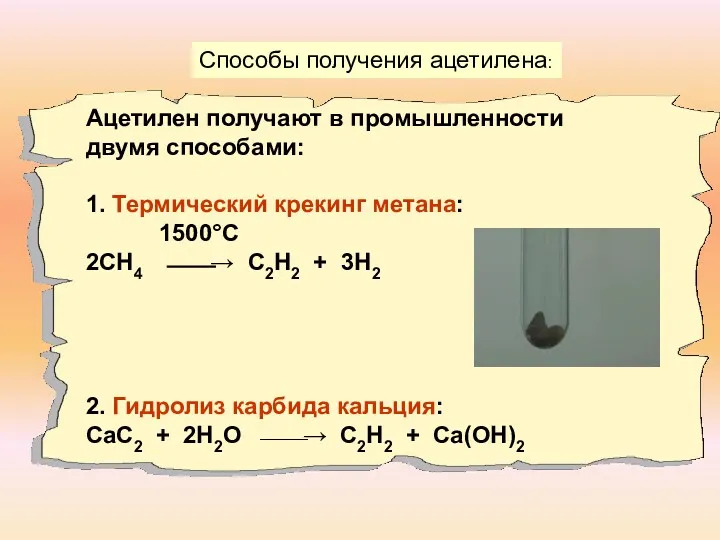
- 8. Способы получения ацетилена: Ацетилен получают в промышленности двумя способами: 1. Термический крекинг метана: 1500°С 2СН4 ⎯⎯→
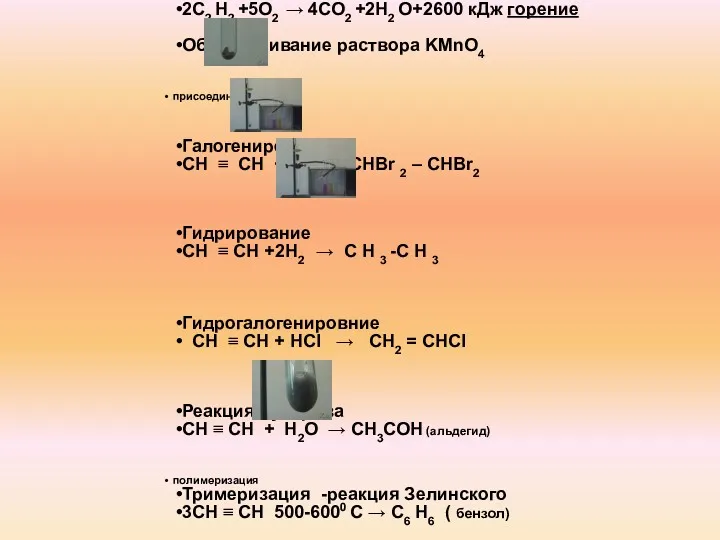
- 9. Химические свойства алкинов окисление 2С2 Н2 +5О2 → 4СО2 +2Н2 О+2600 кДж горение Обесцвечивание раствора KMnO4
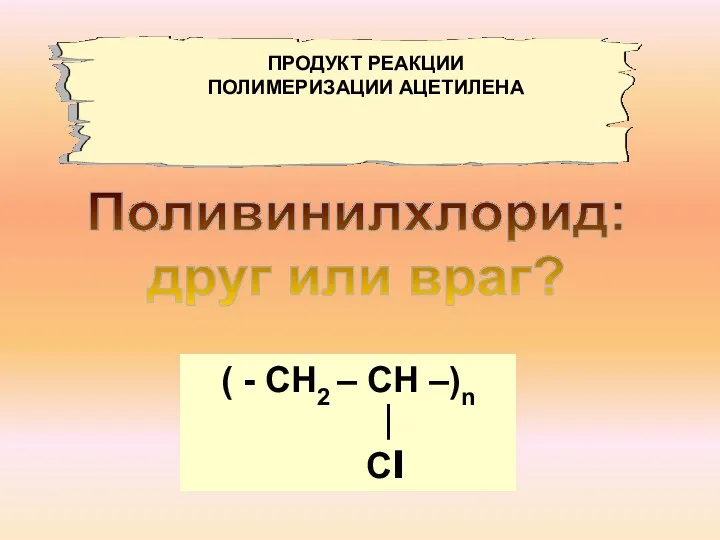
- 10. Поливинилхлорид: друг или враг? ( - СН2 – СН –)n ∣ Сl ПРОДУКТ РЕАКЦИИ ПОЛИМЕРИЗАЦИИ АЦЕТИЛЕНА
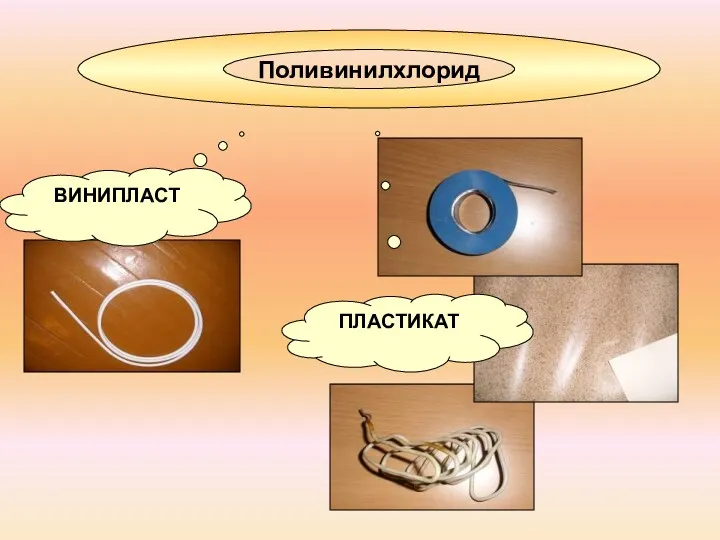
- 11. Поливинилхлорид ПЛАСТИКАТ ВИНИПЛАСТ
- 12. ПОЛИВИНИЛХЛОРИД Углекислый газ Хлорорганические соединения Вода ЯД! НЕ СЖИГАТЬ!
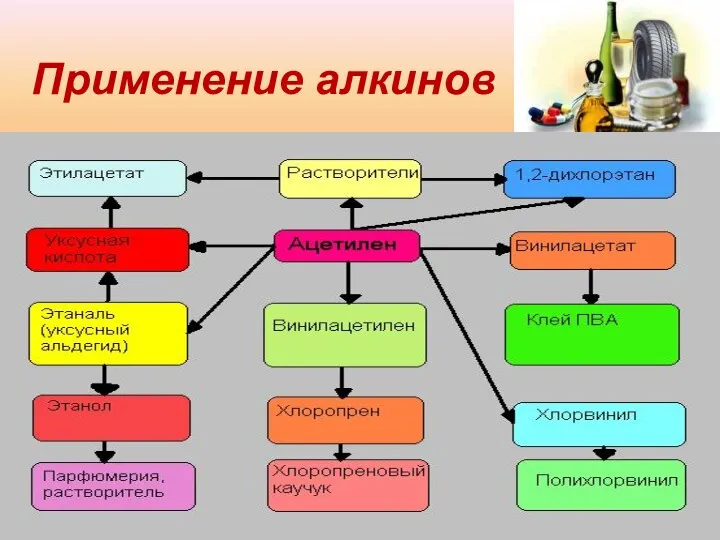
- 13. Применение алкинов
- 14. 1. СН3 – СН = СН -СН3 2. СН2 = СН - С =СН2 ∣ СН3
- 16. Скачать презентацию






 Предельные одноатомные спирты
Предельные одноатомные спирты Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов
Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов Химические реакции
Химические реакции Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары
Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары Композиционные материалы для изоляции электрических машин
Композиционные материалы для изоляции электрических машин Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері
Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері Твердость минералов и их применение
Твердость минералов и их применение Строение атома
Строение атома Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы
Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы Теорія горіння та вибуху
Теорія горіння та вибуху Основы химмотологии моторных топлив. Тема 3
Основы химмотологии моторных топлив. Тема 3 Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Адсорбция. Раздел III
Адсорбция. Раздел III Кислоты. Определение и классификация
Кислоты. Определение и классификация Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Благородные металлы
Благородные металлы Альдегиды и кетоны
Альдегиды и кетоны Классификация органических соединений
Классификация органических соединений Оксикислоты (гидроксикислоты)
Оксикислоты (гидроксикислоты) Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Химиялық жарыс кеші
Химиялық жарыс кеші Химическая термодинамика
Химическая термодинамика Сложные эфиры. Жиры
Сложные эфиры. Жиры Дефекты в твердых телах
Дефекты в твердых телах Water
Water Элемент цинк
Элемент цинк