Содержание
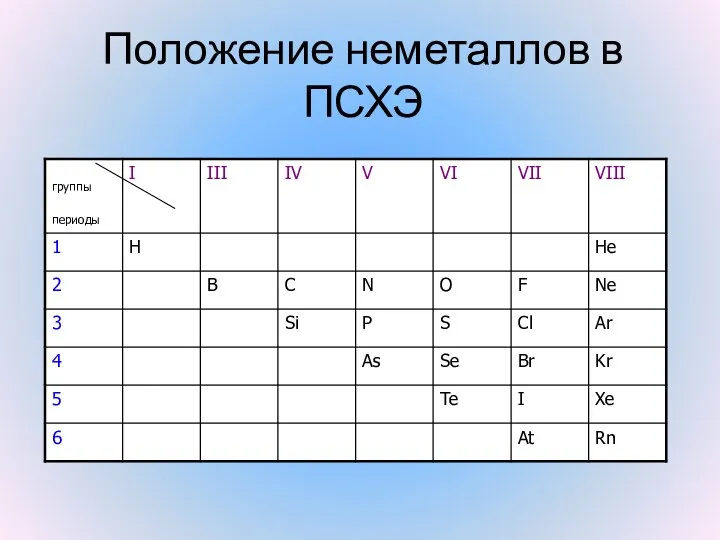
- 2. Положение неметаллов в ПСХЭ
- 3. Особенности атомного строения неметаллов Небольшой атомный радиус На внешнем уровне 4-8 электронов Располагаются только в главных
- 4. Электроотрицательностью называют способность атома при образовании химической связи оттягивать валентные электроны от атомов других элементов.
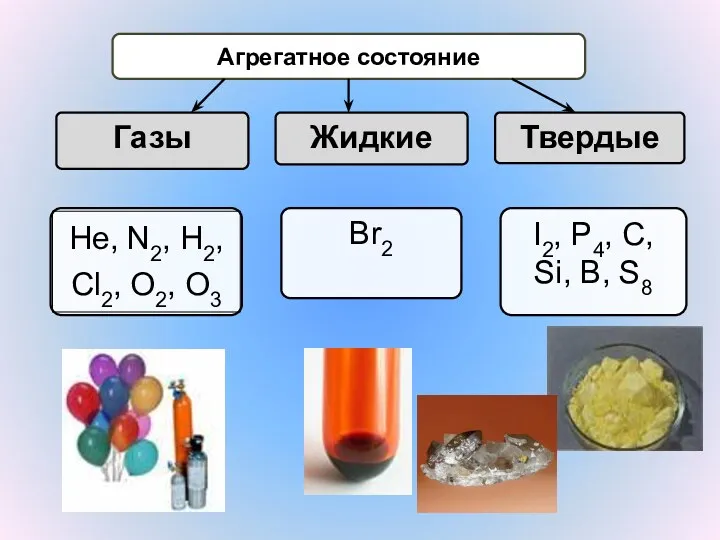
- 5. ФИЗИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
- 6. Агрегатное состояние Газы Жидкие Твердые Br2 I2, P4, C, Si, B, S8
- 7. Твёрдое вещество – неметалл - йод
- 8. Цвет неметаллов БЕЛЫЙ ЧЕРНЫЙ ФОСФОР ФОСФОР ГРАФИТ ЖЕЛТО-ЗЕЛЕНЫЙ ХЛОР
- 9. Цвет неметаллов КРАСНЫЙ ЖЕЛТЫЙ ФИОЛЕТОВЫЙ ФОСФОР СЕРА ЙОД БЕСЦВЕТНЫЙ УГЛЕРОД
- 10. Температура плавления 3 8000 С – у графита - 2100 С - азота
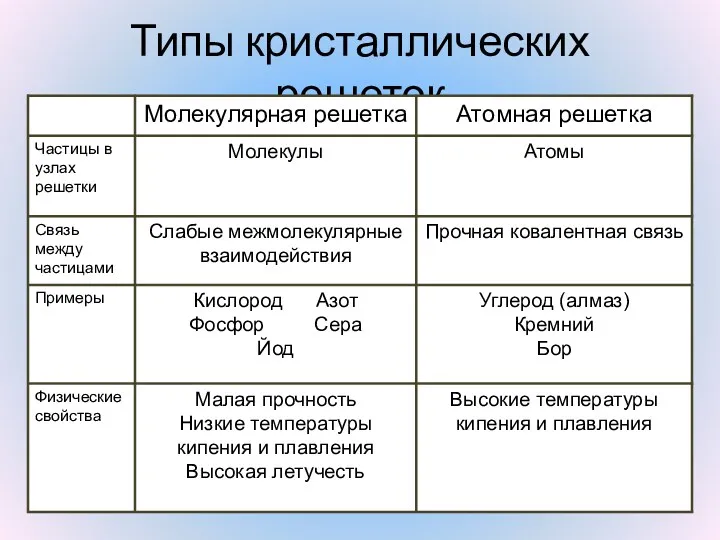
- 11. Типы кристаллических решеток
- 12. Способность атомов одного химического элемента образовывать несколько простых веществ называют аллотропией, а эти простые вещества –
- 13. Аллотропия Разные типы кристаллических решеток Р - фосфор Красный фосфор – атомная кристаллическая решетка Белый фосфор
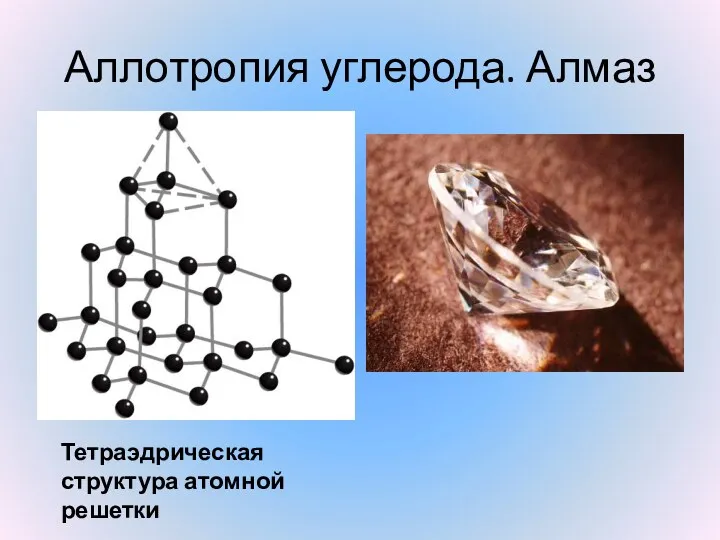
- 14. Аллотропия углерода. Алмаз Тетраэдрическая структура атомной решетки
- 15. Аллотропия углерода. Графит Слоистая структура атомной решетки
- 16. Аллотропия Разный состав молекул О - кислород Кислород Озон Кислород и озон – это аллотропные видоизменения
- 17. Химические свойства неметаллов Взаимодействие с металлами Na + H2 = Ca + P = Li +
- 18. 2. Взаимодействие с водородом: Н2 + S = Н2 + N2 = Н2 + Cl2 =
- 19. 3. Взаимодействие с другими неметаллами: S + Cl2 = S + H2 = S + O2
- 20. 4. Взаимодействие со сложными веществами: NaBr + Cl2 = 2H2S + O2 = FeCl2 + Cl2
- 21. Способы получения неметаллов Zn + H2SO4 = C + Н2О = СО + Н2↑ 2КМnO4 →
- 23. Скачать презентацию
















 Химическая промышленность
Химическая промышленность Охрана труда в кабинете (лаборатории) химии образовательного учреждения
Охрана труда в кабинете (лаборатории) химии образовательного учреждения Сплавы на основе железа. Диаграмма состояния сплавов системы железо–углерод. Лекция 2. Тема 4
Сплавы на основе железа. Диаграмма состояния сплавов системы железо–углерод. Лекция 2. Тема 4 Углеводы. Молекулярные формулы
Углеводы. Молекулярные формулы Кристалл. Основные законы кристаллографии
Кристалл. Основные законы кристаллографии становление органической химии
становление органической химии Дисперсные системы в медицине и пищевой промышленности
Дисперсные системы в медицине и пищевой промышленности Кинетика химических реакций. Химическое равновесие
Кинетика химических реакций. Химическое равновесие Властивості елементів IІВ групи та їх сполук
Властивості елементів IІВ групи та їх сполук 20231110_elektroliz
20231110_elektroliz Химический состав клетки. Неорганические вещества
Химический состав клетки. Неорганические вещества Составление химических формул бинарных соединений по степени окисления атомов
Составление химических формул бинарных соединений по степени окисления атомов Галогены. Положение галогенов в ПСХЭ
Галогены. Положение галогенов в ПСХЭ Состав газированной воды
Состав газированной воды Ферментативный катализ, влияние давления, концентрации и катализаторов на скорость химической реакции
Ферментативный катализ, влияние давления, концентрации и катализаторов на скорость химической реакции Чистые вещества и смеси
Чистые вещества и смеси Марганец
Марганец Галогены
Галогены Лекция 3. Гидроксисоединения. Карбонильные соединения
Лекция 3. Гидроксисоединения. Карбонильные соединения Растворы ВМС
Растворы ВМС Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы Рафинирование металлических расплавов
Рафинирование металлических расплавов Чипсы: польза или вред. Химия
Чипсы: польза или вред. Химия Гідроліз солей
Гідроліз солей Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства Химия. D-элементтер
Химия. D-элементтер Основания. 8 класс
Основания. 8 класс Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева